赤霞珠葡萄梗原花青素的表征及其抗氧化活性研究
李彩霞,焦 扬,崔 玮*,张 勇,高海宁
(1.河西学院 生命科学与工程学院,甘肃 张掖 734000;2.甘肃省高校河西走廊特色资源利用省级重点实验室,甘肃 张掖 734000)
原花青素广泛存在于各种植物核、皮或种籽中,是由单体黄烷-3-醇类物质以不同聚合度连接而成的多酚类化合物[1]。研究证明,原花青素具有抗氧化、清除自由基[1-2]、抗肿瘤、抗心肌缺血、抗炎症,抑制阿尔兹海默症、动脉粥样硬化,护肝解毒、抗菌、美白皮肤、调节免疫等多种药理活性[2-6],主要应用于食品、化妆品和药品等领域。
葡萄梗是葡萄深加工中的主要废弃物,资源丰富,并含有大量的原花青素、单宁等多酚类物质[7-8]。目前对葡萄梗的研究和开发主要集中于单宁、多酚的提取和测定[9]。而葡萄梗作为葡萄加工工序中的第一道废弃物,其研究价值尚未引起人们的重视。据统计,生产100 L红葡萄酒可产生25 kg的果渣,其中葡萄梗占4 kg[10],葡萄采摘时也有大量的葡萄梗因被丢弃而造成资源的大量浪费。葡萄梗资源丰富,若能采用现代技术对原花青素等成分进行提取和纯化,并研发成抗氧化剂,既能充分利用该资源,又能减少环境污染。
本研究采用超声辅助双水相从赤霞珠葡萄梗中提取原花青素,提取液浓缩后经AB-8大孔吸附树脂纯化,通过红外和紫外光谱对原花青素提取物进行表征,并检测葡萄梗原花青素对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid,ABTS)自由基、羟基自由基(·OH)和H2O2的清除作用,以及总抗氧化力和酪氨酸酶的抑制活性,旨在为葡萄梗资源在保健品和化妆品领域的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
葡萄梗:由甘肃省滨河食品有限公司提供(原料来源于张掖板桥庄园),将样品去除杂质,清洗阴干,粉碎过60目筛。
无水乙醇、氢氧化钠、浓盐酸、过硫酸铵、香草醛等(均为分析纯):天津市科密欧化学试剂有限公司;甲醇(色谱纯):天津市光复科技有限公司;儿茶素、原花青素(纯度≥98%):上海金穗生物科技有限公司;总抗氧化力试剂盒:南京建成生物工程研究所;AB-8大孔树脂:南开大学化工厂。
1.2 仪器与设备
DR6000型紫外可见分光光度计:美国哈希公司;MiLLROCK型冷冻干燥机:美国米尔洛克公司;SHB-ⅢA型循环水式多用真空泵:郑州长城科工贸有限公司;KQ-250B型超声波清洗器:昆山市超声仪器有限公司;BT600F恒流泵:雷弗流体科技有限公司;Nicolet iS50型红外光谱仪:美国Thermo Scientific公司;Φ3.5×40 cm层析柱:上海亚荣生化仪器厂。
1.3 试验方法
1.3.1 葡萄梗原花青素粗提物的制备及纯化
葡萄梗原花青素粗提物的制备及纯化[11]:配制乙醇质量分数为24%,硫酸铵质量分数为20%的双水相,按料液比1∶40(g∶mL)加入过60目筛的葡萄梗粉末,在35 ℃超声条件下(40 kHz、250 W)提取50 min后分两相,将上相减压浓缩至浆状物,冻干。将冻干后的固体研磨成粉末,密封保存。
葡萄梗原花青素粗提物的纯化:采用湿法装柱[12],将处理好的AB-8树脂装入Φ3.5 cm×40 cm的层析柱,柱床体积为86.55cm3,按10倍的柱床体积上样(粗提物质量浓度6mg/mL,pH=6),以0.5 mL/min流速上样至动态吸附饱和后,用4倍的蒸馏水洗柱,至流出液澄清,然后用体积分数70%的乙醇作为解吸剂,以0.5 mL/min流速解吸至解吸液为无色,将体积分数70%的乙醇洗脱液减压浓缩至原体积的1/10,冷冻干燥,得原花青素褐色粉末,保存备用。并测定纯化前后样品中原花青素的质量,按下式计算纯化倍数:

1.3.2 原花青素含量的测定
根据文献[13-14]并稍作修改。准确称取儿茶素20 mg,用无水甲醇溶解并定容100 mL,配制成0.2 mg/mL的儿茶素标准溶液,分别吸取儿茶素标准溶液0、0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL,无水甲醇补充至0.5 mL,依次加入4%香草醛溶液3.0 mL,1.50 mL浓盐酸,各管避光反应15 min,以试剂空白为对照,在波长500 nm处测定吸光度值。以吸光度值(y)为纵坐标,儿茶素含量(x)为横坐标,制作标准曲线,求得回归方程为y=4.985x+0.021 5,R2=0.999 3。
提取物中原花青素的测定:称取葡萄梗粗提物和纯化品各50 mg,用体积分数70%的乙醇溶解并定容至50 mL。吸取0.5 mL(纯化样品吸取0.1 mL),根据标准曲线制作的方法测定的吸光度值,按以下公式计算原花青素的含量:
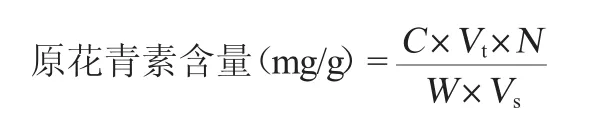
式中:C为标准曲线上查得的原花青素含量,mg;Vt为原花青素提取液总体积,mL;N为样品的稀释倍数;W为样品的质量,g;Vs为测定时所取溶液的体积,mL。
1.3.3 样品纯化前后原花青素紫外光谱和红外光谱表征
将1.3.1节制备的样液分别稀释15倍,采用紫外可见分光光度计在波长200~400 nm范围内进行扫描,根据峰型的高低进一步确定纯化的效果。
红外光谱表征:傅立叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)用于确定生物表面活性剂提取物中存在的官能团和化学键,然后确定其化学性质。将1.3.1制备的样品使用Nicolet iS50型FT-IR光谱仪ATR附件实现FT-IR分析,在波数4 000~650 cm-1范围内扫描纯化前后葡萄梗原花青素的红外光谱图。
1.3.4 原花青素提取物的抗氧化活性检测
原花青素提取物对DPPH自由基(DPPH·)的清除活性:根据文献[15]稍有改动。分别吸取1 mL不同质量浓度(10 μg/mL、20 μg/mL、30 μg/mL、40 μg/mL、50 μg/mL)的样品和阳性对照(20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL的原花青素溶液),加入1 mL体积分数70%的乙醇和2 mL的DPPH溶液(0.15 mmol/L)为测定组,2 mL体积分数70%的乙醇和2 mL的DPPH溶液为对照组,混合均匀,避光30 min后,在波长517 nm处测定吸光度值,按下式计算DPPH·的清除率:
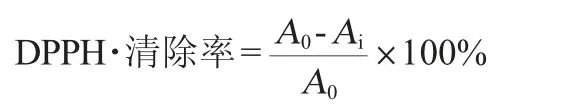
式中:A0为未加原花青素溶液对照组吸光度值;Ai为加原花青素溶液吸光度值。
葡萄梗原花青素对ABTS自由基(ABTS+·)的清除活性:ABTS自由基的清除作用根据文献[16]稍有改动。分别吸取测定DPPH自由基的清除活性时配制的溶液各0.1 mL,加入2.3 mL体积分数70%乙醇和0.6 mL ABTS溶液为测定组,2.4 mL体积分数70%乙醇和0.6 mL ABTS溶液为对照组,摇匀,避光反应6 min后,在波长734 nm处测定吸光度值,按下式计算ABTS+·的清除率:

式中:A0为未加原花青素溶液对照组吸光度值;Ai为加原花青素溶液吸光度值。
原花青素提取物对H2O2的清除活性:原花青素溶液对H2O2清除能力测定参考文献[17]稍作修改。配制40 mmol/L过氧化氢溶液,吸取600 μL过氧化氢溶液和100 μL不同质量浓度的试样(20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL),然后用蒸馏水补至3 mL并摇匀,在室温条件下反应30 min为样品管,以等体积的体积分数70%乙醇代替样品为对照管,空白调零管为2.9 mL蒸馏水和100 μL体积分数70%乙醇溶液。以相应浓度的原花青素为阳性对照,反应结束后以空白管调零分别在波长230 nm处测定各反应管溶液的吸光度值,吸光度值越低,样品对H2O2的清除活性就越高。按以下公式计算H2O2的清除率:
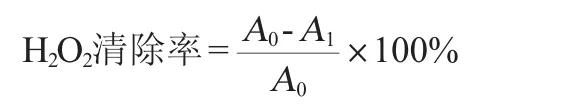
式中:A0为空白组吸光度值,A1为含样品溶液吸光度值。
葡萄梗原花青素对羟基自由基(·OH)的清除作用的测定:参照文献[18],FeSO4与H2O2反应生成·OH。水杨酸可以捕获自由基,510 nm处的吸光度值的降低可用于评从原花青素清除·OH能力。精确取1 mL质量浓度为20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL的样品溶液,加入1 mL 10mmol/L的FeSO4、1mL10mmol/L的H2O2,混匀,静置10 min 再加入1 mL 10 mmol/L水杨酸混匀,37 ℃反应30 min,在波长510 nm处测量反应溶液的吸光度值A1,以1 mL体积分数70%的乙醇代替样品溶液对照管测量吸光度值A0。按下式计算·OH的清除率:
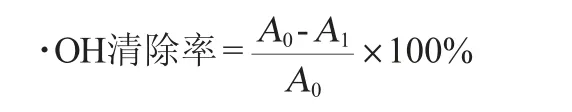
式中:A0、A1分别为空白溶液和样品溶液的吸光度值。
总抗氧化能力的测定:严格按照总抗氧化能力试剂盒操作,总抗氧化能力的定义:在37 ℃时,每分钟每毫升不同质量浓度的提取液和阳性对照溶液,使反应体系的吸光度(OD)值每增加0.01时,为一个总抗氧化能力单位(U)。总抗氧化力以下式计算:

葡萄梗原花青素对酪氨酸酶抑制活性的测定:蘑菇酪氨酸粗酶提取液的制备参照文献[19],称取新鲜的双孢蘑菇50 g切成小块置于研钵中加入0.2 moL/L内含1%聚乙烯吡咯烷酮的磷酸缓冲盐溶液(phosphate buffer saline,PBS)(pH=6.8)50mL,迅速置于冰浴中进行研磨,研磨成浆后再加入PBS溶液100mL,在冰浴中提取1h,在4℃、10000r/min离心20 min,取其上清液即为得到蘑菇酪氨酸粗酶提取液。
酪氨酸酶活性的测定参照文献[20]。在试管中依次加入2.9 mL PBS溶液,2 mmol/L的L-左旋多巴(L-levodopa,L-DOPA)(pH=6.8的PBS配制)0.8 mL,再加入0.3 mL酪氨酸酶溶液为实验组,用0.3 mL缓冲液代替酶液为空白对照调零,在475 nm处,并每隔30 s测定1次吸光度值,测定6 min,并制作酶活性随时间的动力学曲线。酪氨酸酶活性的定义:在测定条件下以每分钟多巴醌在波长475 nm的吸光度值增加0.001为一个酶活单位(U)。
葡萄梗原花青素对酪氨酸酶的抑制作用:在0.2 mol/L的PBS(pH=6.8)中,按表1顺序加入缓冲液、提取液、酪氨酸酶液,最后各管加入质量浓度为2 mmol/L的L-多巴溶液,在波长475 nm处测定4 min内的吸光度变化值,按下式计算酪氨酸酶的抑制率:

表1 反应液组成与体积Table 1 Composition and volume of reaction solution
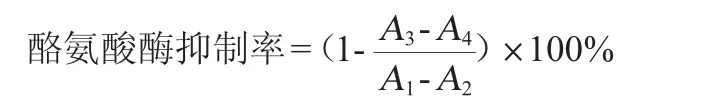
式中:A1为不加提取液空白管的吸光度值;A2为不加提取液和酶液的空白对照管的吸光度值;A3为加提取液和酶液的吸光度值;A4为不加酶液对照管的吸光度值。
1.3.5 数据统计与处理
采用Excel 2003软件处理数据,用Origin 8.5软件作图,实验数据均为3个重复的平均值加标准差。
2 结果与分析
2.1 赤霞珠果梗原花青素纯化前后比较
2.1.1 赤霞珠果梗纯化样品中原花青素的纯度
经计算纯化后样品中原花青素的含量为487.80 mg/g,与纯化前原花青素的含量(81.11mg/g)比较增加了406.69mg/g,其纯化倍数为6.01,由此说明AB-8树脂对赤霞珠果梗原花青素的纯化是非常有效的。
2.1.2 原花青素的紫外光谱
由图1可以看出,纯化前后葡萄梗原花青素的体积分数70%的乙醇溶液在波长279 nm处均具有特征峰,在300~325 nm内无吸收,250~260 nm具波谷(257 nm)。这可能是原花青素结构单元含A和B两个共轭苯环,其上有多个羟基取代,使苯环的B带(波长255 nm处)显著红移,光谱图与微波法提取的葡萄籽原花青素的全波长扫描光谱一致[21],在280 nm处出现的儿茶素的特征吸收峰,说明葡萄梗原花青素主要是由儿茶素和表儿茶素组成的原花青素类[22-23],且纯化物特征峰明显高于未纯化的提取物,由此说明,AB-8大孔树脂对葡萄梗中原花青素的纯化效果非常显著。
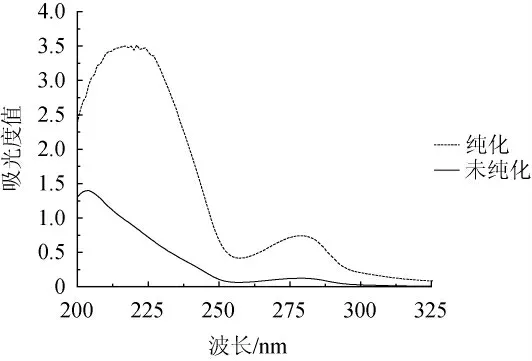
图1 纯化前后样品的紫外光谱Fig.1 Ultraviolet spectra of samples before and after purification
2.1.3 纯化前后样品的红外光谱
由图2可知,纯化前后样品的红外光谱差异明显,纯化后样品在3 208 cm-1处的吸收峰是-OH的伸缩振动带,波长1 600 cm-1,1 523 cm-1,1 432 cm-1是苯环骨架的特征吸收峰,波长1 279 cm-1,1 120 cm-1,1 036 cm-1是C-O-C的伸缩振动带,在1 520~1 540 cm-1处有一个单峰(1 523 cm-1),在低频指纹区780 cm-1~730 cm-1范围内只有一个峰(764 cm-1),根据B环上羟基的数量的不同,将多聚原花青素分为以原翠雀定(B环含3个羟基)为主的结构单元,或者B环含有2个羟基的原花青定为主的结构单元,原翠雀定的红外特征吸收峰在振动频率区(1 540~1 520 cm-1)处有2个吸收峰,且在730 cm-1左右有强吸收峰[23-24]。该图谱显示,在振动频率区(1 540~1 520 cm-1)处只有1 523 cm-1一个吸收峰,在低频指纹区(780~730 cm-1)范围内只有764 cm-1一个峰,在730 cm-1附近无吸收谱带,由此推测,赤霞珠葡萄梗纯化物是以原花青定为主要结构单元的原花青素。
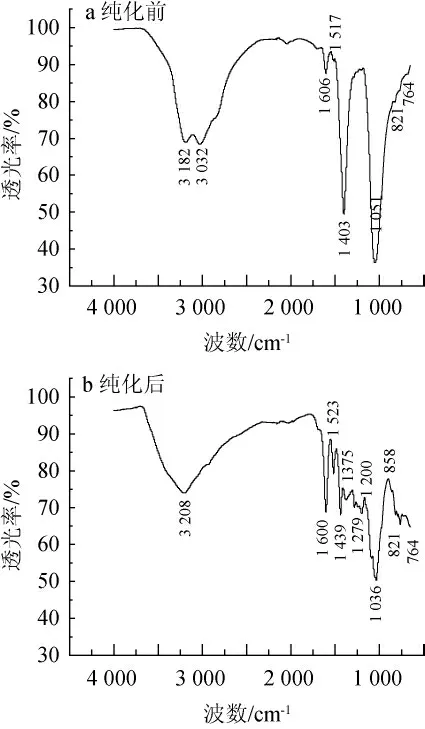
图2 纯化前(a)后(b)样品的红外光谱Fig.2 Infrared spectra of samples before (a) and after (b) purification
2.2 抗氧化活性的检测
2.2.1 葡萄梗原花青素对DPPH·的清除活性
自由基与机体的衰老有密切关系,DPPH·是一种稳定的有机自由基,自由基清除剂可与DPPH反应,使其醇溶液紫色减弱,在波长517 nm处的吸光度值降低,该方法可用于检测待测物的抗氧化性[25]。由图3可知,葡萄梗原花青素与对照原花青素对DPPH·均有一定的清除作用,且随着质量浓度的增加,对DPPH·的清除率也随着增大,在葡萄梗原花青素质量浓度40 μg/mL时,对DPPH·清除率为77.02%,而对照质量浓度为40 μg/mL,其清除率为62.05%,说明葡萄梗原花青素对DPPH·的清除活性高于对照。
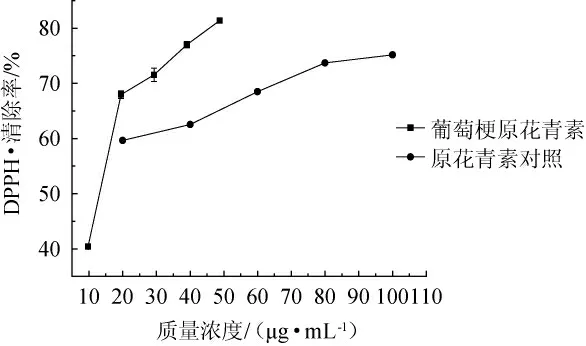
图3 葡萄梗原花青素对DPPH自由基的清除作用Fig.3 Scavenging effect of proanthocyanidins from grape stalks on DPPH free radical
2.2.2 葡萄梗原花青素对ABTS+·的清除活性
ABTS+·清除法是通过比色法来测定样品的抗氧化活性,ABTS 试剂在氧化剂作用下会形成绿色的ABTS+·,在抗氧化物存在时ABTS+·的产生会被抑制,在波长734 nm处的吸光度降低。此法具有操作快速、简单、高通量等优点,是目前评价天然产物抗氧化活性常用的方法[26]。由图4可知,随着葡萄梗原花青素与对照原花青素质量浓度的增加,对ABTS+·的清除作用均在增大,在葡萄梗原花青素质量浓度为40 μg/mL时对ABTS+·的清除率为98.15%,而对照浓度为40 μg/mL,其清除率为97.82%,该数据表明葡萄梗原花青素对ABTS+·的清除作用高于对照。
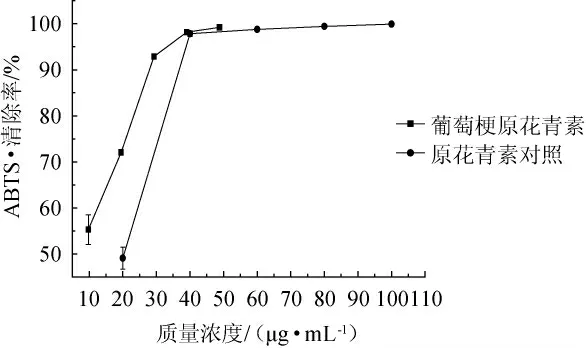
图4 葡萄梗原花青素对ABTS自由基的清除作用Fig.4 Scavenging effect of proanthocyanidins from grape stalks on ABTS free radical
2.2.3 葡萄梗原花青素对H2O2的清除活性
H2O2可导致人机体遗传物质的损伤,基因突变,加速人体的衰老进程。由图5可以看出,葡萄梗原花青素与原花青素对照对H2O2的抑制率随着浓度的增加而逐渐增大,在质量浓度达40 μg/mL时,抑制效果分别达到10.78%和8.89%。由此数据可知,在低浓度时葡萄梗提取物原花青素对H2O2自由基的清除作用稍高于对照,而在高浓度时,低于对照。
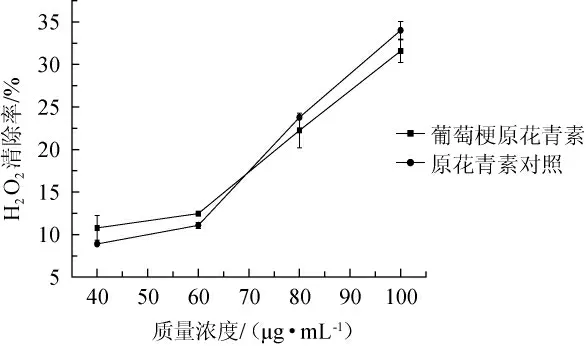
图5 葡萄梗原花青素对H2O2的清除作用Fig.5 Scavenging effect of proanthocyanidins from grape stalks on H2O2
2.2.4 葡萄梗原花青素对·OH的清除能力
·OH对人体的攻击首先是从细胞膜开始的,一旦细胞膜破坏就会导致心血系统疾病,更严重的话会导致基因突变,从而引起发生系统性的混乱。由图6可以看出,葡萄梗原花青素和对照品对·OH的抑制率随着原花青素的浓度的增加而逐渐增大,在质量浓度达40 μg/mL时,其抑制分别为57.63%和50.8%。说明,葡萄梗原花青素对·OH有抑制作用,其抑制作用高于对照。

图6 葡萄梗原花青素对羟基自由基的清除作用Fig.6 Scavenging effect of proanthocyanidins from grape stalks on hydroxyl radical
2.2.5 葡萄梗原花青素的总抗氧化能力
由图7可知,葡萄梗原花青素和对照原花青素的总抗氧化力随着质量浓度的增加逐渐增强,并呈正相关,相关性分别为y梗=0.690 7x+19.471,R2=0.964 6;y对=0.405 6x+0.045 7,R2=0.986 7。在葡萄梗原花青素和对照的质量浓度为40 μg/mL时,总抗氧化力分别为49.31 U/mL、15.98 U/mL。总体而言,对照原花青素的总抗氧化力不及葡萄梗原花青素。
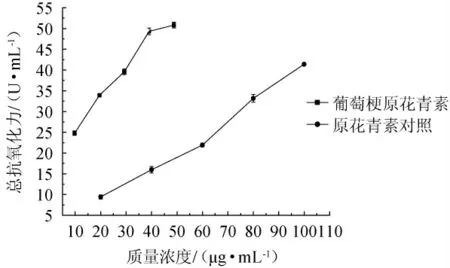
图7 葡萄梗原花青素的总抗氧化能力Fig.7 Total antioxidant capacity of proanthocyanidins from grape stalks
2.2.6 葡萄梗原花青素对酪氨酸酶的抑制作用
由图8可知,在4~5 min时,其酶活力最高,在0~4 min范围内,酪氨酸酶活性与时间呈相关性,y=1.489 9x+197.94,相关系数R2=0.980 6,因此,在研究提取物对酪氨酸酶的抑制作用时测定4 min内的吸光度变化值。
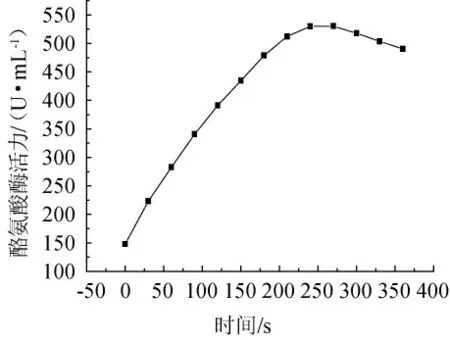
图8 酪氨酸酶促动力曲线Fig.8 Kinetic curve of tyrosinase activity
酪氨酸酶是人体中黑色素生成代谢与儿茶酚胺密切相关的关键限速酶,酪氨酸酶活性物质已在治疗色素障碍类疾病、防腐保鲜、美白和乌发等方面得到了广泛的应用[27]。由图9可知,随着葡萄梗原花青素和对照原花青素质量浓度的增加对酪氨酸酶抑制活性也在增加,且呈正相关,y梗=1.2145x-4.7965,R2=0.9801;y对照=0.743 2x-8.076 6,R2=0.981 3。在葡萄梗原花青素40 μg/mL时对酪氨酸酶的抑制率为43.78%,而对照质量浓度为40μg/mL时,其抑制率为24.37%。以上结果表明,葡萄梗原花青素对酪氨酸酶的抑制作用强于对照,因此,具有良好的美白活性。
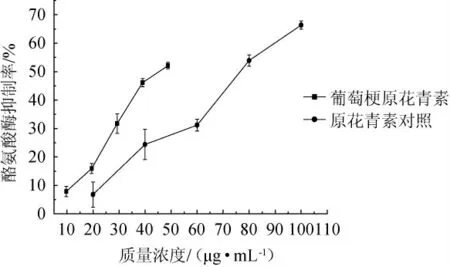
图9 葡萄梗原花青素对酪氨酸酶的抑制作用Fig.9 Inhibitory effect of proanthocyanidins from grape stalks on tyrosinase
2.3 酪氨酸酶抑制率与抗氧化之间的相关性分析
原花青素对酪氨酸酶的抑制率与DPPH·、ABTS+·、·OH清除率、H2O2还原力及总抗氧化力之间的相关性见图10。由图10可知,随着酪氨酸酶抑制活性的增加,·OH、DPPH·、ABTS+·、H2O2清除率及总抗氧化力也随着增加,且呈显著正相关(P<0.01),相关系数R2分别为0.860 4、0.870、0.951 2、0.951 9(P<0.05)和0.986 2,因此推断葡萄梗原花青素对酪氨酸酶抑制能力与其抗氧化有很强的关联性。可能是通过清除自由基,终止自由基链的引发,削弱酪氨酸酶反应过程中的供氧而抑制酪氨酸酶催化活性[25],也可能是原花青素与L-多巴竞争酶的结合部位,或者原花青素能与酪氨酸酶中的金属离子鳌合,从而抑制酶的活性[26],其机理需尚待进一步研究。

图10 酪氨酸酶抑制率与抗氧化活性的相关性Fig.10 Correlation between tyrosinase inhibition rate and antioxidant activity
3 结论
通过超声辅助双水相提取赤霞珠葡萄梗中原花青素、并采用AB-8大孔吸附树脂对其进行纯化,纯化后的产物中原花青素含量为487.80 mg/g,是纯化前(81.11 mg/g)的6.01倍。对纯化物进行紫外和红外扫描,均具有原花青素的特征峰,表明AB-8大孔吸附树脂纯化葡萄梗原花青素是有效的。
抗氧化表明,葡萄梗原花青素质量浓度为40 μg/mL时,对DPPH·、ABTS+·、·OH和H2O2的清除率分别为77.02%、98.15%、57.63%和10.78,对酪氨酸酶抑制率和总抗氧化力分别为43.78%和49.31 U/mL,均高于对照。说明葡萄梗原花青素具有抗氧化和酪氨酸酶抑制活性。

