基于高通量测序解析赊店老酒浓香型白酒大曲古菌群落多样性
刘延波,李海登,秦梦星,赵志军,王 贤,韩素娜,潘春梅
(1.河南牧业经济学院 食品与生物工程学院(酒业学院),河南 郑州 450046;2.河南仰韶酒业有限公司 博士后科研工作站,河南 三门峡 472400;3.河南牧业经济学院河南省白酒风格工程技术研究中心,河南 郑州 450046;4.河南牧业经济学院郑州市白酒酿造微生物技术重点实验室,河南 郑州 450046;5.赊店老酒股份有限公司,河南 南阳 473300)
大曲是白酒酿造过程中的重要物质,在白酒酿造过程中起着糖化、发酵、生香的作用[1]。大曲在制作上采用自然接种和开放式发酵[2],富集制曲环境中的各种微生物在曲坯中生长,包括细菌、真菌和古菌,它们在曲坯中彼消此长,最终形成独特的群落结构[3]。古菌相较于细菌和真菌在大曲中占比较少,但在浓香型白酒的产香过程中起着重要作用,不仅促进己酸发酵进程多产己酸,而且能增加己酸乙酯含量以及有效的降低甲醇的含量,提高酒质[4]。因此,研究大曲中古菌群落结构具有重要意义。
近几年,随着第二代测序技术的迅猛发展,高通量测序技术被广泛应用于酿酒微生物多样性研究[5],其相比于传统微生物分离、荧光原位杂交、末端限制性片段长度多态性分析和变性梯度凝胶电泳等方法具有准确定量、灵敏度高、工作量小、耗费少等优点[6-8]。
目前,在白酒酿造方面,对于古菌的研究多见于窖泥[9-12]、酒醅[13]、发酵黄水[14],但对大曲的研究较少,并且利用高通量测序技术解析浓香型白酒大曲古菌群落多样性的研究鲜见报道。因此,本研究采用高通量测序技术对赊店老酒浓香型白酒大曲的古菌群落多样性进行分析,并进行蛋白直系同源簇(clusters of orthologous groups,COG)功能预测分析,为探究中原地区大曲的制作以及白酒创新发展提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
浓香型白酒大曲样品B1:河南赊店老酒酒业有限公司。对称取样后,经破碎、过筛(20目)、混匀、缩分,于-20 ℃冰箱存放。
1.1.2 试剂
1.2 仪器与设备
Pico-21式离心机:美国Thermo Fisher公司;GL-88B漩涡混合器:海门市其林贝尔仪器制造有限公司;TND03-H-H混匀型干式恒温器:深圳拓能达科技有限公司;DYY-6C型电泳仪电源、DYCZ-21电泳槽:北京市六一仪器厂;凝胶成像系统:美国UVP公司;荧光计:赛默飞世尔科技(中国)有限公司;T100TM Thermal Cyeler 聚合酶链式反应(polymerase chain reaction,PCR)仪:美国BIO-RAD公司。
1.3 大曲基因组的提取
1.3.1 样品预处理
称取大曲样品200 mg于灭菌的2 mL离心管中,加入1 mL体积分数为70%的乙醇,振荡混匀,10 000 r/min室温离心3 min,弃上清液。加入1×磷酸盐缓冲液(phosphate buffer saline,PBS)溶液,振荡混匀,10 000 r/min室温离心3 min,弃上清液。倒置2 mL管于吸水纸上1 min,直至没有液体流出。将样品管放入55 ℃烘箱10 min,使残留酒精完全挥发[15]。
1.3.2 DNA的提取
1.3.3 PCR扩增
第一轮扩增:利用Qubit2.0 DNA检测试剂盒对基因组DNA精确定量。以基因组DNA为模板,采用引物1st-340F(5'-CCCTAYGGGGYGCASCAG-3')、1st-1000R(5'-GGCCATGCACYWCYTCTC-3')进行PCR扩增。PCR扩僧体系:2×Taqmaster Mix 5 μL、引物1st-340F(10 μmol/L)1 μL、引物1st-1000R(10 μmol/L)1 μL、基因组DNA 20 ng、双蒸水(ddH2O)补充至30 μL。PCR扩增程序:94 ℃、3 min;94 ℃、30 s,45 ℃、20 s,65 ℃、30 s(进行5个循环);94 ℃、20 s,55 ℃、20 s,72 ℃、30 s(进行20个循环);72 ℃、5 min;10 ℃保存。
第二轮扩增:以第一轮PCR扩增产物为模板,采用V3-V4通用引物349F(5'-CCCTACACGACGCTCTTCCGATCTN(barcode)GYGCASCAGKCGMGAAW-3')、806R(5'-GACTGGAGTTCCTTGGCACCCGAGAATTCCAGGACTACVSGGGTATCTAAT-3')对第一轮扩增产物进行PCR扩增。PCR扩增体系:2×Taqmaster Mix 5 μL;349F(10 μmol/L)1 μL、806R(10 μmol/L)1 μL、第一轮PCR扩增产物20 ng、ddH2O补充至30 μL。PCR扩增程序:94 ℃、3 min;94 ℃、30 s,45 ℃、20 s,65 ℃、30 s(5个循环);94 ℃、20 s,55 ℃、20 s,72 ℃、30 s(20个循环);72 ℃、5 min;10 ℃保存。
第三轮扩增:引入Illumina桥式PCR兼容引物。PCR扩增体系:2×Taqmaster Mix 5 μL、Bar-PCR primer F(10 μmol/L)1 μL;primer R(10 μmol/L)1 μL、第二轮PCR扩增产物20 ng、ddH2O水补充至30 μL。PCR扩增程序:95 ℃、3 min;94 ℃、20 s,55 ℃、20 s,72 ℃、30 s(5个循环);72 ℃、5 min;10 ℃保存。采用2%琼脂糖凝胶电泳检测,检测合格后,纯化回收DNA,利用Qubit2.0 DNA检测试剂盒对回收的DNA精确定量,按照1∶1等量混合后委托生工生物工程(上海)股份有限公司测序。
1.3.4 测序及数据分析
应用Miseq 2×300 bp测序平台进行测定,并且通过测序数据统计分析、操作分类单元(operational taxonomic unit,OTU)分析、Alpha多样性分析、物种分类学分析和COG功能预测分析等不同方面对大曲的古菌菌落多样性进行分析。
2 结果与分析
2.1 古菌16S rDNA V3-V4区基因的PCR扩增
古菌16S rDNA V3-V4区基因的PCR扩增结果见图1。由图1可知,PCR扩增产物碱基长度为500 bp左右,与目标相符,纯化回收后委托生工生物工程(上海)股份有限公司进行测序。

图1 古菌16S rDNA V3-V4区基因的PCR扩增产物琼脂糖凝胶电泳结果Fig.1 Agarose gel electrophoresis results of PCR amplified products from archaea 16S rDNA V3-V4 region
2.2 测序数据结果分析
对古菌16S rDNA V3-V4区基因序列进行高通量测序,通过barcode标签序列(5'-GCGTGTG-3')得到样本的数据,为了提高后续分析质量和可靠性,对原始序列进行去接头、质量控制(quality control,QC)等处理,结果见表1。由表1可知,大曲样品B1中检测到的原始reads数目为77 563个,平均碱基长度为417.01 bp。通过质控去除barcode、两端引物及部分低质量序列,得到74 434条基因序列,平均碱基长度为379.26 bp;PCR扩增后,产生887个嵌合体;非靶区域序列数目有531个;为保证测序数据信息的分析质量,再通过去除嵌合体与靶区域外序列发现,大曲样品B1中有73 000条基因序列。

表1 大曲样品B1中古菌16S rDNA V3-V4区基因序列测序结果Table 1 Sequencing results of 16S rDNA V3-V4 region gene sequence of archaea in Daqu samples B1
2.3 Alpha多样性分析
Shannon指数、Chao1指数、Simpson指数和Coverage等Alpha多样性指数常用于衡量微生物群落多样性[16],大曲样品B1中古菌的Alpha多样性分析结果见表2。由表2可知,大曲样品B1的Coverage值为1,证明实验取样合理,测序结果能反映样本的真实情况,其中可注释的OTU数为417个,Shannon指数、Chao1指数、Simpson指数分别为2.05、474.13、0.34。
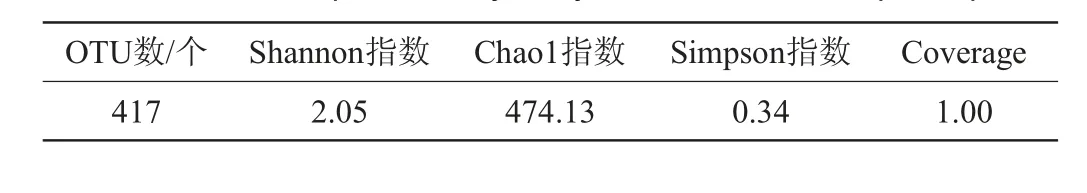
表2 大曲样品B1中古菌的Alpha多样性分析结果Table 2 Results of Alpha diversity analysis of archaea in Daqu sample B1
2.4 Shannon指数曲线分析
使用相似度>97%的OTU,利用mothur进行rarefaction分析,利用R制作曲线图,结果见图2。由图2可知,随着测序数量的增加,曲线趋于平坦,更多的数据量只会产生少量新的OTU,证明本次测序数据量合理。
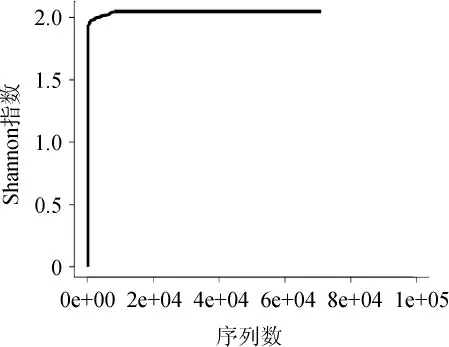
图2 大曲样品B1的Shannon指数稀释曲线Fig.2 Shannon index dilution curve of Daqu sample B1
2.5 物种分类学分析
将得到的所有OTU和数据库进行比对,对其进行物种分类,获得各个OTU的分类水平,即门、纲、目、科、属分类水平。基于门、属水平大曲样品B1中古菌的群落结构分别见图3和图4。
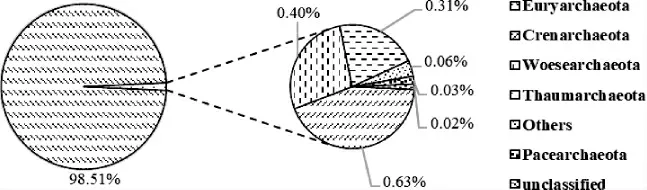
图3 基于门水平大曲样品B1古菌群落结构分析结果Fig.3 Analysis results of archaea community structure in Daqu sample B1 based on phylum level
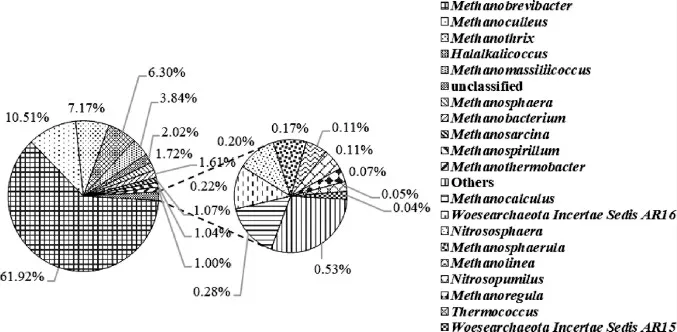
图4 基于属水平上大曲样品B1古菌群落结构分析结果Fig.4 Analysis results of archaea community structure in Daqu sample B1 based on genus level
由图3可知,大曲样品B1中共注释到6个古菌门,其中优势古菌门(相对丰度>1%)为广古菌门(Euryarchaeota)(98.51%),非优势古菌门为泉古菌门(Crenarchaeota)(0.63%)乌斯古菌门(Woesearchaeota)(0.40%)、奇古菌门(Thaumarchaeota)(0.31%)、佩斯古菌门(Pacearchaeota)(0.03%)、Others(0.06%)、未分类菌门(unclassified)(0.02%)。边名鸿等[17]利用核糖体DNA扩增片段限制性内切酶分析(amplifed ribosomal DNA restriction analysis,ARDRA)免培养手段研究酱香型窖泥中的古菌群落结构,结果表明,酱香型窖泥中古菌主要为广古菌门;李可[18]采用传统培养和构建小亚基核糖体(ribosomal small subunit rRNA,SSU rRNA)文库的方法对中国浓香型白酒发酵黄水微生物群落结构及多样性研究发现主要古菌为广古菌门;WU C等[19]利用荧光原位杂交(fluorescence in situ hybridization,FISH)和聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gel gradient electrophoresis,PCR-DGGE)研究不同窖龄窖泥中的古菌群落,发现所有古菌的16S rRNA基因序列均归为广古菌门;赵东等[20]运用高通量测序技术解析五粮液窖泥原核微生物群落结构发现,古菌门有广古菌门、泉古菌门;张应刚等[21]基于高通量测序分析不同窖龄窖泥微生物结构与多样性,结果表明古菌主要为广古菌门、奇古菌门和泉古菌门。本实验研究结果与前人研究结果一致,广古菌门不仅在窖泥、发酵黄水中为绝对优势菌门,在大曲中也是绝对优势菌门,说明广古菌门类古菌在白酒酿造中发挥着重要作用,对白酒风味的形成至关重要;除广古菌门、泉古菌门、奇古菌门外,还新发现乌斯古菌门、佩斯古菌门,这两个菌门的报道多见于对甲烷盐碱环境和海洋沉积物的研究[22-23]。
由图4可知,大曲样品B1中共注释到20个古菌属,其中优势古菌属(相对丰度>1%)为甲烷短杆菌属(Methanobrevibacter)(61.92%)、甲烷囊菌属(Methanoculleus)(10.51%)、甲烷发菌属(Methanothrix)(7.17%)、盐碱球菌属(Halalkalicoccus)(6.30%)、Methanomassiliicoccus(3.84%)、甲烷球形菌属(Methanosphaera)(1.72%)、甲烷杆菌属(Methanobacterium)(1.61%)、甲烷八叠球菌属(Methanosarcina)(1.07%)、Methanospirillum(1.04%)、甲烷嗜热杆菌属(Methanothermobacter)(1.00%)、unclassified(2.02%),非优势古菌属为产甲烷石状菌属(Methanocalculus)(0.28%)、WoesearchaeotaIncertae Sedis AR16(0.22%)、亚硝化暖菌属(Nitrososphaera)(0.20%)、Methanosphaerula(0.17%)、甲烷绳菌属(Methanolinea)(0.11%)、亚硝化侏儒菌属(Nitrosopumilus)(0.11%)、Methanoregula(0.07%)、热球菌属(Thermococcus)(0.05%)、WoesearchaeotaIncertae Sedis AR15(0.04%)、Others(0.53%)。
叶光斌等[24]基于免培养法发现窖泥中古菌属有甲烷囊菌属、甲烷八叠球菌属、甲烷杆菌属和Methanomassiliic-occus;陶勇等[11]通过454焦磷酸测序法在不同窖龄窖泥中发现古菌的群落有甲烷短杆菌属、甲烷囊菌属、甲烷杆菌属和甲烷八叠球菌属;王明跃等[25]应用PCR-ARDRA和16S rRNA基因克隆测序技术针对窖泥古菌群落研究发现,古菌的群落组成是甲烷囊菌属、甲烷八叠球菌属、甲烷鬃菌属(Methanosaeta)和甲烷杆菌属;WANG X等[26]通过对窖泥和酒醅进行高通量测序发现甲烷杆菌属和甲烷短杆菌属占主导地位。本研究得益于先进的高通量测序技术,在大曲优势菌属数量上较上述研究发现的要多。
大曲中的菌群主要为甲烷菌,其对窖泥的老熟有促进作用[27];甲烷短杆菌属、甲烷囊菌属和甲烷杆菌属等为氢营养型产甲烷菌,它们能够消耗己酸和乙酸代谢的H2和CO2,解除己酸菌代谢的反馈抑制作用,增强与己酸菌的“种间氢转移关系”,在浓香型白酒生产中促进己酸发酵进程多产己酸,从而增加己酸乙酯含量以提高酒质[28];由于产生低沸点的甲烷气体,不仅能够带走大量热量,抑制杂菌繁殖,而且能使发酵按照理想的温度缓慢进行,提高发酵效率,增加产量[29]。
此外本研究首次在酿酒领域的研究中发现盐碱球菌属(Halalkalicoccus)、热球菌属(Thermococcus)、甲烷绳菌属(Methanolinea)、亚硝化侏儒菌属(Nitrosopumilus),这极大的丰富了酿酒微生物信息资源库。盐碱球菌属类古菌多存在于高盐等极端环境[30],这类古菌类群可以分泌蛋白酶降解环境中的蛋白质,形成小分子的肽和氨基酸[31],因此推测该菌属类古菌对浓香型白酒香气成分有一定的贡献;热球菌属是一类产环糊精酶的嗜热古菌,可以通过H2发酵在丙酮酸或麦芽低聚糖上生长,多用于麦芽七糖的制备[32-33];甲烷绳菌属是一种生活于厌氧消化污泥、沼泽中的产甲烷古菌[34-35];亚硝化侏儒菌属属于氨氧化古细菌,具有一定的硝化能力[36]。目前对于大曲中古菌的研究仍然滞后,这些菌属在整个酿造过程中是否普遍分布、在白酒发酵过程中发挥什么样的作用以及具体的影响等都有待研究。
2.6 COG功能预测分析
为了得知大曲样品B1更高层级水平上的功能情况,通过对已有测序微生物基因组的基因功能的构成进行分析后,通过16S rRNA测序获得的物种构成推测样本中的功能基因的构成,结果见表3。由表3可知,预测大曲样品B1古菌群落的COG功能有4类,分别为新陈代谢类(8个)、细胞过程和信号传导类(10个)、信息存储与处理类(5个)和特征差的功能(2个)。过滤掉特征差的功能,大曲样品B1古菌群落的COG功能富集丰度前6的功能有翻译、核糖体结构和生物发生,能源生产与转化,氨基酸转运和代谢,辅酶运输和代谢,复制、重组和修复和转录,反映了大曲中各种酶系的合成活跃。

表3 大曲样品B1中古菌群落的蛋白COG功能分类结果Table 3 Results of protein COG function classification of archaea community in Daqu sample B1
3 结论
本研究运用高通量测序技术分析赊店老酒大曲的古菌群落多样性及功能情况。结果表明,大曲的优势古菌门为广古菌门(Euryarchaeota),优势古菌属有甲烷短杆菌属(Methanobrevibacter)、甲烷囊菌属(Methanoculleus)、甲烷发菌属(Methanothrix)、盐碱球菌属(Halalkalicoccus)、Methanomassiliicoccus、甲烷球形菌属(Methanosphaera)、甲烷杆菌属(Methanobacterium)、甲烷八叠球菌属(Methanosarcina)、Methanospirillum、甲烷嗜热杆菌属(Methanothermobacter)。此外,首次在大曲中发现盐碱球菌属(Halalkalicoccus)、热球菌属(Thermococcus)、甲烷绳菌属(Methanolinea)、亚硝化侏儒菌属(Nitrosopumilus),COG功能主要富集在翻译、核糖体结构和生物发生,能源生产与转化,氨基酸转运和代谢,辅酶运输和代谢,复制、重组和修复,转录,反映了大曲中各种酶系的合成活跃。本研究结果极大丰富了浓香型白酒大曲中古菌的数据资源,对中原地区的大曲的制作以及白酒的创新性发展具有重要意义,为下一步分离纯种进行发酵产香实验奠定基础。

