“消白方颗粒”联合硫酸羟氯喹治疗IgA肾病蛋白尿33例临床研究
郑 娱 杨 婧 王 琛
(上海中医药大学附属曙光医院肾病科,上海中医药大学中医肾病研究所,上海市中医临床重点实验室,肝肾疾病病证教育部重点实验室,上海 201203)
IgA肾病是全世界最常见的原发性肾小球肾炎,约30%的IgA肾病患者在确诊的20年左右逐渐进展为终末期肾脏疾病(end-stage renal disease,ESRD)[1]。蛋白尿、肾功能不全、高血压、肾小球硬化、新月体形成和肾间质纤维化是IgAN进展的主要危险因素[2],尿蛋白>1.0 g/d是关键性独立危险因素[3]。因此,积极控制尿蛋白对于延缓IgAN病程尤为重要。一项随机双盲对照研究结果提示,在接受最大耐受量肾素-血管紧张素系统(reninangiotensin system,RAS)抑制剂的IgA肾病患者中,服用硫酸羟氯喹可降低50%的尿蛋白水平[4]。消白方是上海中医药大学附属曙光医院运用于慢性肾炎50余年的经验方,具有益气养阴、活血化瘀、清热利湿之功效,在改善患者的临床症状、体征,以及降低尿蛋白等方面均有很好的疗效。前期研究显示,消白方除可有效降低原发性肾小球肾炎患者的尿蛋白水平[5]、减少动物模型的尿蛋白排泄,还能促进实验动物肾小球病理损害的修复[6]。本研究运用消白方颗粒联合硫酸羟氯喹治疗IgA肾病[慢性肾脏病(CKD)1-3期]气阴两虚兼湿热瘀阻型轻中度蛋白尿患者,通过观察患者的肾功能、尿液生化及炎症细胞因子等指标,深入研究药物降低蛋白尿、延缓IgAN病程进展的作用机制。
1 临床资料
1.1 一般资料 选择2020年7月至2020年12月上海中医药大学附属曙光医院肾内科门诊及病房收治的IgA肾病(CKD 1-3期)气阴两虚兼湿热瘀阻型轻中度蛋白尿患者65例。使用SPSS 21.0软件采用随机对照原理生成随机数顺序,将65例患者分为治疗组33例与对照组32例。治疗组男16例,女17例;平均年龄(44.24±11.10)岁;平均病程(7.12±5.78)年;平均收 缩 压(120.12±6.76)mmHg(1 mmHg≈0.133 kPa),平均舒张压(75.33±3.63)mmHg。对照组男14例,女18例;平均年龄(41.88±12.52)岁;平均病程(4.69±4.15)年;平均收缩压(121.78±7.07)mmHg,平均舒张压(74.56±5.02)mmHg。2组患者性别、年龄、病程等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究经上海中医药大学附属曙光医院伦理委员会审批通过(批件号:2020-844-51-01)。
1.2 诊断标准
1.2.1 西医诊断及分级标准 IgA肾病的诊断标准参考《肾脏病学(第二版)》[7]。慢性肾脏病诊断及临床分级标准参照美国国家肾脏基金会发布的《慢性肾脏病及透析的临床实践指南》中的相关标准[8]。
1.2.2 中医辨证标准 根据《IgA肾病西医诊断和中医辨证分型的实践指南》[9]中的相关标准拟定气阴两虚兼湿热瘀阻型辨证标准。
气阴两虚型。主症:气短乏力,盗汗、自汗,腰膝酸软,手足心热。次症:口干、神疲。舌脉:舌淡或淡红,质体胖大边有齿痕,少苔且偏干,脉沉细或细数无力。
湿热证:主要表现为口干口苦,脘腹胀闷,小便短赤,大便溏臭,舌红苔黄腻,脉滑数。
血瘀证:主要表现为面色黧黑,定位刺痛,夜间加重,腰痛,肢体麻木,肌肤甲错,经色黯,多血块,唇色紫黯或带有瘀斑,舌淡黯有瘀点、瘀斑,舌下脉络瘀紫,脉细涩或涩。
具备气阴两虚型任意2项主症或次症,兼证中任意2项症状体征,结合舌脉象即可诊断。
1.3 纳入标准 符合IgA肾病西医诊断标准及中医辨证标准;符合CKD 1-3期分期标准;年龄18~65岁,性别、民族不限;24 h尿蛋白定量(24 h UP)为1.0~2.5 g;肾 小 球 滤 过 率(eGFR)≥30 mL/(min·1.73 m2);未接受肾脏替代治疗;高血压患者血压正常或血压控制在125~130/75~80 mmHg之间;自愿参加本研究并签署知情同意书。
1.4 排除标准 过去3个月内使用过糖皮质激素、免疫抑制剂或细胞毒性药物者;患继发性IgA肾病者,如过敏性紫癜性肾炎和系统性红斑狼疮等;合并多囊肾、肾盂肾炎、药物性肾损伤等其他类型的肾脏疾病者;诊断为急性肾功能衰竭或慢性肾功能衰竭伴急性加重者;并发视网膜病变、严重心脑血管疾病、严重造血系统疾病、严重肝病、恶性肿瘤、严重精神疾病、严重创伤者;妊娠期或哺乳期妇女;对试验药物过敏或不耐受者。
2 治疗方法
2组患者均采用营养支持和基础对症治疗。营养支持:适量的糖类、脂肪,低磷及优质低蛋白饮食(每日0.5~0.6 g/kg)。对症治疗:祛除诱发及加重肾衰竭的因素;纠正水电解质紊乱、酸碱平衡失调及贫血等;控制血压,以钙离子拮抗剂、α受体阻滞剂和/或中枢性降压药为主,全身浮肿时,限制钠盐摄入。
2.1 治疗组 在营养支持和对症治疗基础上,加用消白方颗粒及硫酸羟氯喹,疗程为3个月。硫酸羟氯喹片(商品名:纷乐,上海上药中西制药有限公司生产,批号:H19990263),口服,0.2 g/次,2次/d。消白方颗粒(江阴天江药业生产),冲服,1袋/次,2次/d,药物组成:生黄芪30 g,莲须15 g,薏苡根30 g,石韦15 g,泽兰15 g,鬼箭羽15 g,青风藤9 g,蚕茧壳9 g。
2.2 对照组 口服硫酸羟氯喹片和中药免煎安慰剂(消白方颗粒原药10%剂量,江阴天江药业生产),用法及用量均同治疗组,疗程为3个月。
3 疗效观察
3.1 观察指标
3.1.1 中医证候积分 分别于治疗前后,参照《中药新药临床研究指导原则(试行)》[11]拟定评分标准,对2组患者的中医症状体征进行评分。
主要症状:气短乏力,盗汗、自汗,腰膝酸软,手足心热。按轻、中、重分别计2、4、6分。
次要症状:口干,神疲。按轻、中、重分别计1、2、3分。
兼证:小便短赤,大便溏臭,口干口苦,脘腹胀闷,面色黧黑,夜尿增,尿频,腰痛,肢体麻木,肌肤甲错。按轻、中、重分别计1、2、3分。
3.1.2 肾功能、尿液生化指标、炎症细胞因子 分别于治疗前后检测2组患者肾功能指标,包括血肌酐(Scr)、尿素氮(BNU)、eGFR;炎症细胞因子指标,包括干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)、白 介 素(IL)-1β、IL-2、IL-4、IL-6、IL-17;尿 液生化指标,包括24 h UP、尿微量白蛋白/肌酐(MA/Cr)、尿N-乙酰-β-D-葡萄糖苷酶(UNAG)、尿视黄醇结合蛋白(URBP)、尿α1微球蛋白(Uα1-MG)、尿β2微球蛋白(Uβ2-MG)。
3.1.3 安全性指标及不良反应 安全性指标:治疗期间监测2组患者血常规、电解质、肝功能、粪便常规、心电图;不良反应:记录患者治疗过程中眼底病变、胃肠道反应、皮肤毒性等不良反应的发生情况。
3.2 疗效评定标准 参照中华中医药学会肾病分会《IgA肾病的诊断、辨证分型和疗效评定(试行方案)》[10]中的疗效判定标准,于治疗后对2组患者进行疗效评价。完全缓解:临床症状完全消失,24 h UP≤0.3 g,肾功能正常;显效:临床症状基本消失,24 h UP较前减少≥50%,肾功能正常;有效:临床症状明显改善,24 h UP较前减少≥25%、<50%,肾功能正常;无效:临床表现与实验室检查均无改善或反加重。
3.3 统计学方法 使用SPSS 21.0统计软件对数据进行统计分析。计量资料以(±s)表示,符合正态分布的数据,组间比较采用独立样本 t 检验,组内比较采用配对样本 t 检验;不符合正态分布的数据,组间比较采用Man-Whitney U检验,组内比较采用Wilcoxon检验。计数资料用百分比表示,使用卡方检验。使用双侧检验,P<0.05表示差异具有统计学意义。
3.4 治疗结果
3.4.1 2组患者临床疗效比较 治疗组临床总有效率明显高于对照组(P<0.05),见表1。

表1 治疗组与对照组患者临床疗效比较 单位:例
3.4.2 2组患者治疗前后中医证候积分比较 治疗前2组患者各项中医证候积分及总分比较差异无统计学意义(P>0.05);治疗后治疗组气短乏力、腰膝酸软、大便溏臭、脘腹胀闷、夜尿增多、神疲证候积分和总分均较治疗前明显下降(P<0.05),也明显低于对照组治疗后(P<0.05)。见表2。
表2 治疗组与对照组患者治疗前后中医证候积分比较(±s) 单位:分
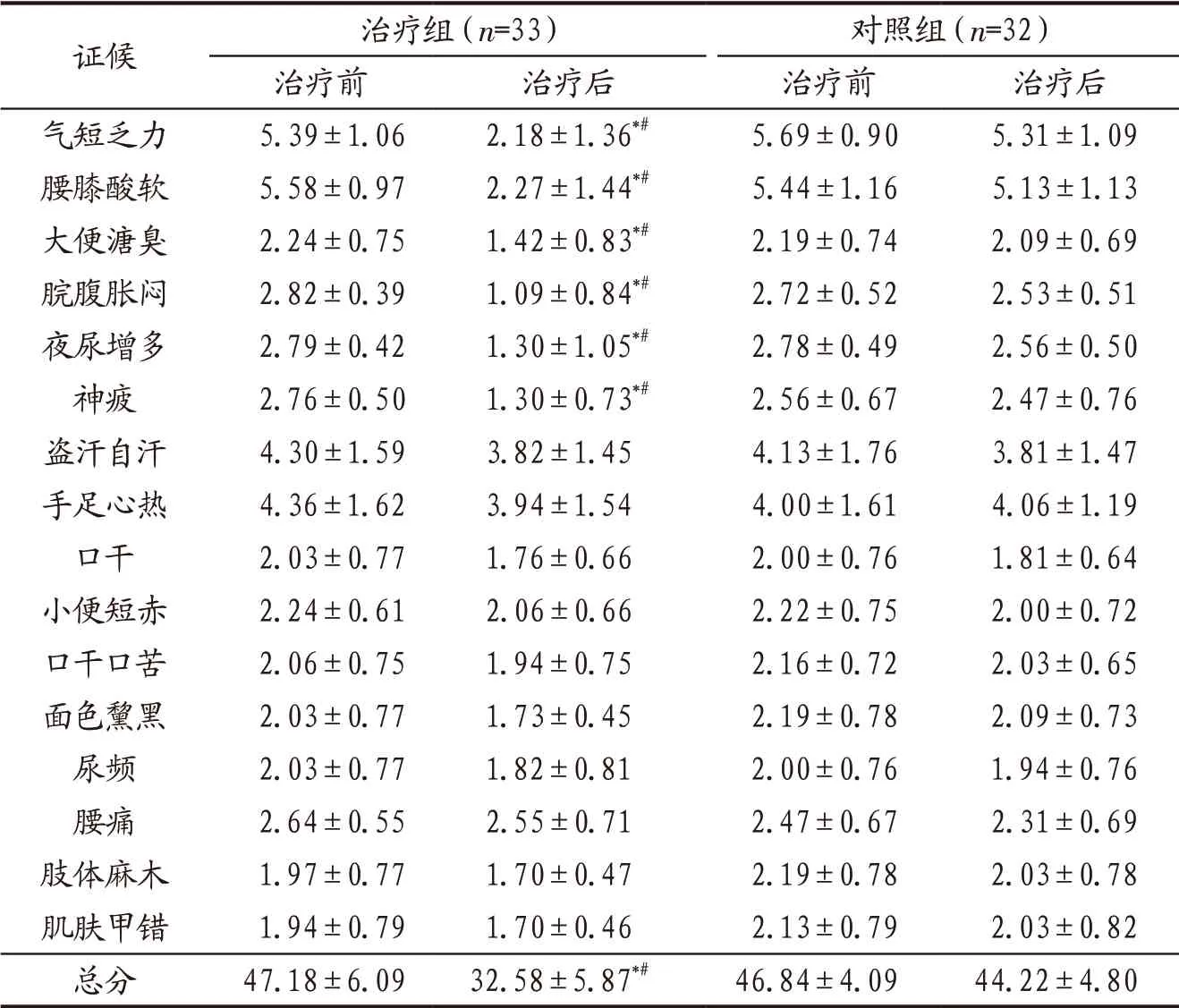
表2 治疗组与对照组患者治疗前后中医证候积分比较(±s) 单位:分
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
证候 治疗组(n=33) 对照组(n=32)治疗前 治疗后 治疗前 治疗后气短乏力 5.39±1.06 2.18±1.36*# 5.69±0.90 5.31±1.09腰膝酸软 5.58±0.97 2.27±1.44*# 5.44±1.16 5.13±1.13大便溏臭 2.24±0.75 1.42±0.83*# 2.19±0.74 2.09±0.69脘腹胀闷 2.82±0.39 1.09±0.84*# 2.72±0.52 2.53±0.51夜尿增多 2.79±0.42 1.30±1.05*# 2.78±0.49 2.56±0.50神疲 2.76±0.50 1.30±0.73*# 2.56±0.67 2.47±0.76盗汗自汗 4.30±1.59 3.82±1.45 4.13±1.76 3.81±1.47手足心热 4.36±1.62 3.94±1.54 4.00±1.61 4.06±1.19口干 2.03±0.77 1.76±0.66 2.00±0.76 1.81±0.64小便短赤 2.24±0.61 2.06±0.66 2.22±0.75 2.00±0.72口干口苦 2.06±0.75 1.94±0.75 2.16±0.72 2.03±0.65面色黧黑 2.03±0.77 1.73±0.45 2.19±0.78 2.09±0.73尿频 2.03±0.77 1.82±0.81 2.00±0.76 1.94±0.76腰痛 2.64±0.55 2.55±0.71 2.47±0.67 2.31±0.69肢体麻木 1.97±0.77 1.70±0.47 2.19±0.78 2.03±0.78肌肤甲错 1.94±0.79 1.70±0.46 2.13±0.79 2.03±0.82总分 47.18±6.09 32.58±5.87*# 46.84±4.09 44.22±4.80
3.4.3 2组患者治疗前后肾功能指标比较 治疗前2组患者Scr、BUN、eGFR比较差异均无统计学意义(P>0.05);治疗后治疗组Scr、BUN均较治疗前明显下降(P<0.05),eGFR较治疗前明显上升(P<0.05),治疗组上述指标的改善均明显优于对照组(P<0.05)。见表3。
表3 治疗组与对照组患者治疗前后肾功能指标比较(±s)

表3 治疗组与对照组患者治疗前后肾功能指标比较(±s)
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
组别 例数 时间 Scr/(μmol/L)BUN/(mmol/L)eGFR/[mL/(min·1.73 m2)治疗组 33 治疗前 99.85±17.27 10.24±3.27 70.82±17.18治疗后 84.30±10.09*# 7.57±1.74*# 85.42±14.99*#对照组 32 治疗前 97.37±16.31 9.59±2.13 77.32±19.39治疗后 104.11±17.30 10.30±2.89 74.47±20.48
3.4.4 2组患者治疗前后尿液生化指标比较 治疗前2组患者各项尿液生化指标比较,差异无统计学意义(P>0.05)。治疗后治疗组24 h UP、MA/Cr、UNAG、Uα1-MG均较治疗前明显下降(P<0.05),也明显低于对照组(P<0.05);对照组24 h UP、MA/Cr较治疗前明显下降(P<0.05)。见表4。
表4 治疗组与对照组患者治疗前后尿液生化指标比较(±s)

表4 治疗组与对照组患者治疗前后尿液生化指标比较(±s)
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
组别 例数 时间 24 hUP/g MA/Cr/(mg/g) UNAG/(U/L) Uα1-MG/(mg/L) URBP/(mg/L) Uβ2-MG/(mg/L)治疗组 33 治疗前 1.89±0.61 4177.68±443.90 71.80±17.18 64.98±15.97 10.25±3.09 20.34±6.01治疗后 1.01±0.33*# 900.92±258.36*# 41.25±9.82*# 48.65±12.60*# 9.01±2.41 17.72±4.74对照组 32 治疗前 1.86±0.31 4044.37±529.70 73.28±21.50 65.30±16.51 9.69±3.81 17.63±5.36治疗后 1.57±0.51* 1785.79±442.43* 69.16±16.86 61.29±11.54 8.40±2.41 15.60±4.79
3.4.5 2组患者治疗前后炎症细胞因子比较 治疗前2组患者各项炎症细胞因子比较,差异无统计学意义(P>0.05);治疗后治疗组TNF-α、IL-2、IL-6、IL-17均较治疗前明显下降(P<0.05),且明显低于对照组(P<0.05)。见表5。
表5 治疗组与对照组患者治疗前后炎症细胞因子比较(±s) 单位:pg/mL
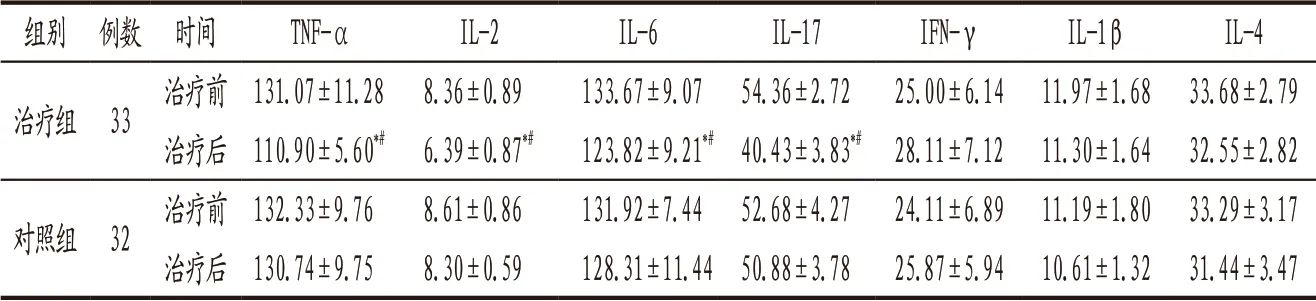
表5 治疗组与对照组患者治疗前后炎症细胞因子比较(±s) 单位:pg/mL
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
组别 例数 时间 TNF-α IL-2 IL-6 IL-17 IFN-γ IL-1β IL-4治疗组 33治疗前 131.07±11.28 8.36±0.89 133.67±9.07 54.36±2.72 25.00±6.14 11.97±1.68 33.68±2.79治疗后 110.90±5.60*# 6.39±0.87*# 123.82±9.21*#40.43±3.83*# 28.11±7.12 11.30±1.64 32.55±2.82对照组 32治疗前 132.33±9.76 8.61±0.86 131.92±7.44 52.68±4.27 24.11±6.89 11.19±1.80 33.29±3.17治疗后 130.74±9.75 8.30±0.59 128.31±11.44 50.88±3.78 25.87±5.94 10.61±1.32 31.44±3.47
3.5 安全性评价 治疗前后2组患者的安全性指标检测均未见异常,所有患者均未出现胃肠道反应、眼底病变及皮肤毒性表现,说明消白方颗粒联合硫酸羟氯喹临床应用时安全性良好。
4 讨论
根据IgA肾病的“多重打击学说”,T细胞、B细胞及细胞因子(IFN-γ、TNF-α、IL-1β、IL-2、IL-4、IL-6、IL-17、IL-21、TGF-β等)通过募集白细胞推动炎症反应,促进肾小球和肾小管间质纤维化,加剧肾脏病变[12]。细胞因子既参与IgA肾病的发病,又通过炎症反应推动IgA肾病进展。
IFN-γ是Th1细胞分泌的主要细胞因子,可促进细胞免疫,而主要从Th2细胞分泌的IL-4已知会增加B细胞的数量,并促进IgA的产生[13]。TNF-α是炎症和免疫反应的重要调节剂,可以刺激肾小球膜细胞中黏附分子的表达并促进肾纤维化的发展[14]。TNF-α的升高促进了血管内皮细胞的损伤,加重了血管内皮细胞的氧化应激反应[15]。在IgA肾病中,IL-1β一方面促进炎症的消退保护肾脏,另一方面作为炎症介质促进肾脏组织的炎症和损害,并参与其病理过程[16]。IL-2在T细胞激活后产生,并在抗原刺激后在T淋巴细胞的增殖中起关键作用。激活后,T细胞表达IL-2的高亲和力受体IL-2R,随后释放出可溶形式的IL-2R蛋白(sIL-2Ra),sIL-2Ra的血浆水平可预测大量经活检证实为IgA肾病患者的长期肾脏疾病进展[17]。IL-4可以多种方式促进炎症[18]。体外研究发现,很多细胞因子能够借助旁分泌或者是自分泌的形式来刺激系膜细胞发生增殖以及细胞外基质不断产生,这过程中IL-6发挥着重要作用[19]。另有研究表明,IL-17的表达与SCr、eGFR、24 h UP的变化呈正相关,说明IL-17可能可以预测IgA肾病的进展和预后[20]。可见,炎症细胞因子在IgA肾病的发生发展中起着关键作用。
低蛋白血症、肾功能损害、蛋白尿和高血压是肾脏疾病不良后果的独立预测因素[21]。尿蛋白水平与慢性肾脏病的病程相关,治疗蛋白尿可以显著延缓IgA肾病进展至ESRD[22]。24 h UP>1.0 g预示ESRD的结局事件[23],大量蛋白尿持续存在或进行性加重提示疾病的不良预后。因此,积极寻求有效可行的方法治疗蛋白尿,尤其是大量蛋白尿[24]尤为重要。
免疫调节药物羟氯喹(HCQ)通过双向调节免疫,既可抑制T细胞的增殖,减少INF-γ、TNF、IL-1、IL-6和IL-2等促炎性细胞因子的产生,还能阻碍Toll样受体(TLR)与核酸配体结合,从而抑制先天性免疫反应的激活[25]。一项回顾性病例对照研究纳入26例IgA肾病患者,经过6个月的临床观察,发现对免疫抑制治疗反应不足的IgA肾病患者使用HCQ可以显著降低尿蛋白[26]。
IgA肾病可归属于中医学“肾风”“尿血”“水肿”“腰痛”“虚劳”等范畴,病机为本虚标实,标实主要表现为湿热、瘀血。消白方颗粒具有益气养阴生津、清热利湿活血之效。方中君药黄芪、莲须益气生津养血、固肾涩精助阴,补益同时兼具收敛之效,从源头上减少尿蛋白流失;泽兰为臣消肿利水、活血散瘀;薏苡根、石韦清利湿热为佐,助湿邪排出;鬼箭羽破血散瘀通络脉,青风藤祛风除湿,蚕茧壳祛风清热,三药合用内散瘀结为使药。全方标本同治,益气敛阴以治本,清热利湿、活血化瘀以治标。现代药理研究发现,黄芪、石韦、泽兰、鬼箭羽具有保护肾功能、改善肾损伤、抑制炎症反应等作用[27-31]。
本研究结果表明,治疗后治疗组临床总有效率明显高于对照组,说明加用消白方颗粒临床疗效优于单用硫酸羟氯喹;治疗后治疗组中医证候总分、BUN、Scr及炎症细胞因子水平均较治疗前显著降低,尿蛋白较治疗前明显减少,且治疗组对上述指标的改善明显优于对照组,说明联合用药延缓CKD进展及改善症状作用优于单用硫酸羟氯喹,消白方颗粒在改善临床症状与肾功能、降蛋白、抗炎方面效果明显。本研究发现,硫酸羟氯喹在降低尿蛋白方面效果显著,但对临床症状、肾功能及炎症细胞因子指标改善不明显,可能与研究时间较短有关。肾脏炎症的发生发展是IgA肾病进展的病理基础,而蛋白尿是CKD的独立危险因素,因此降尿蛋白、抗炎治疗以延缓IgA肾病的进展为本病的治疗目的。消白方中君药黄芪、莲须补益收敛、固肾涩精,具有抗氧化应激、减少肾小管间质损伤的作用,使得血清中炎症细胞因子减少,尿蛋白降低;余药清热利湿、活血化瘀,在保护肾功能、抑制炎症反应、降蛋白方面也发挥了一定的作用。
本研究观察时间较短,样本量偏低,下一步需延长观察时间,扩大样本量,进行多中心研究;有关方药中具体何种中药通过何种途径起到保护肾功能、抗炎、降蛋白的作用也尚待进一步研究。

