银杏内酯B对癫痫模型大鼠脑保护作用及其机制研究
鲁光辉 李新峰 冯 亮 罗 玲 王海华
(邯郸市第二医院,河北邯郸 056000)
癫痫(epilepsy,EP)是一种较为常见的慢性神经系统疾病,我国EP患者约900万,每年新发病例约45万,发病率为25~35个/10万,并且具有反复性、自发性的特点,严重危害患者的身心健康[1]。EP发作是神经元过度兴奋和自由基堆积的过程,研究显示EP发作时间超过30 min即可造成大脑神经元损伤,海马神经元最为敏感[2],而氧化应激反应和细胞凋亡在其病变过程中发挥着重要作用[3-4]。核因子E2相关因子2(nuclear factor e2-related factor 2,Nrf2)/血红素加氧酶-1(heme oxygenase-1,HO-1)是细胞调控氧化应激反应和细胞凋亡的关键信号通路[5-6]。银杏内酯B(ginkgolide B,GB)是从银杏叶中提取出的一种倍半萜内酯化合物,具有良好的抗氧化和抗凋亡活性[7],但GB能否通过抑制氧化应激反应和细胞凋亡减轻EP所致脑组织损伤尚未见文献报道。本实验通过制备EP大鼠模型,研究GB对EP模型大鼠氧化应激、细胞凋亡以及Nrf2/HO-1通路的影响,探讨GB对EP模型大鼠脑保护作用及其机制,现将研究结果报道如下。
1 实验材料
1.1 实验动物 SPF级雄性SD大鼠120只,体质量220~250 g,由河北省实验动物中心提供[许可证号:SCXK(冀)2018-004],适应性饲养 7 d后开展实验。饲养条件:12 h光照黑暗交替,温度(25±1)℃,相对湿度(65±5)%。本实验通过邯郸市第二医院伦理委员会审查,伦理批号:HDEY LL〔K〕字2020-024。
1.2 药物与试剂 GB购自美国Sigma公司(批号:BN90418);注射用丙戊酸钠(valproate,VPA)购自成都诺迪康生物制药有限公司(批号:20190716);末端脱氧核苷酰基转移酶介导dUTP切口末端标记(TUNEL)染色试剂盒和丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)试剂盒购自南京建成生物工程研究所(批号:200413、200326、200113、200308);兔抗鼠Nrf2、HO-1、核因子-κB(NF-κB)、半胱氨酸蛋白酶-3(Caspase-3)、激活型Caspase-3(Cleaved Caspase-3)、β-肌动蛋白(β-actin)抗体和羊抗兔IgG二抗购自北京博奥森生物技术有限公司(批号:bs-1074R、bs-23667R、bs-20355R、bs-0081R、bsm-52289R、bs-0061R、bs-0295G)。
1.3 主要仪器 石蜡包埋机(型号:TDK-BMB),孝感泰康达医疗设备公司;石蜡切片机(型号:RM2125),德国Leica公司;紫外-可见分光光度计(型号:UV2000),上海尤尼柯公司;电泳槽(型号:VE180)、转膜仪(型号:VE186VE180),上海天能科技有限公司;凝胶成像系统(型号:GelDoc2000),美国Bio-Rad公司;倒置光学显微镜(型号:AI09),日本奥林巴斯公司。
2 实验方法
2.1 分组、造模与给药 按照随机数字表法将120只SD大鼠随机分为空白对照组、模型组、VPA组和GB低、中、高剂量组,每组20只。除空白对照组外,其余各组大鼠均参照康云霄等[8]报道的氯化锂-匹罗卡品法诱导制备EP大鼠模型:以127 mg/kg剂量腹腔注射氯化锂溶液,20 h后以15 mg/kg剂量背部皮下注射匹罗卡品溶液。空白对照组上述步骤均同步给予生理盐水。各组均在注射匹罗卡品前30 min腹腔注射给予相应剂量药物或生理盐水(空白对照组和模型组给予生理盐水,GB低、中、高剂量组给药剂量分别为2.5、5、10 mg/kg[9],VPA组给药剂量为300 mg/kg[10])。
2.2 大鼠行为学观察 注射匹罗卡品后2 h内观察各组大鼠行为学变化,记录EP首次发作潜伏期、发作持续时间,参照Racine分级标准对各组大鼠EP发作程度进行分级[11]:无发作为0级;须动及口周、面部肌肉抽搐为Ⅰ级;点头或湿狗样频繁抖动为Ⅱ级;前肢局限性阵挛为Ⅲ级;前肢局限性阵挛伴后肢站立的全身强直性发作为Ⅳ级;伴有站立并摔倒、翻滚的全身强直阵挛发作为Ⅴ级。
2.3 大脑海马组织病理学检查和神经元凋亡观察 注射匹罗卡品24 h后,各组随机取10只大鼠,麻醉后开胸,暴露心脏,由左心室-右心耳通路依次灌注300 mL生理盐水、300 mL 4%多聚甲醛溶液,断头取脑,置于4%多聚甲醛溶液固定72 h后,行石蜡包埋、4 μm厚度切片、透明和脱蜡。部分组织切片行常规HE染色,中性树脂封片后通过光学显微镜观察大脑海马组织病理学改变。部分组织切片按照TUNEL试剂盒操作方法进行处理,50%甘油封片后通过光学显微镜观察海马区神经元凋亡状况,细胞核黄褐色为阳性着色。凋亡指数(apoptosis index,AI)计算:每只大鼠随机取5张切片,计数视野内凋亡细胞数和细胞总数,取比值的百分比,AI(%)=(凋亡细胞数/细胞总数)×100%。
2.4 大脑海马组织SOD、CAT活力和MDA含量检测 注射匹罗卡品24 h后,取各组剩余的10只大鼠,麻醉后脊椎脱臼处死,断头取脑并剥离海马,加入9倍量冷裂解液后研磨匀浆,4 ℃离心(离心半径10 cm,3000 r/min,10 min)取上清液,然后采用黄嘌呤氧化法和钼酸铵法分别检测SOD、CAT活力,硫代巴比妥酸法检测MDA含量。
2.5 大脑海马组织Nrf2、HO-1、NF-κB、Caspase-3、Cleaved Caspase-3蛋白表达检测 取“2.4”步骤海马组织匀浆、离心所得的上清液,4 ℃离心(离心半径10 cm,12 000 r/min,20 min)取沉淀,BCA法检测总蛋白浓度,95 ℃水浴使蛋白变性后,SDS-PAGE胶电泳分离蛋白,湿法转PVDF膜,5%脱脂奶粉37 ℃封闭1 h后,滴加目标蛋白(Nrf2、HO-1、NF-κB、Caspase-3、Cleaved Caspase-3)和β-actin 一抗后4 ℃孵育过夜,PBS溶液洗膜后滴加IgG二抗37 ℃孵育1 h,洗膜后滴加DAB显色,然后以β-actin为内参半定量目标蛋白表达。
2.6 统计学方法 运用SPSS 15.0软件对数据进行统计分析。计量资料以(±s)表示,多组间均数比较采用单因素方差分析,两两比较采用LSD检验,P<0.05为差异有统计学意义。
3 实验结果
3.1 各组大鼠行为学指标比较 空白对照组大鼠行为正常,未出现EP发作,EP发作级别为0级。模型组大鼠发作程度评级明显高于模型组(P<0.01)。各给药组与模型组组间各项指标比较结果见表1。
表1 各组大鼠行为学指标比较(±s)
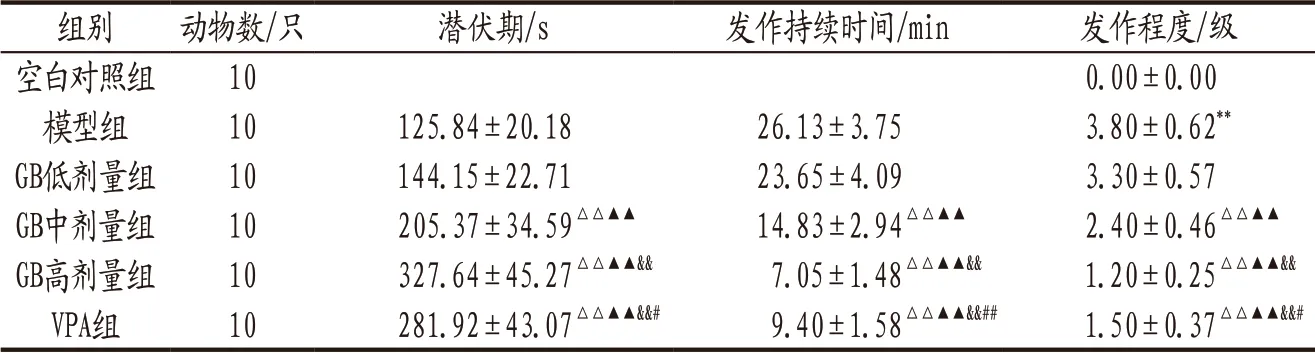
表1 各组大鼠行为学指标比较(±s)
注: 与空白对照组比较,**P<0.01;与模型组比较,△△P<0.01;与GB低剂量组比较,▲▲P<0.01;与GB中剂量组比较,&&P<0.01;与GB高剂量组比较,#P<0.05,##P<0.01。
组别 动物数/只 潜伏期/s 发作持续时间/min 发作程度/级空白对照组 10 0.00±0.00模型组 10 125.84±20.18 26.13±3.75 3.80±0.62**GB低剂量组 10 144.15±22.71 23.65±4.09 3.30±0.57 GB中剂量组 10 205.37±34.59△△▲▲ 14.83±2.94△△▲▲ 2.40±0.46△△▲▲GB高剂量组 10 327.64±45.27△△▲▲&& 7.05±1.48△△▲▲&& 1.20±0.25△△▲▲&&VPA组 10 281.92±43.07△△▲▲&&# 9.40±1.58△△▲▲&&## 1.50±0.37△△▲▲&&#
3.2 各组大鼠海马组织病理学改变比较 空白对照组大鼠海马神经元呈圆形或椭圆形,排列整齐、层次清晰,核膜、核仁清晰;模型组大鼠海马神经元出现数量减少,形态不规则,排列紊乱、层次不清,核仁固缩、偏移、深染等病理学改变;与模型组比较,GB各剂量组和VPA组大鼠海马神经元上述病理学形态结构改变呈不同程度减轻,其中GB高剂量组海马神经元数量减少不明显,形态较规则,排列较整齐,效果优于其他组。见图1。

图1 各组大鼠海马组织病理学改变情况(HE,×400)
3.3 各组大鼠海马神经元凋亡水平比较 空白对照组大鼠海马区仅可见极少量凋亡神经元,AI为(3.48±0.57)%;与空白对照组比较,模型组大鼠海马神经元凋亡数量明显增多,AI为(46.95±8.01)%,明显高于空白对照组(P<0.01);与模型组比较,GB中、高剂量组和VPA组大鼠海马神经元凋亡数量明显减少,AI分别为(24.01±4.73)%、(14.39±2.84)%、(17.74±3.08)%,均明显低于模型组(P<0.01);GB低剂量组AI为(39.47±7.62)%,明显高于GB中、高 剂 量 组 和VPA组(P<0.01);GB高 剂 量 组 和VPA组AI明 显低于GB中剂量组(P<0.01);GB高剂量组AI明显低于VPA组(P<0.05)。见图2。
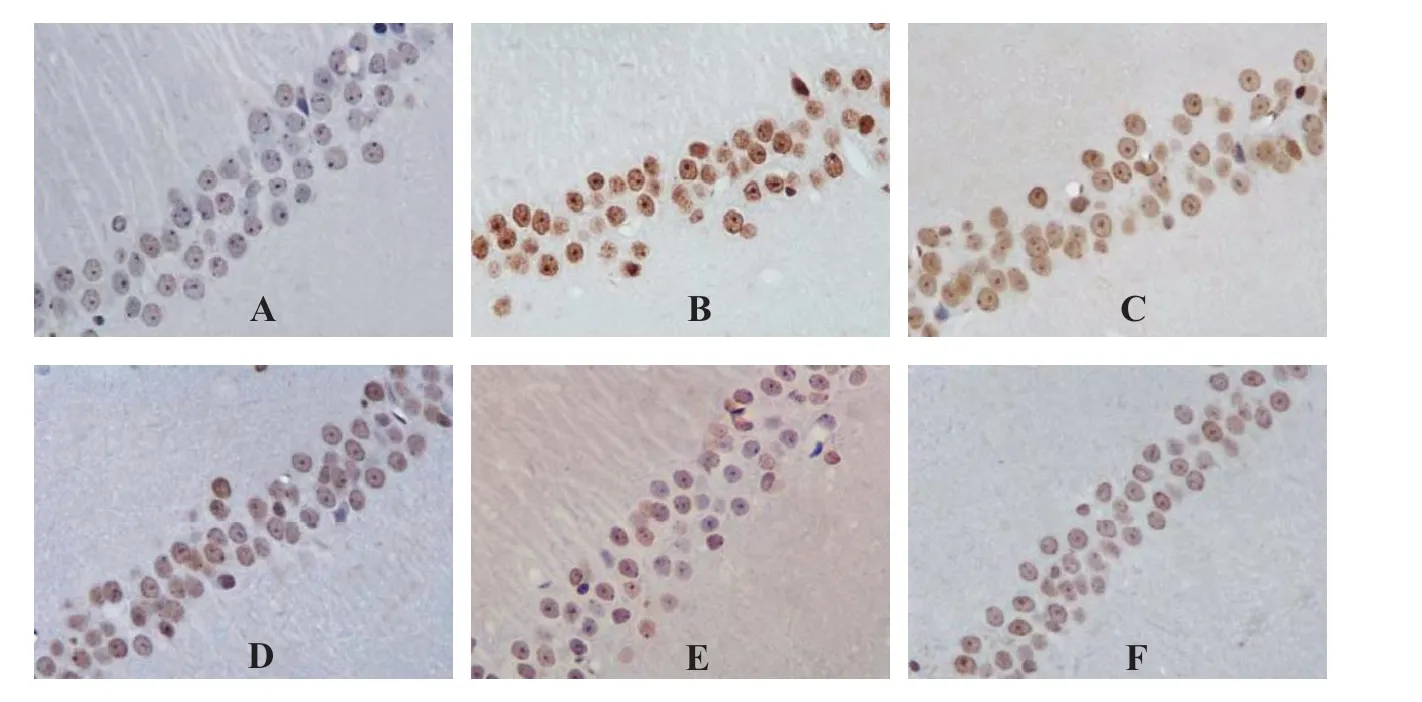
图2 各组大鼠海马神经元凋亡状况(TUNEL,×400)
3.4 各组大鼠海马组织SOD、CAT活力和MDA含量比较 与空白对照组比较,模型组大鼠海马组织SOD、CAT活力降低,MDA含量升高,差异有统计学意义(P<0.01)。各给药组与模型组组间上述指标比较结果见表2。
表2 各组大鼠海马组织SOD、CAT活力和MDA含量比较(±s)
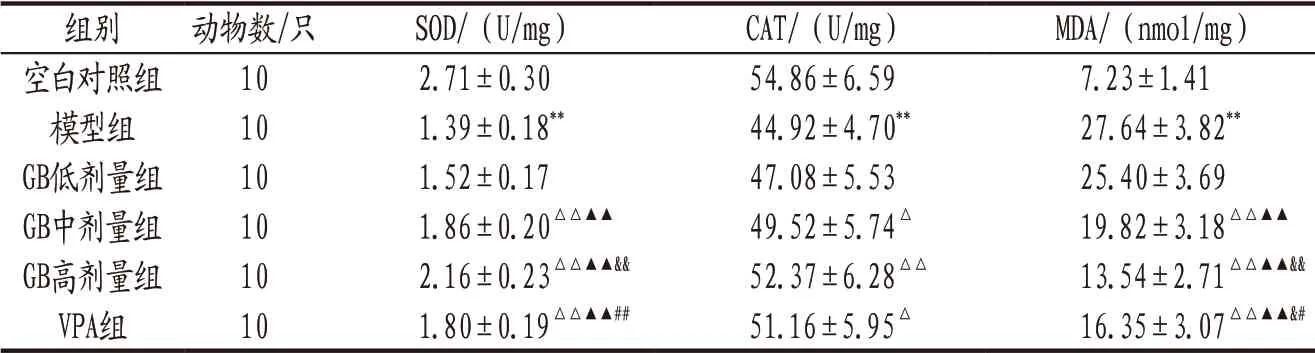
表2 各组大鼠海马组织SOD、CAT活力和MDA含量比较(±s)
注: 与空白对照组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01;与GB低剂量组比较,▲▲P<0.01;与GB中剂量组比较,&P<0.05,&&P<0.01;与GB高剂量组比较,#P<0.05,##P<0.01。
组别 动物数/只 SOD/(U/mg) CAT/(U/mg) MDA/(nmol/mg)空白对照组 10 2.71±0.30 54.86±6.59 7.23±1.41模型组 10 1.39±0.18** 44.92±4.70** 27.64±3.82**GB低剂量组 10 1.52±0.17 47.08±5.53 25.40±3.69 GB中剂量组 10 1.86±0.20△△▲▲ 49.52±5.74△ 19.82±3.18△△▲▲GB高剂量组 10 2.16±0.23△△▲▲&& 52.37±6.28△△ 13.54±2.71△△▲▲&&VPA组 10 1.80±0.19△△▲▲## 51.16±5.95△ 16.35±3.07△△▲▲&#D E F
3.5 各组大鼠海马组织Nrf2、HO-1、NF-κB、Caspase-3、Cleaved Caspase-3蛋白表达比较 与空白对照组比较,模型组大鼠海马组织Nrf2、HO-1表达下调,NF-κB、Cleaved Caspase-3表 达 上 调,Cleaved Caspase-3/Caspase-3比值升高,差异均有统计学意义(P<0.01)。各组上述指标表达见图3,各给药组与模型组组间上述指标比较结果见表3。
表3 各组大鼠海马组织Nrf2、HO-1、NF-κB、Caspase-3、Cleaved Caspase-3蛋白表达及Cleaved Caspase-3/Caspase-3比值比较(±s)
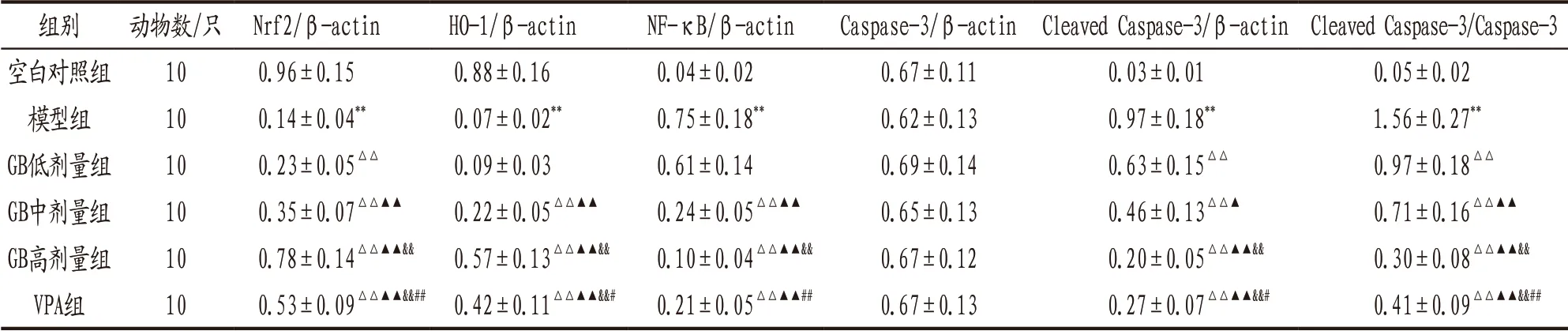
表3 各组大鼠海马组织Nrf2、HO-1、NF-κB、Caspase-3、Cleaved Caspase-3蛋白表达及Cleaved Caspase-3/Caspase-3比值比较(±s)
注: 与空白对照组比较,**P<0.01;与模型组比较,△△P<0.01;与GB低剂量组比较,▲P<0.05,▲▲P<0.01;与GB中剂量组比较,&&P<0.01;与GB高剂量组比较,#P<0.05,##P<0.01。
组别 动物数/只 Nrf2/β-actin HO-1/β-actin NF-κB/β-actin Caspase-3/β-actin Cleaved Caspase-3/β-actin Cleaved Caspase-3/Caspase-3空白对照组 10 0.96±0.15 0.88±0.16 0.04±0.02 0.67±0.11 0.03±0.01 0.05±0.02模型组 10 0.14±0.04** 0.07±0.02** 0.75±0.18** 0.62±0.13 0.97±0.18** 1.56±0.27**GB低剂量组 10 0.23±0.05△△ 0.09±0.03 0.61±0.14 0.69±0.14 0.63±0.15△△ 0.97±0.18△△GB中剂量组 10 0.35±0.07△△▲▲ 0.22±0.05△△▲▲ 0.24±0.05△△▲▲ 0.65±0.13 0.46±0.13△△▲ 0.71±0.16△△▲▲GB高剂量组 10 0.78±0.14△△▲▲&& 0.57±0.13△△▲▲&& 0.10±0.04△△▲▲&& 0.67±0.12 0.20±0.05△△▲▲&& 0.30±0.08△△▲▲&&VPA组 10 0.53±0.09△△▲▲&&## 0.42±0.11△△▲▲&&# 0.21±0.05△△▲▲## 0.67±0.13 0.27±0.07△△▲▲&&# 0.41±0.09△△▲▲&&##
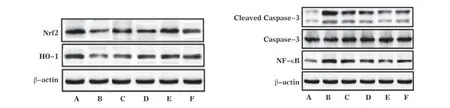
图3 各组大鼠海马组织Nrf2、HO-1、NF-κB、Caspase-3、Cleaved Caspase-3蛋白表达
4 讨论
EP是一种慢性神经系统疾病,长期反复发作严重影响患者的身心健康。大部分患者经药物治疗能够有效控制EP发作,但仍有约30%的患者疗效不佳而逐渐发展为难治性EP。EP发病机制尚未完全阐明,有研究证实氧化应激反应和继发性神经元凋亡是EP发作和神经退行性变的核心环节[3]。因此,寻找靶向抑制氧化应激和细胞凋亡的新型药物或许是改善EP患者预后的有效途径。
GB是从中药银杏叶中提取出的一种小分子活性单体化合物,具有抗氧化、抗凋亡等药理学作用,较易通过血脑屏障,WANG L等[7]研究发现GB能够通过抑制氧化应激反应和神经元凋亡减轻大鼠缺血性脑损伤。VPA是一种广泛应用于临床的广谱抗癫痫药,也是新型抗癫痫药研究动物实验的常用阳性对照药物。临床上以颞叶癫痫最为常见,EP实验动物模型的制备方法主要有电点燃和化学点燃两大类,其中氯化锂-匹罗卡品化学点燃法制备的EP大鼠模型为颞叶癫痫,与人类EP病理特点一致,并且操作简便、重复性高,是最公认的EP大鼠模型制作方法[12]。本实验采用氯化锂-匹罗卡品诱导制备EP大鼠模型,以VPA作为阳性对照药物,发现经GB干预能够明显延长EP大鼠EP发作潜伏期,缩短发作持续时间,降低EP发作程度,明显改善EP大鼠海马神经元病变,抑制海马神经元凋亡,GB低、中、高剂量对EP发作潜伏期、发作持续时间、发作程度及海马神经元凋亡的影响具有剂量依赖性,且GB高剂量上述效应优于VPA,提示GB对EP大鼠具有抗痫和脑组织保护作用。
活性氧自由基(reactive oxygen species,ROS)代谢失衡是导致机体氧化应激损伤的基础。EP发作时神经元过度兴奋和异常放电导致ROS大量生成与释放[13]。以ROS为底物的抗氧化酶(SOD、CAT)被过度消耗致使ROS过剩,ROS攻击破坏核酸、蛋白质及生物膜脂质发生氧化应激反应,生成具有生物毒性的MDA,因此SOD、CAT活力和MDA含量能够反映机体氧化应激反应程度[14]。本研究结果表明,经GB干预能够明显提高EP大鼠海马组织SOD、CAT活力并降低MDA含量,GB低、中、高剂量对SOD活力和MDA含量的调控作用具有剂量依赖性,且GB高剂量对SOD活力和MDA含量的调控作用优于VPA,提示GB对EP大鼠氧化应激损伤具有抑制作用。
Nrf2是一种对机体氧化应激反应具有重要调控作用的核转录因子。DESHMUKH P等[15]研究发现,ROS能够诱导Nrf2与抑制剂Keap1解离而活化,核转位并激活抗氧化反应元件,促进抗氧化酶(SOD、CAT等)转 录 与 表 达。HO-1为Nrf2下游基因,Nrf2核转位后能够诱导HO-1转录表达而催化降解血红素、一氧化碳等,从而抑制氧化应激损伤[16-17]。细胞凋亡过程由多种基因参与调控,其 中Caspase-3被 剪 切 活 化(Cleved Caspase-3)后参与细胞凋亡的启动与执行全过程,被认为是细胞凋亡最关键的调控因子[18]。翟春梅等[19]研究发现NF-κB能够诱导Caspase-3表达与活化,HO-1能 够 抑 制NF-κB启 动 子IKKβ磷 酸化进而抑制NF-κB活性[20]。本研究发现,GB能够明显上调EP大鼠海马组织Nrf2、HO-1表达并 下 调NF-κB、Cleaved Caspase-3表 达,降 低Cleaved Caspase-3/Caspase-3比值,GB低、中、高剂量对Nrf2、HO-1、NF-κB、Cleaved Caspase-3表达及Cleaved Caspase-3/Caspase-3比值的影响具有剂量依赖性,且GB高剂量组上述效应优于VPA组,提示GB对EP大鼠氧化应激和细胞凋亡的抑制作用可能与激活Nrf2/HO-1信号通路有关。
综上所述,GB对EP大鼠具有抗痫和脑组织保护作用,其机制可能与激活Nrf2/HO-1信号通路进而抑制氧化应激和细胞凋亡有关。下一步本课题组拟研究EP大鼠血脑屏障损伤机制及GB的干预作用,以进一步揭示GB治疗EP的药理机制。

