调控Smo活性对成年大鼠神经干细胞增殖和迁移的影响
仇欣霞,陈 荷,冯德龙,董为人
南方医科大学1基础医学院实验教学管理中心,3肿瘤研究所,广东 广州 510515;2南方医科大学第三附属医院神经外科,广东 广州510630
Smo是Sonic Hedgehog(Shh)的下游分子,是Shh信号通路中的关键信号传导因子[1-2]。近期许多研究证实Smo与多种肿瘤细胞迁移有关,Smo抑制剂的小分子药物是肿瘤治疗的新靶点[3]。Shh信号通路负责维持胚胎的正常发育,在胚胎发育过程中对于调控神经干细胞增殖和组织分化发挥重要作用[4-5]。此外,它还在轴突的生长中起到了导向的作用[6]。但关于Smo蛋白调控干细胞增殖和迁移的作用没有直接证据。由此我们推测,调控Smo的活性对神经干细胞的增殖和迁移可能有影响,从而为神经退行性疾病提供新的治疗思路。为了验证这一推测,我们将小分子药物Purmorphamine(PM,Smo 的激动剂)和Cyclopamine(CPM,Smo 的抑制剂)应用于调节Shh信号通路的实验研究中,观察他们对成年神经干细胞(ANSCs)增殖、迁移的影响并探讨可能的作用机制,旨在找寻一种能够有效逆转中枢神经系统退行性疾病进程的新方法[7-8]。
1 材料和方法
1.1 主要材料
大鼠神经干细胞培养液、Accutase消化液、碱性成纤维细胞生长因子(FGF-2)(Milipore)。Purmorphamine、Cyclopamine等试剂(MCE)。ABI 7500 型实时荧光定量PCR 仪(ABI)。倒置显微镜(Olympus),超净工作台(Airtech),细胞培养箱(Thermo)。
1.2 细胞培养
使用实验室已购买的成年大鼠神经干细胞(Milipore)。细胞培养方法参照实验室的前期工作,将冻存的成年大鼠神经干细胞从液氮中取出,迅速置于37 ℃中水浴,解冻后将1 mL的细胞冻存液转移至15 mL的离心管中,缓慢加入9 mL 的培养液并混匀,离心1200 r/3 min。小心吸弃上清液,再加入10 mL培养液重悬细胞,并补充20 ng/mL的FGF-2,种入经多聚鸟氨酸和层粘连蛋白包被的培养板中进行常规培养。第2天全换液并补充FGF-2,以后隔天换液[9]。
1.3 细胞增殖-毒性实验(CCK8实验)
ANSCs按密度为5×104/mL接种于96孔培养板,每孔体积100 μL。将ANSCs随机分为3组,分别为对照组、PM组和CPM组,每组细胞均设6个复孔。参照相关文献,选定PM和CPM的浓度范围[10]。经预实验,初步确定PM有效剂量为1.5 μmol/L,CPM有效剂量浓度为15 μmol/L。将处理后的细胞放入CO2培养箱进行培养,在0、24、48 h时对细胞增殖活性进行检测。在检测时间点前4 h,吸去细胞培养孔中的培养液,加入100 μL CCK8混合液,现配现用,继续孵育4 h后用酶联免疫检测仪检测各孔的吸光度(A450nm)值。以时间(T)为横轴,以光吸收值(A)为纵坐标绘制细胞生长曲线。
1.4 细胞划痕实验
取对数生长期的ANSCs,用培养基重悬细胞,将细胞密度稀释至5×104/mL,接种于6 孔细胞培养板,每孔2.0 mL。用Marker笔沿着6 孔板直径平行等距划线,置于37 ℃、5%CO2培养箱中培养24 h时,待细胞密度达80%~90%时进行实验。用200 μL 微量移液器的吸管垂直于定位横线垂直方向均匀划线,划痕完毕后,用移液器缓慢吸出培养液,用不含血清的培养基洗涤细胞2次以除去细胞碎片及漂浮细胞,随后加入无血清培养基2.0 mL。根据分组,在PM组和CPM组分别添加终浓度为1.5umol/L的PM或15 μmol/L的CPM,对照组仅加等量溶剂。所有培养孔在培养0,24,48 h时置于倒置显微镜下观察结果并拍照,使用Image J 软件打开图片,测量划痕面积。迁移面积An=空白面积A0-空白面积An。Cell migration index=(A0-An)/A0。
1.5 RT-qPCR检测
将对照组、PM组、CPM组及细胞培养48 h后进行RT-PCR 检测。以β-actin 为内参照,设计并合成PCR引物。
按说明书Trizol 法提取总RNA,逆转录合成cDNA;按20 μL 配置PCR 反应体系,PCR 扩增条件:95 ℃预变性10 s;95 ℃变性5 s,56 ℃退火20 s,72 ℃延伸10 s,共40个循环。根据荧光阈值(Ct值),以2-△△Ct表示各因子相对表达量。实验重复3次。

表1 用于RT-PCR的引物序列Tab.1 Sequence of primers used in quantitative real-time PCR
1.6 统计学分析
研究结果数据用SPSS 20.0统计软件分析处理,用Image J软件计算划痕实验的面积,用GraphPad Prim8进行图表制作,计量资料的测定结果以均数±标准差表示;两样本均数的比较采用独立样本t检验;多样本均数的比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
2 结果
2.1 Smo调控ANSCs的增殖
相差显微镜下观察可见各组的神经干细胞均随培养时间的延长而逐渐增多。PM组细胞增殖速度最快,而CPM组细胞增殖受到抑制。CCK8定量结果显示,24 h时PM 组与对照组相比,细胞增殖力有显著性提高(P<0.05);CPM组与对照组相比,细胞增殖力无显著性差异。48 h时,与对照组相比,PM组和CPM组细胞增殖力均有统计学差异(P<0.01),PM组细胞增殖力显著提高(P<0.01),CPM 组细胞增殖力显著降低(P<0.05)。
2.2 PM、CPM对ANSCs迁移的影响
培养至24 h,光学显微镜下观察对照组、PM组和CPM组细胞划痕的愈合程度,结果显示,各组细胞迁移指数无统计学差异(P>0.05)。培养至48 h,与对照组比较,CPM组的细胞迁移指数降低,差异有统计学意义(P<0.05),而PM组细胞划痕面积缩小,迁移指数增加,差异有统计学意义(P<0.01)。

图1 PM、CPM对ANSCs增殖的影响Fig.1 Effect of PM and CPM on proliferation of ANSCs in vitro.A:Microscopic observation of ANSCs treated with PM or CPM for 24 and 48 h(Original magnification:×100).B:Cell proliferation detected by CCK8 assay(*P<0.05,**P<0.01 vs control group).
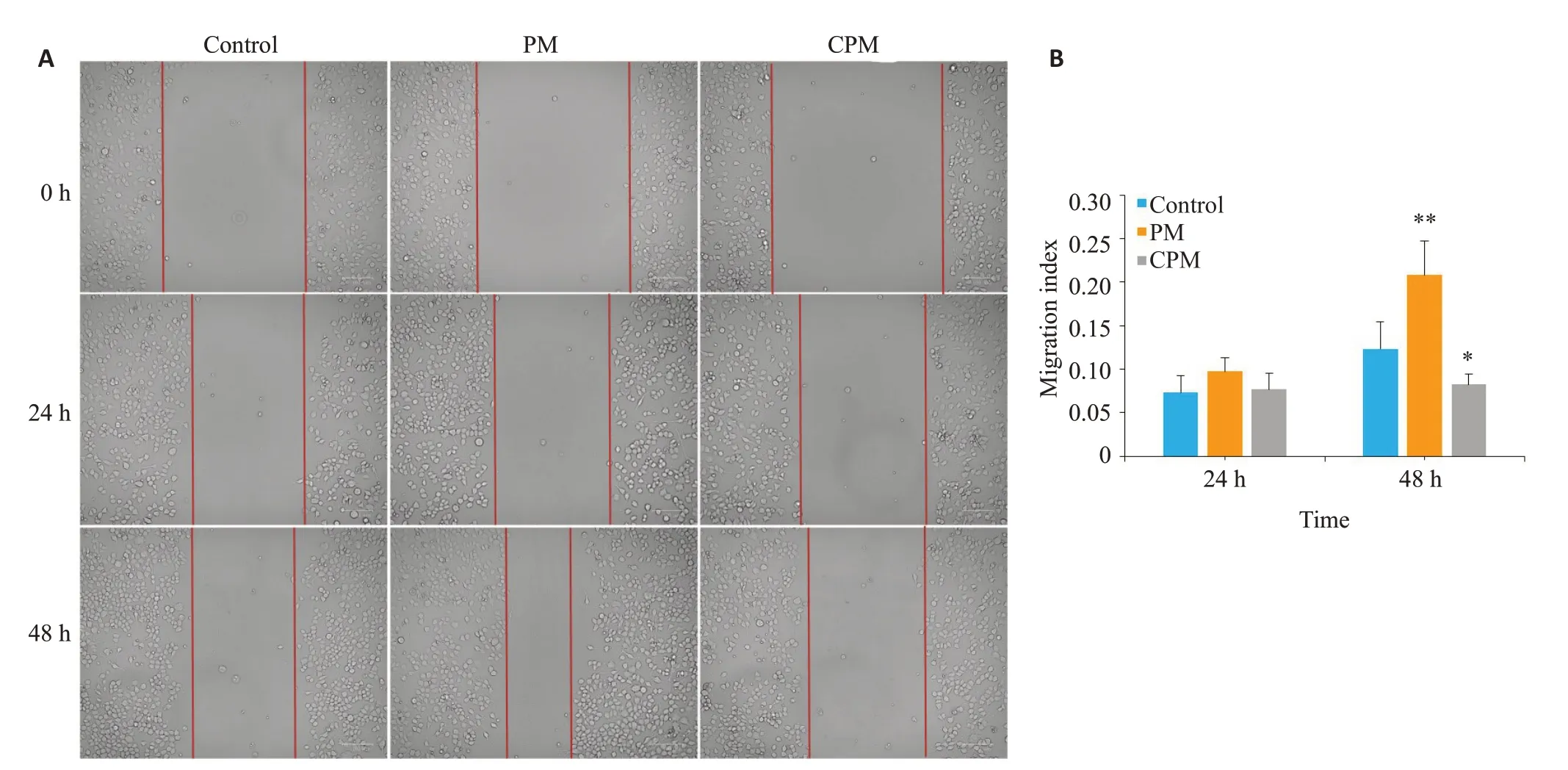
图2 PM、CPM对ANSCs迁移的影响Fig.2 Wound healing assay for assessing migration ability of ANSCs treated with PM or CPM for 24 and 48 h (A;×100) and quantitative analysis(B;*P<0.05,**P<0.01 vs control group).
2.3 PM 上调Smo 的表达以及脑源性神经营养因子(BDNF)、神经导向因子(Slit1)的表达
按上述分组将细胞培养48h,RT-qPCR方法检测各组ANSCs中的G蛋白偶联受体Smoothened(Smo)、细胞表面Patched蛋白(Ptch1)、转录因子(Gli1)表达量。结果显示,PM组与对照组比较,Smo、Ptch1、Gli1因子显著增高(P<0.05)。与对照组、CPM 组比较,PM 组ANSCs中的BDNF及Slit1的表达也显著增高。
3 讨论

图3 各组细胞中Smo、Patch1、Gli1、BDNF、Slit1的表达水平Fig.3 Expression of Smo,Patch1,Gli1,BDNF and Slit1 mRNAS in ANSCs treated with PM or CPM for 48 h detected by qRT-PCR(*P<0.05).
近年来神经退行性疾病发病率逐年上升,有研究表明在成年甚至老年大脑的海马和齿状回等区域仍然分布少量的成年神经干细胞。但是ANSCs数量有限且多处于静息状态,如何促进ANSCs增殖并从海马和齿状回迁移到损伤区对于中枢神经系统退行性疾病治疗有非常大的意义[11-12]。Smo蛋白是Shh信号通路的核心组成成员,能够将胞外的Shh信号转换为胞内的Gli信号,启动细胞核内基因的转录从而激活Shh信号通路[13]。体外细胞培养实验发现,神经细胞遭受神经毒素损害以后,Shh蛋白通过Smo的上调激活Shh信号通路可以促进受损神经细胞的修复[14-15]。在帕金森动物模型中,纹状体内注射Shh蛋白可以减轻其行为损害[16]。也有研究表明Shh 作为干细胞激活因子在组织损伤中积极分泌,受刺激的子宫内膜干细胞在子宫内膜去除术动物模型中显示出明显增强的分化和迁移能力[17]。但关于Smo对神经系统退行性变中的成年神经干细胞迁移的调控作用鲜有报道。有研究表明在实体肿瘤中发现,Smo基因组突变会导致Smo及下游通路异常激活,从而改善肿瘤微环境、促进血管生成,并在肿瘤迁移中发挥促癌作用[18-19]。诸多Smo抑制剂的小分子药物在临床前实验中被发现在治疗某些恶性肿瘤增殖和转移方面相对有效,其中两种口服活性药物已被FDA批准用于治疗晚期肿瘤[20]。使用Smo抑制剂的临床试验的数量之多突出了Smo在癌症中的药理靶向性的重要性[21-22]。由此我们联想到在神经系统退行性变中,Smo激动剂也可以激活Shh信号通路,从而促进神经干细胞的增殖及迁移。从CCK8实验和细胞划痕实验的研究中,我们发现Smo激动剂PM能显著促进ANSCs的增殖,同时也可以促进ANSCs的迁移。在阻断Smo信号通路后,上述结果均被逆转。实验结果与预期一致,证明了调控Smo的活性可以影响ANSCs的增殖和迁移。进一步地,我们揭示促进ANSCs增殖和迁移的可能的作用机制。
BDNF 属于神经营养因子家族,许多研究发现BDNF能够促进发育过程中的神经细胞的存活、分化及增殖,BDNF及其受体TrkB在皮质的ANSCs迁移过程中起着重要的作用[23-24]。不仅如此,它还可以促进受损神经细胞的修复[25-26]。坐骨神经损伤动物模型中,在靠近损伤部位的雪旺细胞中诱导BDNF基因表达之前,Shh表达是上调的,继续给予Smo抑制剂CPM可以抑制BDNF的表达[27]。我们的实验研究中,给予Smo激动剂PM后,发现细胞中的BDNF的基因水平是显著提高的,提示BDNF与Smo的调控有关。Slit1是多功能导向分子,它不仅具有调节神经轴突生长方向、引导神经细胞迁移等功能,而且最近的研究还发现Slit1在血管生成、肿瘤细胞迁移等多个过程中也发挥作用[28-29]。成年期,Shh是一种化学吸引因子,参与了神经干细胞迁移的自主调节。Smo去除与神经干细胞迁移失败有关,推测可能是由神经干细胞内slit1配体的引入引起的间接效应[30-31]。我们的实验研究中,给予Smo激动剂PM后,ANSCs出现了显著的增殖和迁移,进一步,我们发现BDNF和Slit1基因水平显著升高,提示PM可以激动Smo并促进ANSCs的增殖和迁移,它的作用机制可能与激活Smo促进BDNF和Slit1的表达上调有关。
使用Smo的激动剂和抑制剂在体外细胞培养实验中能够调节ANSCs的增殖和迁移,未来仍需进一步研究其在神经系统退行性病变在体实验的作用。

