抑制Notch1/Jagged1通路可促进大鼠骨髓间充质干细胞“归巢”并改善哮喘
王 坤,朱慧志,杨 磊,徐晴雯,任冯春,刘向国
1 新安医学教育部重点实验室,安徽 合肥 230031;2 徽学研究中心安徽中医药大学分中心,安徽 合肥 230031;3 安徽中医药大学中医学院,安徽 合肥 230012;4 安徽中医药大学第一附属医院,安徽 合肥 230031;5安徽中医药大学研究生院,安徽 合肥 230012;6安徽中医药大学中西医结合学院,安徽 合肥230012
支气管哮喘是由多种细胞及细胞组分参与的气道免疫炎症性疾病[1-2],其中辅助T细胞Th1/Th2“漂移”在哮喘炎症的发生发展中起重要作用[3-4]。Th1/Th2间维持动态平衡是机体应对外界刺激的基本免疫调节方式[5]。哮喘作为一种免疫疾病,在过敏原刺激下其发病以Th1/Th2间平衡向Th2“漂移”,形成炎症反应为主要特征[6]。积极有效地调控Th1/Th2“漂移”是治疗哮喘的重要手段。骨髓间充质干细胞(BMSCs)是骨髓中的成体干细胞[7]。既往研究发现[8-9],BMSCs驱动的免疫调节可重新调控Th1/Th2平衡,减少Th2细胞因子,抑制嗜酸性粒细胞在肺组织的聚集,降低哮喘炎症损伤。这一过程的前提是“归巢”:组织发生炎症损伤时,BMSCs向受损部位迁移。归巢能在靶向部位发挥免疫效应。BMSCs归巢对哮喘中的免疫失衡虽有调节作用,但具体作用机制尚不明确。Notch信号通路广泛参与细胞发育、分化及免疫调节等功能活动[10]。Notch 受体(Notch1等)和配体(Jagged1等)结合后,其胞内段易位至细胞核,与DNA结合转录阻遏物结合并作用,将其转化为诱导靶基因转录的转录激活复合物,活化下游靶基因的表达[11]。Notch 通路中的受体Notch1 和配 体Jagged1 是哮喘Th1/Th2 平衡向Th2“漂移”的关键因素。研究表明[12-13],Jagged1蛋白参与了Th2细胞的发育,而Notch1通过促进Th2特异性转录因子GATA-3的表达,诱导Th2细胞分化。BMSCs归巢与Notch通路均与哮喘Th1/Th2“漂移”关系密切,其中可能存在更深入的关联。为进一步观察Notch 通路是否参与哮喘BMSCs归巢过程,本文拟通过阻断Notch信号通路研究BMSCs归巢对哮喘Th2型炎症反应的调节及归巢与Notch1/Jagged1通路的关联性。旨在推测Notch信号通路可能参与了Th1/Th2“漂移”和BMSCs归巢免疫调节,从而改善哮喘炎症反应。
1 材料和方法
1.1 材料
1.1.1 实验动物 清洁级雄性SD 大鼠(20 只,体质量180~200 g),用于实验分组。4周龄清洁级雄性SD大鼠(10只,体质量80~100 g)用于骨髓间充质干细胞及哮喘支气管上皮细胞提取。以上大鼠均由安徽医科大学实验动物管理中心提供。动物伦理由安徽中医药大学动物伦理委员会批准(批号:AHUCM-rats-2019005)。
1.1.2 主要设备和试剂 显微镜(OLYMPUS);超声雾化器(上海鱼跃医疗设备股份有限公司);荧光定量PCR仪(Thermo)。流式细胞仪(贝克曼)。卵清蛋白(OVA):V级(Sigma);酶联免疫吸附法(ELISA)试剂盒(Invitrogen);角蛋白8(keratin 8)抗体(Abcam)。CD29-异硫氰基荧光素(FITC)、CD45-FITC、CD44-藻红蛋白(PE)、CD11b/c-PE单克隆抗体(eBioscience)。PCR试剂盒(赛默飞);趋化因子受体4抗体(Proteintech);Cy3标记山羊抗兔IgG(H+L)(Beyotime);T-bet、GATA-3、Notch1、Jagged1抗体(Santa Cruz)。
1.2 方法
1.2.1 分组 将20只大鼠用随机数字表法分为正常对照组(NC)、模型对照组(MC)、BMSCs移植组(BMSCs)、BMSC+Notch抑制剂组,5只/组。
1.2.2 间充质干细胞的分离、培养、鉴定 4周龄大鼠断颈处死后,取股骨并剪去两端,吸取胎牛血清+双抗溶液多次冲出骨髓细胞后吹打,1000 r/min离心5 min,弃上清,用PBS 重悬细胞,以2×106/cm2密度接种,置于37 ℃、5%CO2恒温培养箱中培养。每3~4 d更换1次培养基。原代细胞融合至80%~90%左右开始传代培养,调整细胞浓度至1×106/mL,倒置显微镜下观察细胞形态。取融合达90%的第4代BMSCs,分别加入荧光标记的抗体(Anti-CD29-FITC、Anti-CD44-PE、Anti-CD45-FITC、Anti-CD11b/c-PE),混匀,4 ℃避光孵育30 min,PBS漂洗2遍以去除未结合的抗体,流式细胞仪鉴定其表面标志物。
1.2.3 CFSE标记BMSCs 将荧光染料羧基荧光素二醋酸盐琥珀酰亚胺(CFSE)以DMSO溶解,配成使用液,贮存于4 ℃条件下,避免反复冻融。移植前将5×106BMSCs细胞悬浮于2 mL 0.1%BSA/PBS 内,加入2 μL CFSE工作液,置37 ℃10 min;4倍体积4 ℃的胎牛血清终止反应,室温5 min;PBS室温洗涤3次,第2次结束后37 ℃5 min;将1×106BMSCs细胞悬浮于1 mL PBS内,备用于移植。
1.2.4 哮喘模型建立[14]及细胞移植 除正常对照组外的各组大鼠,在第0和7天腹腔注射致敏混合液(含1 mg 10%卵清蛋白和100 mg氢氧化铝凝胶),第14天将大鼠置于密闭容器内,予1%卵清蛋白雾化激发,30 min/次,1次/d,连续7 d。正常组予生理盐水替代完成上述操作。BMSCs组及BMSCs+Notch抑制剂组在激发最后一天经尾静脉将CFSE标记的1×106/mL BMSCs悬液植入体内,其余2组以PBS替代注射。BMSCs+Notch抑制剂组在激发前1 h按1 mg/kg体质量腹腔注射抑制剂,隔日1次,连续7 d。
1.2.5 哮喘支气管上皮细胞的分离及鉴定 大鼠麻醉后在无菌环境下取出气管,清除肺组织及表面其他软组织后,灌入1%链酶蛋白酶,结扎上端,4 ℃过夜,置于90 mm培养皿中,剪开气管,予培养基冲洗,细胞刷充分刷洗,收集培养皿中的刷洗液,离心洗涤收集细胞。1000 r/min离心5 min,弃上清,用原代细胞培养液吹打细胞后置于无菌培养瓶,置于37 ℃、5%CO2恒温培养箱中培养,备用于实验。各组分离培养获得的支气管上皮细胞与角蛋白单克隆抗体作用后,经细胞核荧光染料4',6-二脒基-2-苯基吲哚(DAPI)染色,磷酸缓冲盐溶液(PBS)漂洗,置于荧光显微镜下观察。
1.3 观察指标
1.3.1 间充质干细胞归巢至肺组织观察 在BMSCs移植后24、72、144 h取大鼠肺组织,将组织剪成1~2 mm3小块,用消化酶消化,不锈钢过滤网过滤消化液,调整各组全肺单个细胞悬液浓度,采用流式细胞术和荧光显微镜分析CFSE-BMSCs(绿色)荧光强度。
1.3.2 支气管上皮细胞CXCR4表达检测 采用免疫荧光检测支气管上皮细胞CXCR4表达。将分离培养获得的支气管上皮细胞传代,待长至80%~90%经PBS洗涤、胰酶消化,充分吹打成单细胞悬液,接种于已置玻片的6孔板。爬片以4%多聚甲醛避光固定,滴加5%BSA均匀覆盖。经CXCR4抗体(1∶100),Cy3标记山羊抗兔IgG(H+L)(1∶500)作用后,予以DAPI染色,封片,置于荧光显微镜下观察并采集图像。(DAPI紫外激发波长330~380 nm,发射波长420 nm,发蓝光;CY3激发波长510~560 nm,发射波长590 nm,发红光)。
1.3.3 肺组织病理形态学观察 取大鼠右下肺组织,石蜡包埋,HE染色,光学显微镜下观察肺组织病理形态学变化。
1.3.4 哮喘大鼠肺组织Th1/Th2细胞表达 检测各组大鼠肺组织IFN-γ、IL-5、IL-13的蛋白水平,操作方法按照美国Invitrogen的ELISA试剂盒操作步骤,用酶标仪测定并计算各组蛋白含量。
1.3.5 肺组织Notch1/Jagged1通路相关基因表达 提取大鼠肺组织总mRNA,Notch1、Jagged1引物设计由上海生工合成(Notch1、Jagged1引物序列见表1)。反转录试剂盒反转录第一链互补DNA(cDNA),PCR扩增,扩增产物进行1.5%琼脂糖电泳,UVP凝胶显像仪扫描,图像分析。以β-actin作为内源参照,使用2-ΔΔCT方法计算Notch1、Jagged1 mRNA的相对表达量。
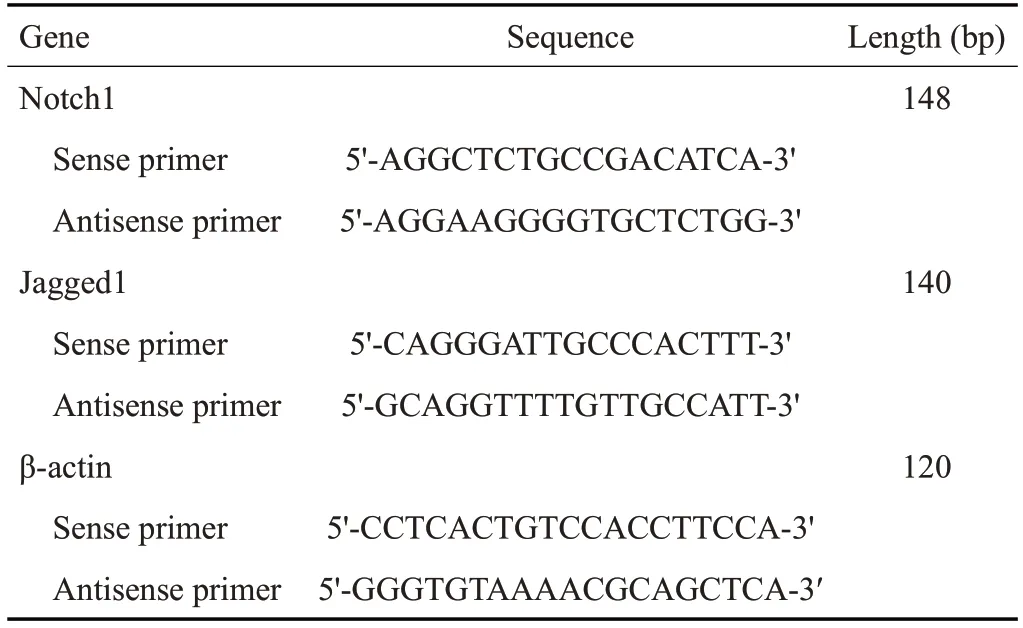
表1 Notch1、Jagged1引物序列Tab.1 Primer sequences of Notch1 and Jagged1
1.3.6 肺组织T-bet、GATA-3、Notch1、Jagged1蛋白表达将肺组织在冷的组织裂解缓冲液中均匀化、溶解,提取肺组织总蛋白。将样品放入标准蛋白样品缓冲液中煮沸,用10%三甘氨酸凝胶进行蛋白电泳,然后转移至聚偏二氟乙烯膜膜。将膜依次加入T-bet、GATA-3、Notch1、Jagged1一抗(稀释浓度分别为1∶1000、1∶1000,1∶800、1∶1000)、二抗(山羊抗兔IgG,上海碧云天生物技术有限公司,A0516)孵育,稀释浓度为1∶5000,按照标准规程对膜进行显影。使用发光试剂盒检测试剂对这些条带进行曝光、显影。Image J量化各个条带的强度,并以相对于内参β-actin的百分比表示T-bet、GATA-3、Notch1、Jagged1蛋白表达量。
1.4 统计学分析
采用SPSS19.0统计软件对数据进行统计分析,结果用均数±标准差表示,各组间比较采用单因素方差分析,两组间比较采用独立样本t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 骨髓间充质干细胞、支气管上皮细胞鉴定骨髓间充质干细胞观察及鉴定
初次接种2 h后开始贴壁,细胞呈类圆形,密集分布,排列无序。原代培养7 d后,细胞开始增殖,形态呈锤形或梭形。第3代未分化间充质干细胞,形态均一呈成纤维细胞样,漩涡状分布,排列整齐有序。流式细胞仪分析发现,BMSCs表面标志物CD29、CD44呈阳性,表达量分别为97.4%、96.5%。CD45、CD11b呈阴性,表达量分别为1.62%、1.08%(图1)。支气管上皮细胞鉴定:经DAPI染色后细胞核呈蓝色荧光,支气管上皮细胞特异性目的蛋白keratin 8的抗体表达于胞浆,呈红色荧光,鉴定为支气管上皮细胞(图2)。

图1 BMSCs表面标志物CD29、CD44、CD45、CD11b表达Fig.1 Expression of BMSC surface markers CD29,CD44,CD45 and CD11b.
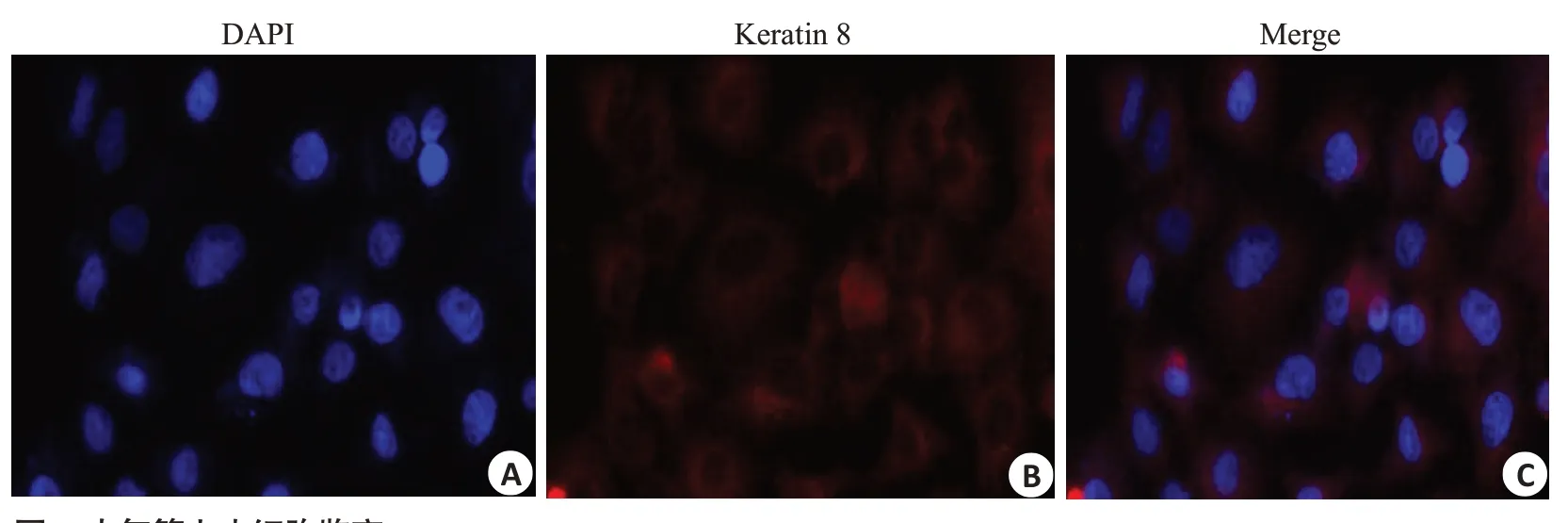
图2 支气管上皮细胞鉴定Fig.2 Identification of bronchial epithelial cells (Immunofluorescence staining,original magnification:×200).A:The nuclei of bronchial epithelial cells were blue after DAPI staining;B:The cytoplasm showed red fluorescence;C:Merged image.
2.2 骨髓间充质干细胞归巢至肺组织观察
通过将CFSE标记BMSCs移植至哮喘大鼠体内,追踪CFSE表达量来反映BMSCs在肺组织中的归巢程度。流式细胞术观察肺组织CFSE表达量发现,BMSCs体内移植后,24 h CFSE表达量为(4.89±1.65)%,72 h CFSE表达量为(14.78±4.65)%,144 h CFSE表达量为(3.07±1.06)%,CFSE在肺组织表达量随着时间推移逐渐升高,在72 h 达到高峰,后逐渐降低,证明移植后BMSCs可向肺组织归巢,表明同源异体BMSCs经尾静脉注射入哮喘大鼠体内后可向肺组织迁移(图3)。
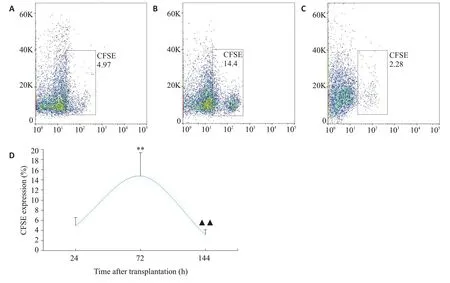
图3 CFSE标记的BMSCs在哮喘大鼠肺组织中表达Fig.3 Expression of CFSE-labeled BMSCs in lung tissues of asthmatic rats.A:Homing amount of CFSE+cells at 24 h.B:Homing amount of CFSE+cells at 72 h.C:Homing amount of CFSE+cells at 144 h.D:Comparison of CFSE expression across the time points.**P<0.01 vs 24 h;▲▲P<0.01 vs 72 h.
2.3 支气管上皮细胞中CXCR4表达
NC组与MC组之间比较,MC组CXCR4表达量较NC 组升高(t=2.8271、P=0.0222)。BMSCs 移植及Notch 抑制剂干预后发现,与NC 组、MC 组比较,BMSCs组、BMSCs+Notch抑制剂组CXCR4表达量均显著升高(t=2.6021、P=0.0315,t=5.8649、P=0.0004)。与BMSCs组比较,BMSCs+Notch抑制剂组CXCR4表达量升高(t=3.254、P=0.0116,图4)。

图4 支气管上皮细胞中CXCR4表达Fig.4 CXCR4 expression in bronchial epithelial cells (immunofluorescence staining,×200).A:NC group;B:MC group;C:BMSCs group;D:BMSCs+Notch inhibitor group;E:Comparison of relative expression of CXCR4 among the groups.*P<0.05,**P<0.01 vs NC group;ΔP<0.05,ΔΔP<0.01 vs MC group;▲P<0.05 vs BMSCs.
2.4 肺组织病理形态学观察
NC组大鼠肺组织结构完整,支气管管腔无狭窄,管腔壁无增厚紊乱,周围无明显炎症细胞浸润。MC组大鼠肺组织结构受损明显,支气管管腔狭窄,平滑肌增生明显,周围大量炎症细胞浸润,以嗜酸性粒细胞为主,成团聚集。BMSCs组及BMSCs+Notch抑制剂组肺组织受损、管腔狭窄及炎症细胞浸润情况均较模型组有不同程度减轻(图5)。
图5 各组大鼠肺组织病理形态学观察Fig.5 Observation of pathologies of rat lung tissue in each group (HE staining,×200).A:NC group;B:MC group;C:BMSCs group;D:BMSCs+Notch inhibitor group.
2.5 肺组织Th1、Th2细胞因子表达
ELISA结果显示,与NC组比较,MC组IFN-γ表达降低(t=5.2001、P=0.0008),IL-5、IL-13表达升高(t=4.2173、P=0.0029,t=3.7989、P=0.0052)。
与MC组比较,BMSCs组、BMSCs+Notch抑制剂组IFN-γ表达升高(t=2.653、P=0.0291,t=5.4014、P=0.0006);BMSCs+Notch抑制剂组IL-5、IL-13降低(t=2.5386、P=0.0348,t=3.7295、P=0.0058)。BMSCs组IL-5(t=1.8189、P=0.1064)、IL-13(t=1.1298、P=0.2913)表达降低,但差异无统计学意义(P>0.05)。
与BMSCs组比较,BMSCs+Notch抑制剂组IFN-γ表达升高(t=2.7269、P=0.0260),IL-13降低(t=2.9032、P=0.0198,表2)。

表2 肺组织Th1/Th2细胞表达Tab.2 IFN-γ,IL-5 and IL-3 expressions in the lung tissue(Mean±SD,pg/mL,n=5)
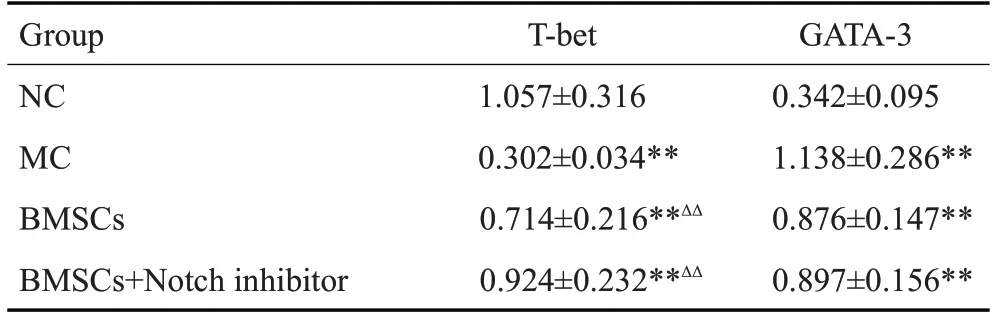
表3 肺组织Th1、Th2细胞特异性转录因子蛋白表达Tab.3 Expression of Th1 and Th2 cell-specific transcription factor proteins in the lung(Mean±SD,n=5)
2.6 肺组织Th1、Th2细胞特异性转录因子蛋白表达
免疫印迹结果显示,与NC组比较,MC组肺组织Th1 细胞特异性转录因子T-bet 蛋白表达降低(t=5.3118、P=0.0007),Th2细胞特异性转录因子GATA-3蛋白表达升高(t=5.9062、P=0.0004)。经BMSCs移植及Notch1 通路阻滞剂后,与MC 组比较,BMSCs 组、BMSCs+N抑制剂组T-bet蛋白表达升高(t=4.2132、P=0.0029,t=5.9316、P=0.0003),BMSCs组、BMSCs+N抑制剂组GATA-3 蛋白表达降低,但无统计学意义(P>0.05,表4,图6)。
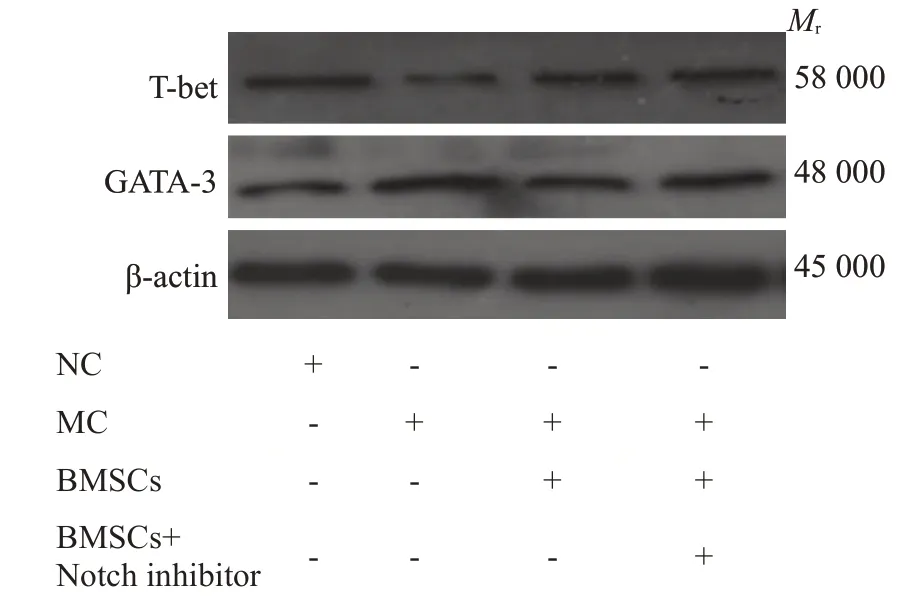
图6 肺组织Th1、Th2细胞特异性转录因子蛋白表达Fig.6 Th1 and Th2 cell specific transcription factor protein expression in lung tissue.
2.7 肺组织Notch1/Jagged1表达
RT-PCR 检测结果显示,与NC 组比较,MC 组Notch1、Jagged1 mRNA和蛋白表达升高(P<0.01)。与MC组比较,BMSCs组Notch1、Jagged1 蛋白表达降低,BMSCs+Notch抑制剂组Notch1、Jagged1mRNA和蛋白表达降低(P<0.05或P<0.01)。与BMSCs组比较,BMSCs+Notch抑制剂组Notch1mRNA表达降低(P<0.05,表5,图7)。
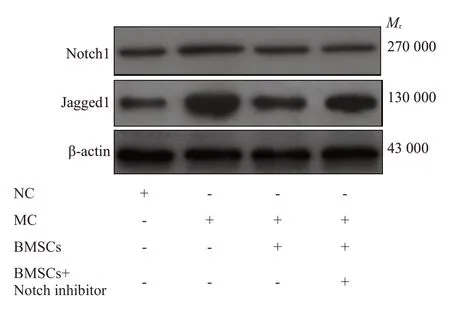
图7 肺组织Notch1、Jagged1蛋白表达Fig.7 Expression of Notch1 and Jagged1 protein in lung tissue.

表5 肺组织Notch1/Jagged1表达Tab.5 Expression of Notch1/Jagged1 in lung tissue(Mean±SD,n=5)
3 讨论
哮喘作为免疫相关的疾病,是以Th1/Th2失衡诱发的Th2型免疫炎症占主导[15]。骨髓反应机制参与了哮喘炎症的发生发展。在过敏原刺激下,Eos/B祖细胞自骨髓释放量增多,经外周循环周转至肺,在Th2细胞因子IL-4、IL-5等调控下分化成熟,出现以嗜酸性粒细胞气道浸润为主的哮喘病理变化[16-17]。哮喘气道炎症反应是多种炎症细胞及细胞组分相互作用的结果[18]。过敏原刺激下,细胞免疫调节功能下降,导致Th1/Th2平衡向Th2“漂移”,Th1细胞因子(IFN-γ等)分化受抑制,Th2炎症因子(IL-5、IL-13等)大量产生,通过促进肥大细胞募集,IgE合成,嗜酸性粒细胞浸润等方式,促进哮喘炎症反应的发生发展[19-20]。本研究结果显示,与NC组比较,MC组IFN-γ表达降低,IL-5、IL-13表达升高。而Th1、Th2转录因子亦随之变化,同时大量Th2型炎性因子分化并对相关炎症介质的调控作用,致使慢性气道炎症发生及加剧。此研究结果与Abdolreza等[21]的研究结果相似。
源于骨髓的间充质干细胞具有多向分化能力,增殖性高且具有良好的免疫调节性和免疫相容性。BMSCs通过调节免疫炎症可有效改善哮喘[22]。哮喘发作时,BMSCs通过调节树突状细胞和T细胞功能,抑制相关炎症细胞的分泌,发挥免疫调节剂的作用[23]。本次研究发现,将间充质干细胞注射入哮喘大鼠体内后,支气管上皮细胞中CXCR4表达随之升高,且肺组织病理形态学改善。说明BMSCs可有效缓解哮喘炎症损伤。而改善的前提是“归巢”,“归巢”使得骨髓中休眠的BMSCs被炎症损伤部位分泌的趋化因子“唤醒”,迁移至受伤的肺组织,免疫调节炎症环境和修复受损肺组织,从而改善哮喘症状。Th1/Th2“漂移”即Th2型反应模式是哮喘气道炎症的重要特征,也是哮喘炎症形成的始动和维持因素。BMSCs具有免疫相容性和免疫调节的特征[24]。免疫相容性使得BMSCs不易被机体的免疫细胞识别,有效逃脱免疫系统的攻击排斥,为异体应用提供可能[25]。本研究发现,经BMSCs 干预后,BMSCs 组、BMSCs+Notch抑制剂组IFN-γ表达升高,IL-5、IL-13表达降低。提示在机体出现炎症反应时,受损部位释放趋化因子与
BMSCs表面的趋化因子受体(CXCR4)结合,沿着趋化轴,BMSCs归巢至炎症损伤部位,调节免疫内环境,发挥抑制炎症和组织修复作用,从而改善哮喘大鼠肺组织病理形态学变化。研究表明[26],在哮喘的炎症反应中,BMSCs可通过分泌和调节生长因子、细胞因子、抗纤维化因子等实现旁分泌效应,抑制T细胞的过度活化,改变Th1/Th2平衡,缓解哮喘气道炎症。
Notch信号通路广泛参与多种组织细胞的信号识别、增殖、分化和凋亡等功能活动[27]。在哺乳动物中,Notch通路由Notch配体和Notch受体组成,它们都是I型跨膜蛋白[28]。受体与配体结合,在受体Jagged1触发后由γ-分泌酶介导的蛋白水解机制释放Notch胞内域(NICD),通过与DNA 结合蛋白(DNA 结合转录阻遏物)关联介导了Notch信号的传导[29]。这种蛋白质-蛋白质间的相互作用可激活下游的基因[30]。Notch信号通路参与了对BMSCs的调控。有研究发现[31],Notch信号通路可抑制间充质干细胞向成骨细胞转化。用Jagged1处理BMSCs后,BMSCs中下游的基因mRNA水平显着增加,BMSCs中的白蛋白表达被阻断。研究还发现[32],通过γ-促分泌酶抑制剂阻断Notch 信号传导或敲除BMSCs 中Notch 信号的转录因子RBP-J 可导致CXCR4表达上调,并促进BMSCs在体外和小鼠肝脏缺血/再灌注模型体内肝脏组织中对SDF-1的反应,说明通过阻断Notch信号传导可上调BMSCs中的CXCR4表达以达到增强BMSCs归巢能力的目的。本次研究结果显示,与NC组比较,MC组Notch1mRNA、Jagged1mRNA表达升高,Notch1、Jagged1蛋白表达升高。说明哮喘发生时存在Notch信号通路受体和配体表达的变化。而通过BMSCs 植入归巢后发现,BMSCs 组、BMSCs+Notch抑制剂组Notch1mRNA、Jagged1mRNA表达降低,且BMSCs+Notch抑制剂组Jagged1蛋白降低更明显,说明抑制Notch通路过激活可促进BMSCs归巢,从而影响哮喘的进展。
综上所述,哮喘存在Th1/Th2平衡向Th2“漂移”,且BMSCs向哮喘肺组织归巢对Th1/Th2“漂移”产生调节作用,而Notch1/Jagged1通路可能参与其过程,通过抑制Notch1/Jagged1通路过激活可改善哮喘炎症的发作。

