Mage-D1与活化后的p75神经营养因子受体结合可正向调节大鼠外胚间充质干细胞的矿化
罗玉婷,杨正艳,李 蒙,赵曼竹,温秀杰,周 智
1重庆医科大学附属口腔医院,重庆 401147;2口腔疾病与生物医学重庆市重点实验室,重庆 401147;3重庆市高校市级口腔生物医学工程重点实验室,重庆 401147;4四川省泸州市西南医科大学附属口腔医院正畸科,四川泸州646000
外胚间充质干细胞(EMSCs)来源于颅神经嵴,是牙齿发育的始祖细胞[1-3]。向平滑肌和成骨细胞分化的特点限制了它在牙发育中的应用[4,5]。为了促使EMSCs发挥最大效能,本课题组利用颅神经嵴细胞中高表达的p75神经营养因子受体(p75NTR)对EMSCs进行分选纯化[6],成功获得p75NTR阳性EMSCs[7],并发现其正向调控了EMSCs在牙发育过程中的矿化[8]。p75NTR是神经生长因子(NGF)的低亲和力受体,属Ⅰ型跨膜肿瘤坏死受体超家族成员[9]。前期研究发现p75NTR可能参与牙发育初期上皮与间充质相互作用的调控[10]。它与小鼠牙齿硬组织形成的的昼夜节律有关,其缺失会降低牙槽骨的骨量[11]。此外,它还协同参与多条信号通路调控EMSCs成骨分化[11,12]。
p75NTR可能通过改变Dlx和Msx的转录活性从而进一步调控牙齿的发育,但中间信使是什么尚不清楚。查阅文献发现黑色素瘤相关抗原Mage-D1可能是p75NTR参与调控的下游因子[13]。Mage-D1属黑色素抗原蛋白家族Ⅱ型蛋白,介导了多种细胞生理功能,它与p75NTR的胞内域结合发挥调控作用[14],还能调控Dlx/Msx 转录活性[15]。前期实验发现:Mage-D1 与p75NTR的组织学表达模式相近,免疫共沉淀结果也显示随着矿化天数增加,二者结合呈增多趋势,矿化相关基因表达增高[16]。基于以上,我们提出p75NTR-Mage-D1-Dlx/Msx信号通路假说。本研究通过高灵敏度的邻位连接法确证Mage-D1与活化后的p75NTR在EMSCs中的结合,使结合部位在细胞中可视化,并进一步研究二者结合对EMSCs矿化的调控作用,以期为颌骨及牙齿发育提供新依据。
1 材料和方法
1.1 实验动物与主要试剂
SD大鼠由重庆医科大学实验动物中心提供,实验过程及动物处死方法均经实验动物福利伦理审查委员会审查通过(201903-187)。
DMEM-F12培养基(Hyclone),胰酶(Hyclone),胎牛血清(Hyclone),CD44、CD90、CD29、CD146、CD105、CD45(Santa Cruz)、p75NTR抗体(Invitrogen),Mage-D1 抗体(Biorbyt),山羊抗小鼠IgG,山羊抗兔IgG,CCK-8试剂(碧云天),NGF(Peprotech),DUOLINK PLA试剂盒(Sigma),0.2%茜素红溶液(碧云天),碱性磷酸酶显色试剂盒(上海生工),TRIzol Reagent RNA提取试剂盒(Invitrogen),TB Green Premix EX TaqⅡ(Takara),Western blot凝胶试剂盒(康为世纪)。
1.2 方法
1.2.1 E19.5 d EMSCs培养及表面抗原鉴定 SD大鼠胚胎发育至第19天时处死,取出胚胎,分离上下颌,于体视显微镜下取出牙胚组织,置于培养瓶中,加入含10%FBS的DMEM-F12。置于37 ℃含5%CO2的恒温箱中静置贴壁培养,约24 h后可观察到组织块周围细胞呈放射状生长。视细胞生长情况进行传代。
取生长状态良好的第3代EMSCs,胰酶消化离心后于4 ℃冰箱固定30 min,12000 r/min离心5 min,PBS清洗并重悬,稀释为每1.5 mLEP管1×106细胞,加入CD44、CD90、CD29、CD146、CD105、CD45单克隆抗体2µL,4 ℃冰箱过夜孵育。次日加入相应荧光二抗避光孵育2 h,清洗后加3%FBS-PBS重悬,流式细胞仪检测。
1.2.2 邻位连接法检测Mage-D1与p75NTR在EMSCs中的结合 选择生长良好的第3代EMSCs制备成密度为5×103/mL的悬液,接种至含细胞爬片的孔板中。4%多聚甲醛室温于加入100 ng/mL NGF的不同时间点(0、2、12、24、72 h)固定,封闭,加入Mage-D1与p75NTR一抗4 ℃过夜。次日,加入PLA探针37 ℃孵育1 h,缓冲液A清洗。随后加入连接酶溶液37 ℃反应30 min,缓冲液A清洗。避光加入扩增酶溶液37 ℃反应100 min,缓冲液B清洗。干燥,DAPI染核5 min;显微镜分析。具体操作按试剂盒说明书进行。
以未加入任何干预为空白对照组(NC),实验组为:100 ng/mL NGF 组和SH-Mage-D1 组。即,仅使用100 ng/mL NGF刺激EMSCs,及仅加入慢病毒液干扰Mage-D1,嘌呤霉素筛选出稳定表达的EMSCs。待各组细胞汇集率达80%时按上述同样方法进行检测,并比较结合强度的差异。
1.2.3 茜素红及ALP染色 常规消化第3代EMSCs,以5×104/孔的密度接种于孔板中。在矿化诱导(配方为含10 mmol/Lβ-甘油磷酸钠,50μg/mL维生素C,1×10-8mol/L地塞米松、10%FBS的α-MEM培养基)第14天时,对各组进行多聚甲醛固定,染色。
1.2.4 RT-PCR与Western blot检测基因与蛋白表达 收集各组矿化诱导第7天后的细胞,按TRIzol说明书方法提取总RNA,并用反转录试剂盒合成cDNA。以甘油醛-3-磷酸脱氢(GAPDH)为内参照,采用RT-PCR 检测。所用引物均由Takara公司合成(表1)。成骨诱导第14天提取细胞蛋白,BCA法测定蛋白浓度,以GAPDH为内参,进行Western blot检测蛋白表达情况。

表1 引物基因序列Tab.1 Primer sequence for qRT-PCR
1.2.5 统计学方法 实验数据使用Graphpad Prism 8软件统计分析与作图,定量资料以均数±标准差表示,NGF刺激组与空白组,以及SH-Mage-D1与空白组间分别采用独立样本t检验,P<0.05认为差异有统计学意义。所有实验均独立重复3次。
2 结果
2.1 E19.5d EMSCs的分离培养与表面分子鉴定
通过组织块贴壁法成功获得E19.5 d原代EMSCs,并培养至第3代E19.5 d,细胞形态规则,为间充质干细胞纺锤样形态,呈梭形或多边形(图1A)。流式细胞仪检测细胞表面分子情况:CD44(98.0%)、CD90(98.2%)、CD29(97.7%)、CD146(97.9%)、CD105(97.8%)、CD45(0.3%)(图1B)。

图1 E19.5d EMSCs的分离培养与表面分子鉴定Fig.1 Isolation,culture and characterization of E19.5 d EMSCs.A:Primary and third-passage EMSCs (Scale bar=100 µm).B:The cells show high expressions of the MSC markers CD44,CD90,CD29,CD146 and CD105 while CD45 expression is hardly detected.
2.2 Mage-D1与p75NTR在EMSCs的结合
邻位连接法检测显示随着加入100 ng/mL NGF时间的延长Mage-D1与活化后p75NTR的结合也愈多,且大部分集中在胞浆,极少部分位于细胞核内(图2A);当慢病毒干扰Mage-D1 后二者结合也随之减弱(图2B),且实验组荧光强度与对照组相比具有统计学意义(图2C)。
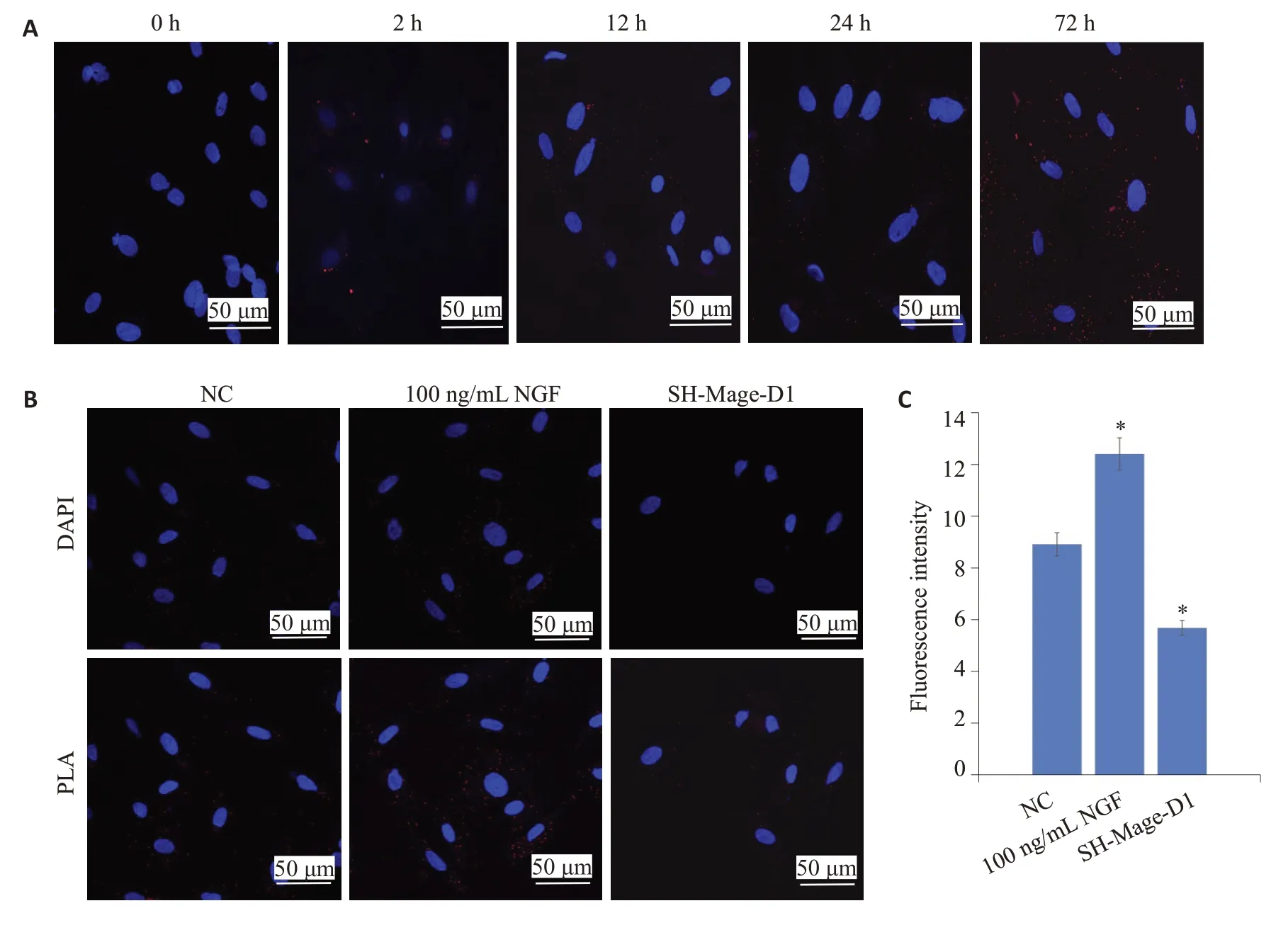
图2 邻位连接法检测Mage-D1与p75NTR在EMSCs的结合Fig.2 Binding of Mage-D1 and p75NTR in the EMSCs.A:Proximity ligation assay for detecting the binding of the Mage-D1 and p75NTR in cells treated with 100 ng/mL NGF for 0,2,12,24 and 72 h (Scale bar=50 µm).B:Binding of Mage-D1 and p75NTR in the cell in the control,100 ng/mL NGF and SH-Mage-D1 groups(Scale bar=50µm);C:Quantitative analysis of PLA fluorescence signals(*P<0.05 vs NC).
2.3 茜素红与ALP染色
对矿化诱导液14 d后的细胞进行茜素红与ALP发现,100 ng/mL NGF组细胞矿盐沉积与碱性磷酸酶均最强,SH-Mage-D1组最弱(图3)。
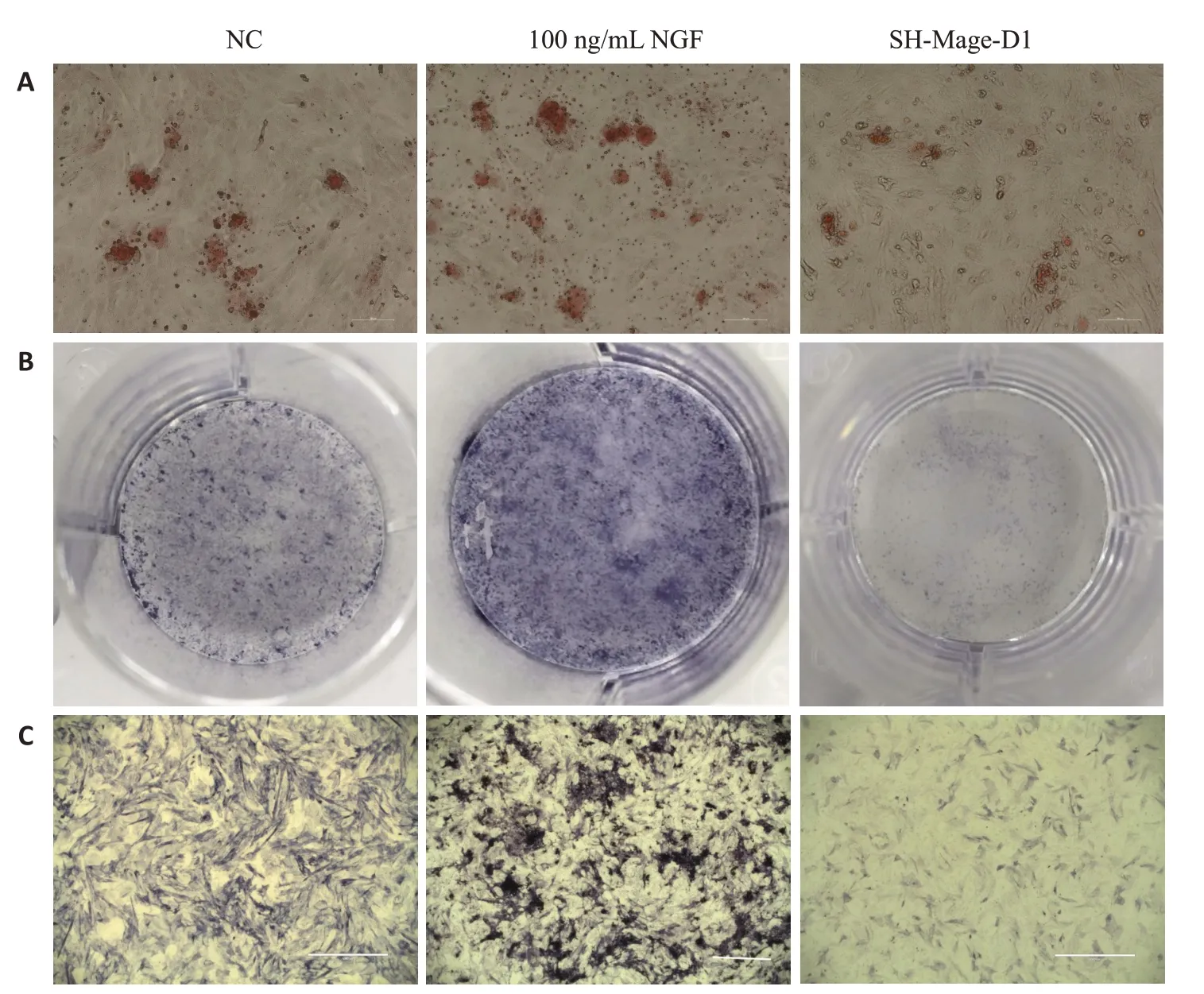
图3 茜素红与ALP染色Fig.3 Alizarin red staining (A) and ALP staining (B,C) of the EMSCs after 14 days of osteogenic induction(scale bar=100 μm).
2.4 RT-PCR与Western blot检测基因与蛋白水平
RT-PCR 与Western blot 检测ALP、Runx2、OCN、BSP、OPN、Col1、Dlx1及Msx1基因与蛋白水平发现,100 ng/mL NGF组的基因与蛋白表达最强,SH-Mage-D1组最弱,与对照组相比差异均具有统计学意义(图4A,4B)。

图4 RT-PCR与Western blot检测基因与蛋白水平Fig.4 RT-PCR(A) and Western blotting (B) for detecting ALP,Runx2,OCN,BSP,OPN,Dlx1 and Msx1expressions in the EMSCs after osteogenic induction(*P<0.05 vs NC).
3 讨论
神经嵴是脊椎动物胚胎发育过程中的暂时性结构[17]。当颅神经嵴向腹外侧迁移至面突中胚层后被称为外胚间充质。颅颌面部的大部分组织结构都可由神经嵴来源的外胚间充质组织发育而来[18,19],因此被认为是颌面部发育的始祖细胞。
它是首个被发现的NGF低亲和力受体,可发挥多种生物学效应,不仅在整个生命过程中对神经损伤修复,促进细胞生长分化等过程中具有极重要作用[20],还参与了牙齿形态形成、牙齿硬组织的矿化[21]以及牙发育初期的调控[13]。p75NTR是由胞内结构域、跨膜域和胞外结构域构成的跨膜蛋白,其胞外结构域可与NGF结合[22]。当加入外源性NGF后,发现p75NTR敲除小鼠的成骨分化能力不如野生型小鼠,这说明NGF可激活p75NTR从而正向调控的EMSCs成骨分化[11]。本研究结果也证实,当p75NTR被外源性NGF激活后,EMSCs的矿化能力增强。
p75NTR发挥生物学功能主要是靠配体类型及所激活的信号通路。因其胞内域不具有固有的酶活性,因此依赖于与胞浆结合蛋白的相互作用来诱导下游效应。Mage-D1能与多种胞内胞外蛋白结合,并介导多种细胞生理功能,如凋亡[23]、转录[15]等。Salehi[14]发现,Mage-D1 可通过其同源结构域与NGF 的另一受体TrkA竞争结合p75NTR。当Mage-D1与p75NTR的胞内域结合后,在下游信号传递中发挥直接作用或通过促进p75NTR胞内域的生成来介导生物学效应。并且研究显示TrkA在EMSCs和大鼠胚胎第一磨牙的发育中未见表达,因此p75NTR 失去TrkA 的竞争从而与Mage-D1结合发挥调控功能[24]。在本研究中,通过邻位连接法检测发现,当p75NTR被活化后直接与Mage-D1结合,且发现二者结合信号多聚集在胞浆中,极少部分位于细胞核中。这说明,当p75NTR被活化后,产生水解效应[25],裂解后释放其胞内段至胞浆内[26]与Mage-D1结合,之后二者共同作用调节生物学功能。为了进一步验证,我们利用慢病毒干扰Mage-D1,当Mage-D1表达水平的下降,p75NTR与Mage-D1结合的信号强度也下降,染色与基因蛋白的表达水平均降低,更加确证了p75NTR与Mage-D1在EMSCs中的结合及对EMSCs成骨分化的调控作用。
在牙齿早期发育中有许多转录因子表达,这些转录因子通过调节生长因子进一步调控牙发育。Dlx和Msx属于同源盒基因家族,被广泛认为是颅面和牙齿发育的关键因子[27-29]。已经证实Mage-D1可通过自身的六肽重复序列与Dlx、Msx结合从而发挥调控作用[30,31]。在本研究中,RT-PCR检测发现,Dlx1和Msx1的基因表达水平随着p75NTR与Mage-D1结合强度变化而出现变化,并且相应的成骨分化能力出现改变。这进一步说明Mage-D1与p75NTR结合后,结合信号由胞外传至胞内。在胞内,Mage-D1与Dlx/Msx家族结合,再向细胞核内转移上调Dlx/Msx的转录活性,从而促进成骨细胞分化[32]。
本研究初步验证了Mage-D1与p75NTR在EMSCs的结合及对矿化正向调控的作用。通过100 ng/mL NGF刺激EMSCs后,Mage-D1与p75NTR结合随时间延长而增多,而当慢病毒干扰Mage-D1使其表达降低后,结合也随之降低。并且随着结合强度的变化,成骨分化能力也发生改变。虽然以往研究通过免疫共沉淀初步证明了Mage-D1与p75NTR的结合,但本研究使用具有高灵敏度的邻位连接法进一步确证了二者的结合,并且可以直观的观察到Mage-D1与p75NTR结合的部位,使得结合可视化[33]。综上所述,本研究证明Mage-D1可与活化后的p75NTR相结合,影响了Dlx/Msx的转录活性,从而调控EMSCs的矿化。但本研究仅从细胞水平证明二者的结合,还需借助敲除小鼠等多种研究方法验证p75NTR-Mage-D1-Dlx/Msx信号通路假说,以期揭示牙发育的复杂机制,为推进牙齿组织工程化进程提供新的科学依据。

