煤矸石充填复垦土壤细菌群落变化
焦 赫,李新举
(1.山东农业大学 资源与环境学院,山东 泰安 271018; 2.土肥资源高效利用国家工程实验室,山东 泰安 271018)
高潜水位煤矿区煤炭开采常造成严重的地面沉降,多年来一直采用回填复垦技术来减轻沉降影响[1-2]。煤矸石因为价格低廉且长期堆放会对地表结构和生态环境造成严重破坏,而被广泛用作矿区沉陷土地充填材料[3-4]。然而煤矸石作为固体废弃物,养分含量低,且含有较多重金属元素,其充填后的耕地质量较低,易造成严重的土壤、水和空气污染等问题[5]。因此,煤矸石充填复垦地土壤质量的研究是国内外相关专家关注的焦点[6-7]。目前,对采煤塌陷地煤矸石充填复垦地的土壤质量研究主要集中于植物保护、重金属污染、土壤酶活性等方面[8-10],在煤矸石充填复垦对土壤微生物生态影响的研究较缺乏。
土壤微生物参与了土壤生态系统中的物质循环、信息传递以及能量转换,在养分的转化循环、维持生态系统稳定性和植被演替恢复中起着决定性作用[11-14]。细菌作为土壤地下和地上系统交流的重要媒介,参与了土壤生态系统中大多数养分的循环转化,是推动植物凋落物和土壤有机质分解的重要驱动力[15]。其中,土壤细菌群落被认为是生物地球化学循环、气候调节或植物生产力等土壤功能的关键参与者[16],对土壤物理化学性质、植被类型和水文变化等环境因素变化敏感[17-18]。因此,土壤细菌群落组成和结构变化常被用来反映土壤环境质量的变化。
研究表明,土壤细菌群落组成和结构的变化是退化土壤环境恢复效果的重要反映,包括湿地生态恢复、退化森林治理、盐碱地修复[19-21]。此外,土壤细菌群落在衡量矿区复垦土壤质量和生态效益方面具有重要作用。王瑾[22]研究发现土壤细菌群落对不同复垦时间、不同破坏程度、不同复垦区域的采煤沉陷复垦土壤响应不尽相同。KNELLER等[23]通过研究采矿区不同复垦技术下土壤细菌等微生物对于土壤外源有机质添加后的反映,发现细菌群落在评估矿山土壤质量恢复效果的过程中起着关键指示作用。郭晓明等[24]研究矿区沉陷复垦地土壤细菌数量及酶活性空间分布特征发现,与非沉陷地相比,沉陷区对土壤细菌群落的生长存在一定抑制作用,采煤沉陷导致耕地土壤细菌数量空间异质性显著增加。李兆龙等[25]在铜尾矿应用土壤细菌解释了土壤微生物群落结构对重金属污染的响应,证明细菌等微生物对矿区退化土壤进行生态修复评估的重要价值。LI等[26]研究了黄土高原西北部露天煤矿复垦区土壤微生物丰度和多样性,说明细菌等微生物群落演替对于不同复垦方案的响应敏感程度存在显著差异。由此可见,土壤细菌及其群落在矿区采煤沉陷复垦领域的传统研究较为广泛。然而在高潜水位矿区,煤矸石充填复垦作为主要的复垦方式之一,目前利用现代高通量测序方法研究煤矸石充填后土壤细菌群落的变化是有限的。
笔者利用高通量lllumina Miseq 16S rRNA测序方法,探讨了中国东部典型高潜水位矿区采煤塌陷地煤矸石充填复垦耕地不同土层深度下土壤细菌群落多样性和结构组成的变化,并分析了特定优势细菌门与土壤理化性质的关系。主要目的是确定:① 煤矸石充填复垦后土壤性质变化;② 煤矸石充填复垦后土壤细菌群落多样性和结构组成的差异变化;③ 可能影响细菌群落结构和多样性的潜在关键土壤特性。
1 材料与方法
1.1 研究区概况
研究区位于山东济宁市东滩矿区,地理坐标为35.41°N~116.96°E,总面积约为1 616.56 km2(图1)。地形以平原为主,作物种类丰富,气候为四季分明的温带大陆季风性气候,雨量集中,水热同步。根据美国农业部土壤质地划分和美国农业部土壤系统分类的数据[27],研究区域的土壤类型主要为湿润淋溶土。土壤质地为砂壤土,砾石含量约7.3%。
图1 研究区位置Fig.1 Location of study area
东滩矿区因常年煤炭开采造成了大面积采煤塌陷地,自2001年开始进行塌陷地的充填复垦。该区充填复垦方式根据充填物的不同主要有煤矸石充填、粉煤灰充填和客土充填等方式。研究区主要采用的典型复垦工艺是煤矸石充填复垦。具体做法是在煤矿区的土地塌陷平稳后,前期先进行表土剥离,然后利用煤矸石进行充填,最后再回填表土层的土壤。复垦规划设计标高为47.0 m,未复垦土地平均标高约为39.8 m,平均充填矸石厚度约为6.2 m,矸石充填后覆土厚度在60~100 cm[28]。充填煤矸石来源于研究矿区煤矸石山和部分选煤厂矸石,煤矸石以碳酸盐类和碳质砂岩为主,其风化物以砾石为主,颗粒间差异较大。由于早年复垦过程中多次受到机械压实,土壤较为紧实。复垦后的利用方式主要为耕地、种植小麦、玉米等作物。
1.2 样品采集
2018年8月,按照室内设计路线,在试验区设置3个16 m×16 m的样地(3个重复),在每个样地内,采用直径5 cm的土壤螺旋钻,用对角线取样法和环刀法分3层(0~20,20~40,40~60 cm)于5个点均匀采样,并以周边正常耕地作为对照。每层土样采集5份并均匀混合,质量约2 kg,且每层取1 kg环刀样,用于土壤含水量和容重的测定,所有样品均装入无菌保鲜袋放置铺满冰袋的保温箱中,立即运回实验室。除去环刀样,将其他土样中明显的植物残渣、石子砖块去除后,按照四分法,将每层所取5份土样均匀混合,每个样品的一半经风干研磨并过2 mm的筛子,储存在室温下用于化学和物理性质分析;另一半立即放置-80 ℃下冷冻用于微生物分析。
1.3 土样理化性质
把土样置于铝制铁盒中,在105 ℃下烘干48 h,进行土样含水量(MoiC)测量。容重(BD)采用环刀法测定。采用高温外加热重铬酸钾氧化-容重法测定土壤有机碳(SOC)含量。用pH计(PHSJ-3F)和TDR(TRIME-IPH)测定土壤中的pH和电导率(EC)。分别用凯氏法测定碱解氮(AN)、奥尔森法测定速效磷(AP)、用盐酸铵萃取后用原子吸收光谱法测定速效钾(AK)。对上述指标均进行了3次重复测试,并根据相关性做进一步分析。
1.4 土壤细菌16S rRNA基因序列分析
1.4.1DNA抽提和PCR扩增
根据制造商说明,使用E.Z.N.A.®soil试剂盒(Omega Bio-tek,Norcross,GA,U.S.)说明书从每种土壤样品中称取0.5 g进行总DNA抽提。DNA浓度和纯度利用NanoDrop 2000进行检测,利用1%的琼脂糖凝胶电泳检测DNA提取质量;用引物515F(5′-GTGYCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACNVGGGTWTCTAAT-3′)对16S rRNA基因V5-V6可变区进行PCR扩增。扩增程序为:94 ℃预变性10 min,35个循环(94 ℃,变性40 s,55 ℃ 退火30 s,72 ℃延伸90 s),最后72 ℃延伸10 min (PCR采用TransGen AP221-02:TransStart Fastpfu DNA Polymerase;PCR仪:ABI GeneAmp®9700型)。扩增体系为24 μL,18.35 μL 水,2.5 μL 10×buffer,2 μL 2.5 mmol/L dNTPs,各0.5 μL引物(515F和806R),0.15 μL Taq聚合酶,1 μL所提取DNA。
1.4.2高通量测序
用2%琼脂糖凝胶电泳对3个重复PCR产物进行检测并汇集,然后利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行纯化,并利用QuantiFluorTM-ST(Promega,USA)进行检测定量。最后,根据Illumina MiSeq平台(Illumina,San Diego,USA)标准操作规程将纯化后的扩增片段构建PE 2×300的文库。通过高通量测序对所有纯化和混合样本测序读数进行分析。最终,实验数据利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。
1.5 数据处理和分析
采用SPSS 22.0软件对土壤性质数据进行单因素方差分析(ANOVA),在P<0.05时观察到显著性。使用R vegan软件包计算了α多样性指数,包括丰富度(Ace和Chao指数)、微生物群落多样性(Shannon指数)。用β多样性分析评价物种复杂度的差异,利用R vegan软件包做基于Bray-Curtis差异矩阵的主坐标分析(PCoA)以比较和可视化土壤样本之间的相似性。为探讨细菌群落与土壤性质之间的关系,利用CANOCO 5.0对门水平下前10个优势菌门与土壤理化性质进行典型相关分析(CCA),以Pearson相关分析法辅助分析。
2 结果与分析
2.1 土壤理化性质
所考虑的土壤理化性质(AN,AP,AK,SOC,pH,EC,BD,MoiC)在不同处理间差异显著(表1)。G的pH值分布在8.23~8.68,3层pH均显著高于CK(P<0.05),且在深度变化上呈现逐渐降低的变化趋势。G的EC在不同土层深度下均大于CK,随土层深度增加而增大。G和CK的EC在DL(Deep Layer)均高于SL(Surface Layer)和ML(Middle Layer)层。G的AN和AK变化趋势一致,ML和DL土层质量分数(均值为72.85 mg/kg和75.82 mg/kg)远低于表层(120.67 mg/kg 和108.83 mg/kg),G的AP质量分数随土层深度增加呈现下降趋势。与CK相比,G的AN质量分数(120.67 mg/kg)在SL层略高于CK(120.57 mg/kg)。AK,AP在不同土层深度下质量分数均明显低于CK。G的SOC质量分数随土层深度增加呈现逐渐下降趋势,在SL层与CK质量分数接近,但其他层远低于CK。G的BD在各层均高于CK,且ML质量分数高于其他土层。整体上G的含水量低于CK。
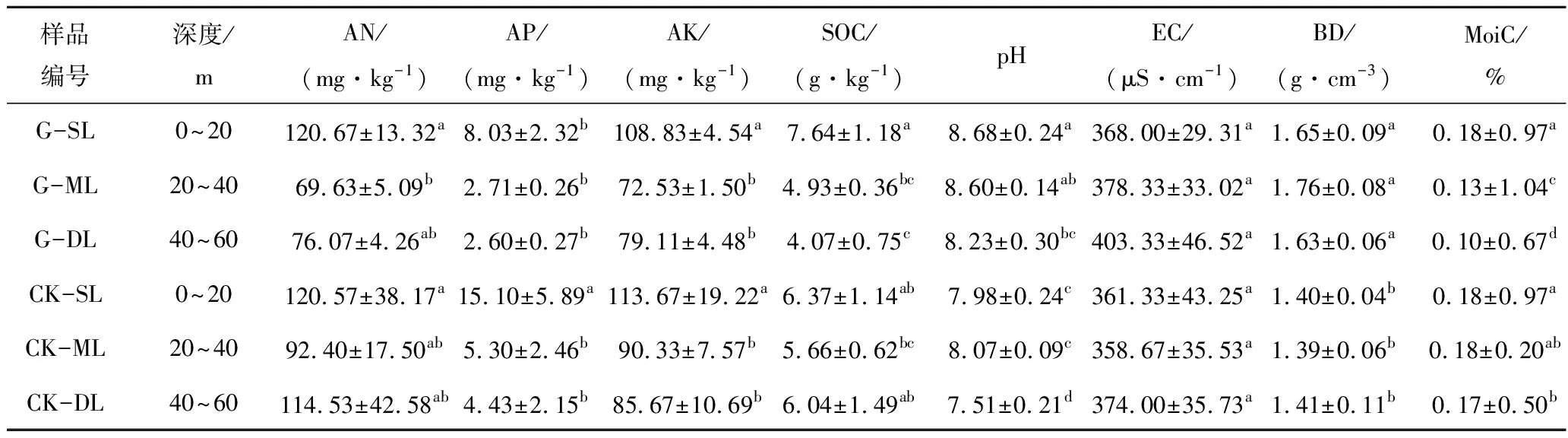
表1 复垦地和对照地的土壤性质
2.2 土壤细菌群落组成特征
从18个样品整合的数据集中保留了1 607 790个高质量的序列(细菌群落平均每个样本89 322个),共检测到11 430个OTUs,有效序列长度均>200 bp。G和CK的ACE,Chao和Shannon指数在丰富度和多样性方面存在显著差异(表2)。所有样本的覆盖率都在96%以上,说明测序读数足以进行分析。通过对Chao,ACE和Shannon指数在不同土层深度下的计算,结果表明,在SL层,G的丰富度和多样性略高于CK,但在DL层,G的土壤细菌ACE指数、Chao指数和Shannon指数的最低值分别为1 062,1 090 和4.38,远低于CK。 ANOVA分析表明,与CK相比,Ace,Chao,Shannon指数在不同土层深度差异显著(P<0.05),在DL层,G的Ace,Chao,Shannon指数分别较SL层降低74.44%~80.92%,73.81%~79.90% 和29.93%~41.00%。因此,说明整体上煤矸石充填后的耕地的细菌群落多样性和丰富度低于CK,且与土层深度呈显著负相关。PCoA发现,G和CK在不同土层深度下土壤细菌群落组成存在显著差异(图2)。
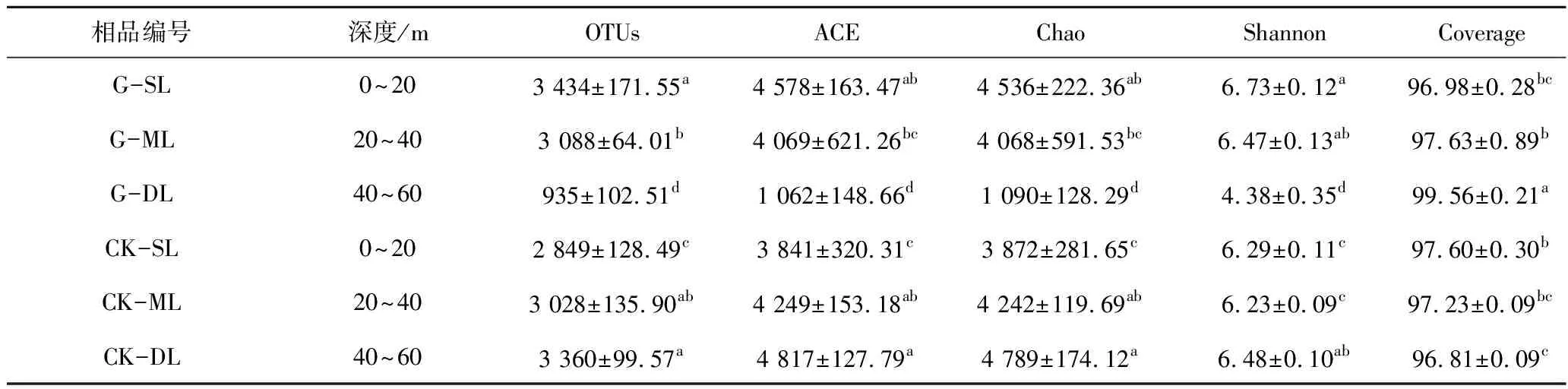
表2 不同处理下观测到的操作分类单元、覆盖率、丰富度和多样性的估计值
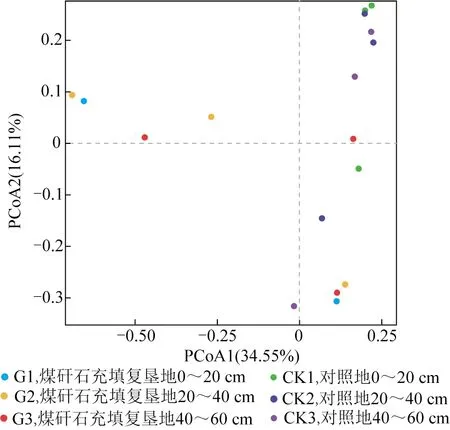
图2 主坐标分析Fig.2 Principal coordinates analysis
在门的水平上,样品的总体细菌群落组成相似,但观察到一些样品的不同比例,如图3所示,图3中,不同小写字母为处理间差异显著(P<0.05)。在所有样品中,变形菌门是最丰富的种类,平均相对丰度为32.43%。放线菌门是第2丰富的门,平均相对丰度为17.60%。酸杆菌门的平均相对丰度为14.46%。其他优势菌门平均相对丰度值按降序排列依次为:绿弯菌门(5.90%)、拟杆菌门(4.75%)、芽单胞菌门(4.53%)、厚壁菌门(3.39%)、浮霉菌门(2.77%)、罗卡氏菌门(2.68%)、疣微菌门(1.49%)、球状细菌(1.30%)。与CK相比,G的变形菌门和酸杆菌门平均相对丰度值随土层深度增加呈下降趋势,变形菌门相对丰度下降了14.13%~24.25%,酸杆菌门相对丰度下降了91.16%~97.41%,而放线菌门呈明显上升趋势,相对丰度上升了113.85%~167.17%。优势菌门相对丰度在CK各土层中变化没有明显规律。另外,与自身相比,G的优势菌门在DL层相对丰度远低于其他土层。
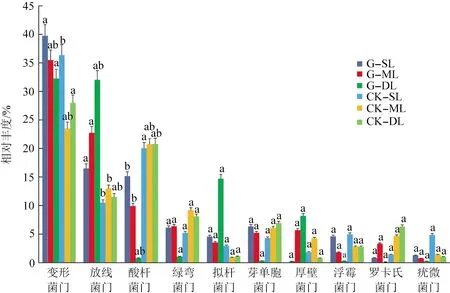
图3 细菌门的相对丰度Fig.3 Relative abundance of bacterial phyla
2.3 土壤理化性质与土壤细菌群落的相关性
采用CCA方法分别研究了G和CK土壤细菌群落(前10个优势门的相对丰度)与土壤理化性质(AN,AP,AK,SOC,pH,EC,BD,MoiC)之间的关系(图4)。研究发现,该区土壤细菌群落的总体结构与pH,MoiC,SOC,AP,AK显著相关。另外,笔者还计算了G和CK前10个优势菌门与土壤理化性质之间的皮尔逊系数(Pearson)见表3,4。研究发现,相对丰度较高的优势菌群(变形菌门、放线菌门和酸杆菌门)仅与土壤某些理化性质显著相关。在G中,MoiC与变形菌门、酸杆菌门、绿弯菌门等优势菌门相对丰度均呈显著正相关(P<0.05)。pH与拟杆菌门的相对丰度呈极显著负相关(P<0.01),与芽单胞菌门呈显著正相关(P<0.05)。在CK中,相对丰度较高的前3类优势菌仅有变形菌门相对丰度与AP呈显著正相关(P<0.05)。此外,放线菌门、酸杆菌门、绿弯菌门、厚壁菌门与大多数土壤理化性质无显著相关。
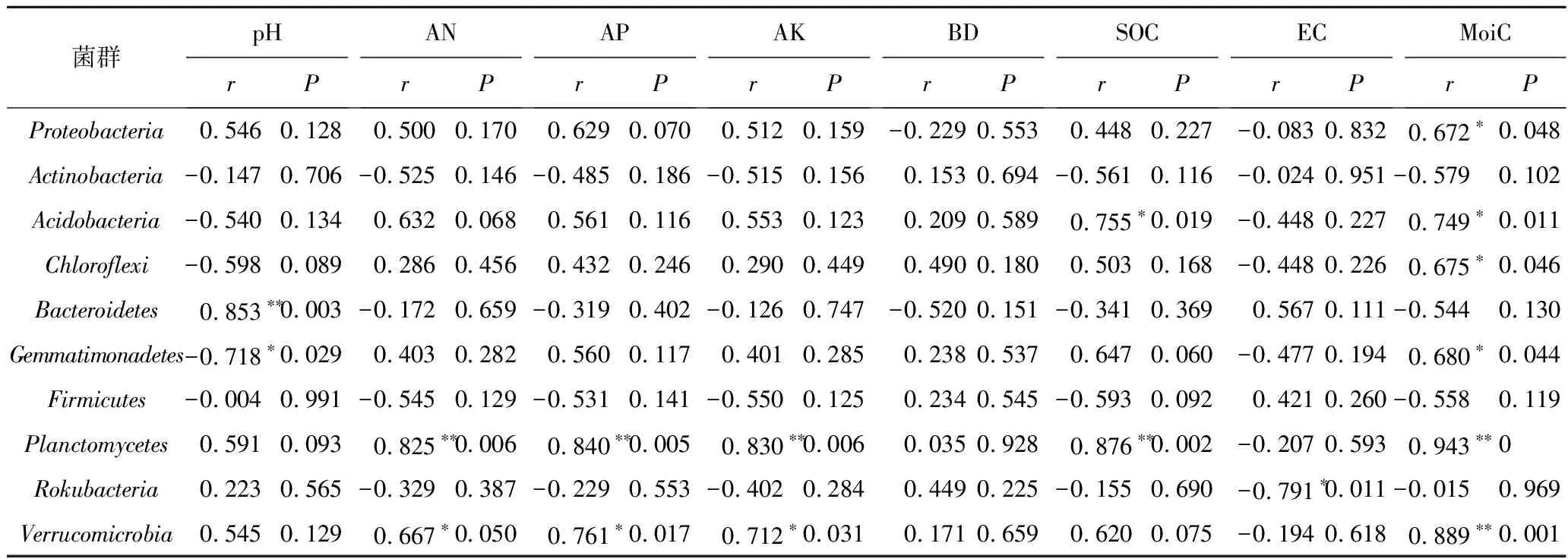
表3 煤矸石充填复垦地土壤细菌群落与土壤理化性质的相关系数
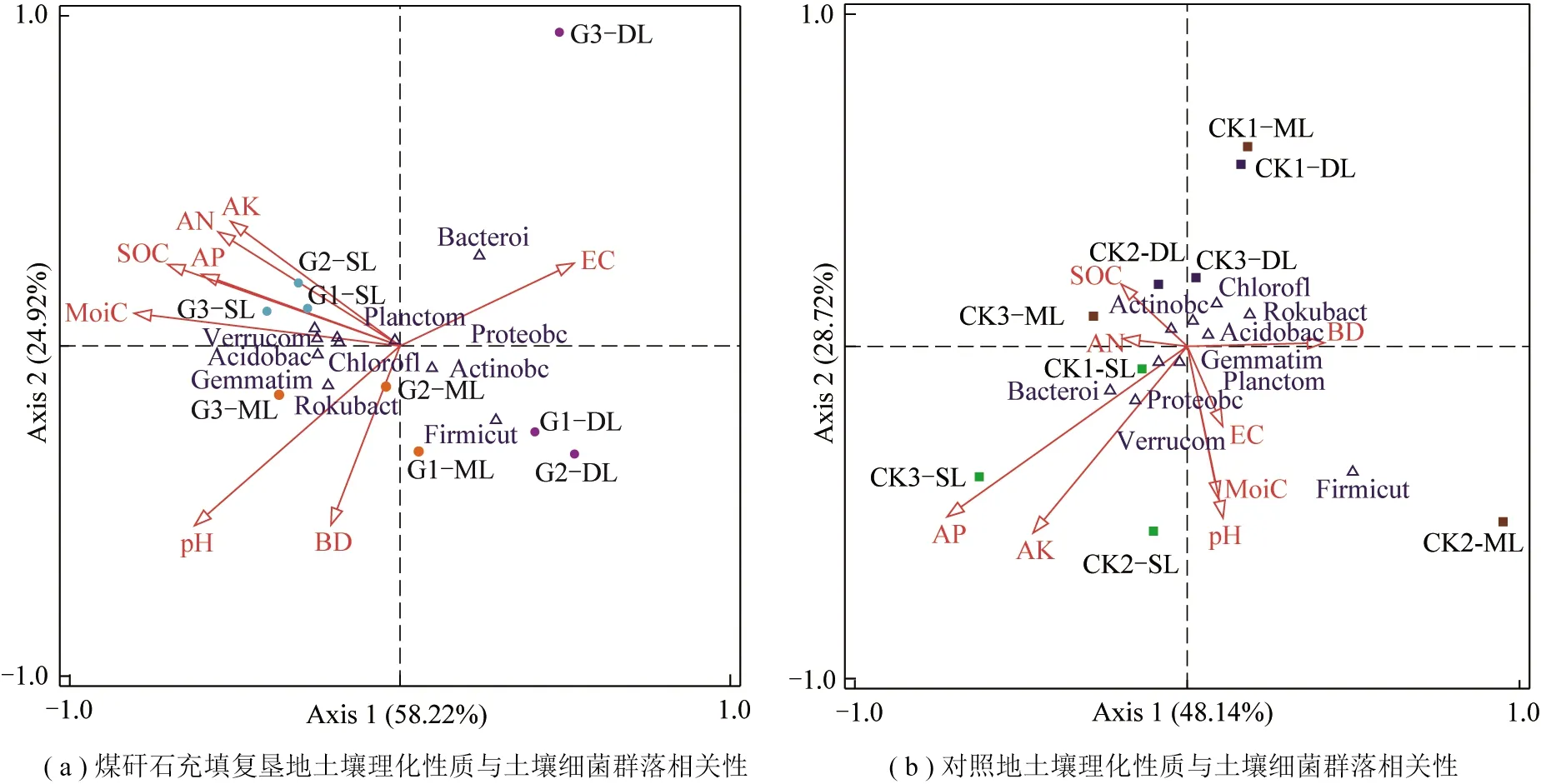
图4 典型相关分析Fig.4 Canonical correspondence analysis
3 讨 论
3.1 土壤理化性质变化
G与CK存在显著差异,不同土层深度下土壤理化性质变化趋势差异很大。G的AN,AP,AK,SOC在SL层含量高于其他土层,这可能与人工施肥、表土回填有关[29-30]。但从ML层开始,特别是AP,SOC含量随土层深度增加呈现明显下降趋势。这是由于煤矸石养分含量低,充填效果差,导致土壤养分下渗速率变低[31-32]。与CK相比,G的EC在不同土层深度下均大于对照地,且随土层深度增加而增大,这也与煤矸石充填有关,由于高地下潜水位从底部煤矸石充填区带来可溶性物质,并逐年随水分蒸发向上层迁移,导致与煤矸石接触层的EC明显高于表层,与前人研究结果[28]类似。研究区复垦地由于早年受机械压实影响严重,较多次数的碾压破坏了土壤结构[33],使得土壤紧实,容重增大,深层次土壤群落恢复速率慢,从而影响土壤养分的充分转化,同时也导致复垦地的MoiC低于普通耕地[34-35]。这些发现表明,充填复垦质量影响土壤养分质量的提高,通过提高煤矸石充填技术和加强土地耕作深翻,将会在稳定土壤生态系统和控制土地退化等方面发挥重要作用。
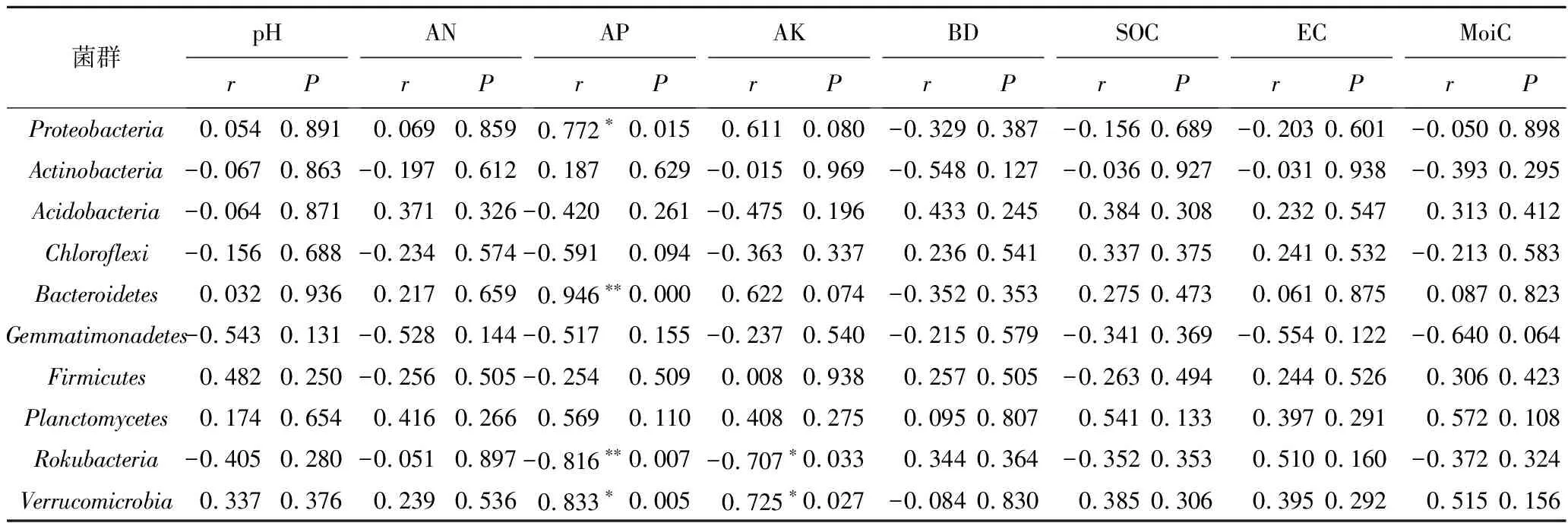
表4 对照地土壤细菌群落与土壤理化性质的相关系数
3.2 土壤细菌群落组成变化
根据表1的结果,煤矸石充填复垦对OTUs、细菌群落丰富度(ACE和Chao1)和多样性(Shannon)指数有显著影响(P<0.05)。在本研究中,煤矸石充填复垦后的总OTUs和细菌多样性指数(包括ACE,Chao和Shannon)在SL层均增加,但在DL层出现显著降低。SL层中由于较高的灌水量和施肥量,促进了土壤细菌的生长。此外作物种植也会为土壤细菌提供更多生长营养成分,与前人研究[29-30,36]一致。但由于煤矸石充填质量差,营养成分缺失,在DL层复垦地的土壤多样性和丰富度骤减。另外,整体上G的土壤细菌群落多样性是低于CK的,究其原因可能是:一方面,由于煤矸石充填造成土壤肥力下降,影响了有机质和矿物质的分解,抑制了细菌生长和繁殖[31-32];另一方面,由于研究区属于高潜水位采煤塌陷地,复垦时间也较长,研究区存在一定盐渍化威胁,且土壤普遍呈碱性,在一定程度上抑制了细菌活性,导致复垦地土壤细菌群落多样性较低[37]。
变形菌门、放线菌门和酸杆菌门是研究区内最具优势的门,这与前人研究一致[38-39],说明这些门并不是某一区域特有,不同区域相对丰度不同。在G中观察到放线菌随土层深度增加呈现上升趋势。LI等[40]在研究矿区重金属污染环境时得出放线菌适合在低营养环境中生长。而酸杆菌的相对丰度随土层深度下降而降低,在G的DL层观察到的相对丰度平均值仅有0.7%。这与煤矸石充填质量差,且研究区土壤偏碱性,土壤结构被破坏,进而影响了酸杆菌的生长环境有关[41]。另外,由于煤矸石填充所造成的土层扰动,也令酸杆菌在各个土层的分布远不及普通耕地平稳[30]。在G和CK的各层均观察到较高的变形菌门相对丰度。据研究,变形菌在草地[37]、森林[38]和牧场土壤[42]的细菌群落中占主导地位,近年来,变形菌在矿区中也被判断为优势菌[38-39]。此外,由于煤矸石充填影响土壤结构稳定和营养输送,复垦土壤中细菌间的竞争压力增大,所以G的优势菌门在DL层相对丰度远低于其他土层。
3.3 土壤理化性质与土壤细菌群落关系变化
CCA(图4)和Pearson相关系数(表3,4)显示了土壤细菌群落与土壤理化性质之间的关系。在本研究中,pH是影响复垦地与对照地土壤细菌群落的主要因素。因为高潜水位特有的水土条件导致土壤存在盐渍化风险,尤其是研究区的复垦地中充填的煤矸石中又含有大量的碳酸盐矿物,碳酸盐矿物溶解后溶液导致土壤呈弱碱性,pH过高,将破坏土壤结构,导致土壤通气状况变差,间接影响土壤养分转化及其有效性[43]。通过图4可以看出,在煤矸石充填复垦地中,MoiC和SOC是影响细菌群落结构的主要理化性质。已有研究证明煤矸石结构性差,大孔隙多,毛细孔隙少,土壤保水能力差[44]。而煤矸石充填复垦土壤会影响含水量的下渗速率,抑制细菌等微生物活跃度,进而影响细菌群落相对丰度稳定性[32]。研究发现,煤矸石充填复垦地的SOC是细菌群落能量和营养物的稳定来源,细菌分解代谢速率与SOC含量相关。尹宁宁等[45]在研究矿区SOC与土壤微生物功能多样性之间关系时也有同样的结论。另外,AP和AK是影响对照地土壤细菌群落结构的主要理化性质。长期施肥效应对细菌群落的影响不容忽视,AP的施用能增加土壤细菌多样性以及各细菌物种在群落中分布的均匀性[46]。而钾肥的生物可用性一直被认为是调节农田生态系统产量的关键因素,PENG等[47]的研究中发现AK是影响油菜籽根际微生物群落的重要因子。也有研究认为AK含量与农田黑土细菌各细菌群落生物量呈高度正相关[48]。
根据Pearson相关分析结果,发现变形菌门与AP存在显著相关性(P<0.05),说明变形菌门具有嗜营养的特点[10]。芽单胞菌门具有抗极端环境条件和清除土壤中重金属的能力,能适应碱性土壤环境,与复垦地pH呈正相关[30]。而拟杆菌门因为不能适应碱性环境与pH呈负相关[49]。另外,MoiC与复垦地中变形菌门、酸杆菌门、绿弯菌门等优势菌门的相对丰度均呈显著正相关,这与煤矸石填充土壤保水能力差,影响细菌群落生长繁殖有关[44]。此外,优势菌门仅与部分理化性质显著相关(P<0.05),放线菌门、酸杆菌门、绿弯菌门、厚壁菌门对大多数土壤理化性质的变化无明显响应。
4 结 论
(1)由于受煤矸石自身特性及高潜水位特有的水土条件影响,煤矸石充填复垦地的土壤细菌群落多样性与丰富度低于普通耕地,且随土层深度增加呈显著下降趋势,40~60 cm土层细菌群落多样性与丰富度明显低于其他土层。
(2)煤矸石充填复垦地土壤细菌群落组成与普通耕地有很高的相似性,在不同土层深度下,土壤细菌群落结构的变化主要体现在优势菌群落比例的变化。在所有的处理中,优势菌门是变形菌门、放线菌门和酸杆菌门。与对照地相比,复垦地表层的优势菌相对丰度较高,但经过煤矸石充填复垦工程扰动后,土壤生态环境受到严重影响,尤其在40~60 cm层,细菌等微生物难以在煤矸石层正常生长,细菌群落组成差异变大。
(3)煤矸石充填复垦显著改变了研究区土壤理化性质,不同土层深度下土壤理化性质变化趋势差异明显。相关性分析表明,pH,MoiC,SOC,AP和AK是影响土壤细菌群落组成的主要土壤理化性质。但部分优势菌门对理化性质的响应并不明显,可能与土壤微生物群落的高度复杂性及该区域条件的特殊性等多方面因素相关。

