不同耐盐性花生品种对NaCl胁迫的光合和抗逆生理响应特征
温赛群,丁 红,徐 扬,张冠初,张智猛,戴良香*
(1 山东省花生研究所,山东青岛 266100;2 河北省农林科学院经济作物研究所,石家庄 050051)
土地盐碱化是世界范围内面临的重要环境问题,近50%的灌溉土地存在不同程度的次生盐碱化[1]。中国是世界上土地盐碱化面积最大的国家之一,可利用的盐碱地面积达6.7×106hm2,其中中轻度盐碱地面积占30.1%,中重度盐渍化威胁的低产田占总耕地的22%,且有 9.2×107hm2的耕地正面临着盐渍化的影响。中国人口众多,人均耕地面积不足0.1 hm2,如何改良利用盐渍地区的土地资源是提高粮食和食用植物油自给率重大而艰巨的课题,筛选及培育耐盐能力强的作物品种、研究植物耐盐性及其生理机制成为热点问题之一。
花生是中国重要的油料作物和经济作物,含油率高达50%以上,在保障中国食用油安全领域具有明显的产业优势。同时,花生抗逆性较强,除具有抗旱、耐瘠薄和培肥地力特性外,还具有较强的耐盐碱能力,可耐受0.30%~0.45%的盐浓度[2],在盐碱土区种植业结构调整中是最适宜的替代作物。花生种植效益明显,发展盐渍土区花生产业,对提高其农业种植结构抗风险能力、提高食用植物油供给和改良利用盐碱地资源具有重要作用。以往研究表明,花生耐盐性鉴选的适宜浓度因生育时期、栽培手段不同而异,芽期耐盐性室内鉴定以0.58%~1.0% NaCl为选择标准[3-5],室内土培法鉴选耐盐花生品种的适宜浓度为0.30%~0.45%[6]。盐胁迫下花生叶片叶绿素含量、净光合速率和叶面积指数降低[7-8],SOD、POD、CAT 活性下降,MDA 含量增加,抗氧化酶保护系统和细胞膜遭到破坏[9],对氮、磷、钾、镁等营养元素的吸收与转运受阻[10-11]。而植物的耐盐性是一个复杂的数量性状,涉及多种耐盐机制的协调作用,但目前对于不同花生耐盐品种耐盐机理的研究还相对较少。因此,本试验选用已鉴选出的不同耐盐性花生品种,采用NaCl温室内盆栽试验模拟田间盐胁迫,研究其在不同盐胁迫强度下的光合特性、抗氧化能力和相对含水量等生理响应特征,旨在明确不同耐盐性花生品种耐盐生理机制,为盐碱地花生高产高效生产提供理论与技术支撑。
1 材料和方法
1.1 供试材料
选择耐盐型花生品种‘花育25’(HY25)和‘鲁花12’(LH12),以及盐敏感型花生品种‘海花1号’(HH1)和‘花育20’(HY20)为试验材料,分别随机选取各品种种子50粒称重(重复4次),获得其百仁重分别为87.35 g(‘花育25’)、83.52 g(‘海花1号’)、76.45 g(‘鲁花12’)和74.75 g(‘花育20’)。
1.2 试验方法
试验于2018年3-10月在山东省花生研究所日光温室中进行,光照周期为12 h/12 h,有效光量子密度为110 μmol·m-2·s-1,昼/夜温度为23~25 ℃/18~20 ℃,光暗相对湿度为(65% ± 5%)。供试土壤采自山东省花生研究所莱西试验站0~20 cm表层土,其基本理化性质为土壤有机质含量13.42 g·kg-1,全磷(P2O5) 0.79 g·kg-1,全钾(K2O) 11.36 g·kg-1,全氮1.34 g·kg-1,水解氮(N)109.37 mg·kg-1,速效磷(P2O5) 14.01 mg·kg-1,速效钾(K2O) 113.22 mg·kg-1,土壤pH7.25。风干、过筛(3 mm)后备用。依据《土壤农业化学分析》盐碱土分级标准[12]和耐盐品种鉴选评价标准[2],将土壤含盐量(W/W=NaCl质量/烘干土壤质量)设定在中度含盐量(2.0~4.0 mg·kg-1)以下。
选用高10.5 cm、内径12.5 cm的塑料盆,每盆装土0.75 kg,以分析纯NaCl施入处理组盆栽土壤中,使土壤含盐量分别达到0(CK)、1.0、2.0、3.0、4.0 g/kg。依据田间持水量采用重量法控制培养生长期间每盆的浇水量,控制初始土壤含水量达到田间持水量的90%,于人工气候室内自然蒸发至土壤含水量为田间持水量60%~70%时进行播种。每盆播种4粒,6次重复。并保持每粒种子的播种深度均为3 cm,间距控制在1 cm。出苗后重量法控制补水量保持土壤含水量在田间持水量50%~60%。由于3.0 g/kg处理出苗延迟7~17 d,4.0 g/kg处理出苗困难,未能对植株相关性状进行调查测定。
1.3 测定指标及方法
不同盐胁迫浓度下,均选择在花生幼苗长至5展叶时,利用Li-6400XT便携式光合仪,于上午10:00~12:00选取每株倒2~3展开叶,测定净光合速率(Pn,μmol·m-2·s-1)、蒸腾速率(Tr,g·m-2·h-1)和气孔导度(Gs,mmol·m-2·s-1)。同时,测定植株光合-光响应曲线。每处理随机选取5株,共3个重复。设定诱导光强约为2 000 μmol·m-2·s-1,诱导时间约15~30 min。光响应曲线测定时,设置叶室温度为25 ℃,采用开放式气路,设置CO2浓度条件为400 μmol·mol-1,相对湿度为60%~75%,设置光强由高到低为2 000、1 800、1 600、1 400、1 200、800、600、400、200和0 μmol·m-2·s-1。
采用SPAD 502叶绿素仪(柯尼卡美能达公司,日本)测定叶绿素含量相对值(SPAD)。被测部位选择叶片中上部,且避开叶脉,各处理5次重复。之后,选取植株长势较均匀的3盆,采取其所有展开叶片置于-80 ℃超低温冰箱中保存,以备相关生理生化指标测定。其中,叶片相对含水量采用烘干称重法测定;脯氨酸含量采用茚三酮法测定,可溶性糖含量采用蒽酮法测定,并用氮蓝四唑(NBT)法测定SOD活性,愈创木酚法测定过氧化物酶(POD)活性,紫外吸收法测定CAT活性,硫代巴比妥酸(TBA) 法测定MDA含量[13]。
1.4 数据处理
采用SPSS 17.0对数据进行统计分析,用Excel 2017制图。
2 结果与分析
2.1 NaCl胁迫对不同类型花生品种叶片相对含水量的影响
各花生品种叶片相对含水量(RWC)均表现出随盐胁迫浓度升高而显著降低的趋势,但品种间降幅存在差异(图1)。其中,在1.0 g/kg NaCl胁迫处理下,HY20品种RWC稍高于对照,其余品种RWC均显著低于对照。在2.0和3.0 g/kg NaCl胁迫浓度下,HY25、LH12和HY20品种RWC均显著低于1.0 g/kg胁迫浓度处理,但HY25、LH12在两胁迫浓度间无显著差异,而HY20品种表现为3.0 g/kg显著低于2.0 g/kg浓度;HH1品种RWC在2.0和3.0 g/kg NaCl胁迫浓度下与1.0 g/kg盐胁迫浓度间均无显著差异。在3.0 g/kg NaCl胁迫浓度下,HY25、LH12、HH1和HY20叶片RWC分别比对照显著降低10.3%、10.5%、13.9%和14.3%。可见,在NaCl胁迫条件下,耐盐花生品种叶

相同品种不同小写字母表示处理间在0.05水平存在显著性差异;下同图1 NaCl胁迫下不同花生品种叶片相对含水量的变化The different normal letters indicate significant difference among treatments at 0.05 level. The same as belowFig.1 The relative water content (RWC) in leaves of different peanut varieties under NaCl stress
片自由水含量明显高于盐敏感品种,其保持了对水分的吸收能力,缓解了渗透胁迫对植株生长的影响,较强的保水能力是品种抗盐耐逆的主要原因之一。
2.2 NaCl胁迫对不同类型花生品种叶片SPAD值的影响
各类型花生品种叶片SPAD值均随着NaCl胁迫浓度的增加表现出逐渐降低的趋势,但降低幅度在各品种间存在明显差异(图2)。其中,耐盐品种HY25和LH12叶片SPAD值在低于2.0 g/kg NaCl胁迫下与对照相比均无显著变化,仅在3.0 g/kg NaCl胁迫浓度下显著降低;而盐敏感品种HY20叶片SPAD值在1.0 g/kg NaCl胁迫下也无显著变化,但在2.0~3.0 g/kg NaCl胁迫下均显著降低;盐敏感品种HH1叶片SPAD值在1.0~3.0 g/kg NaCl胁迫下均比对照显著降低,且各盐胁迫处理间也均差异显著。在3.0 g/kg NaCl胁迫下,花生品种HY25、LH12、HH1和HY20叶片SPAD值分别较其CK显著降低13.4%、17.0%、22.3%和18.8%。可见,低于2.0 g/kg NaCl胁迫下,耐盐花生品种叶绿素含量不受盐胁迫的显著影响,在较高浓度NaCl胁迫处理下,耐盐品种叶片叶绿素含量降幅较盐敏感品种低,受盐胁迫抑制程度较小。
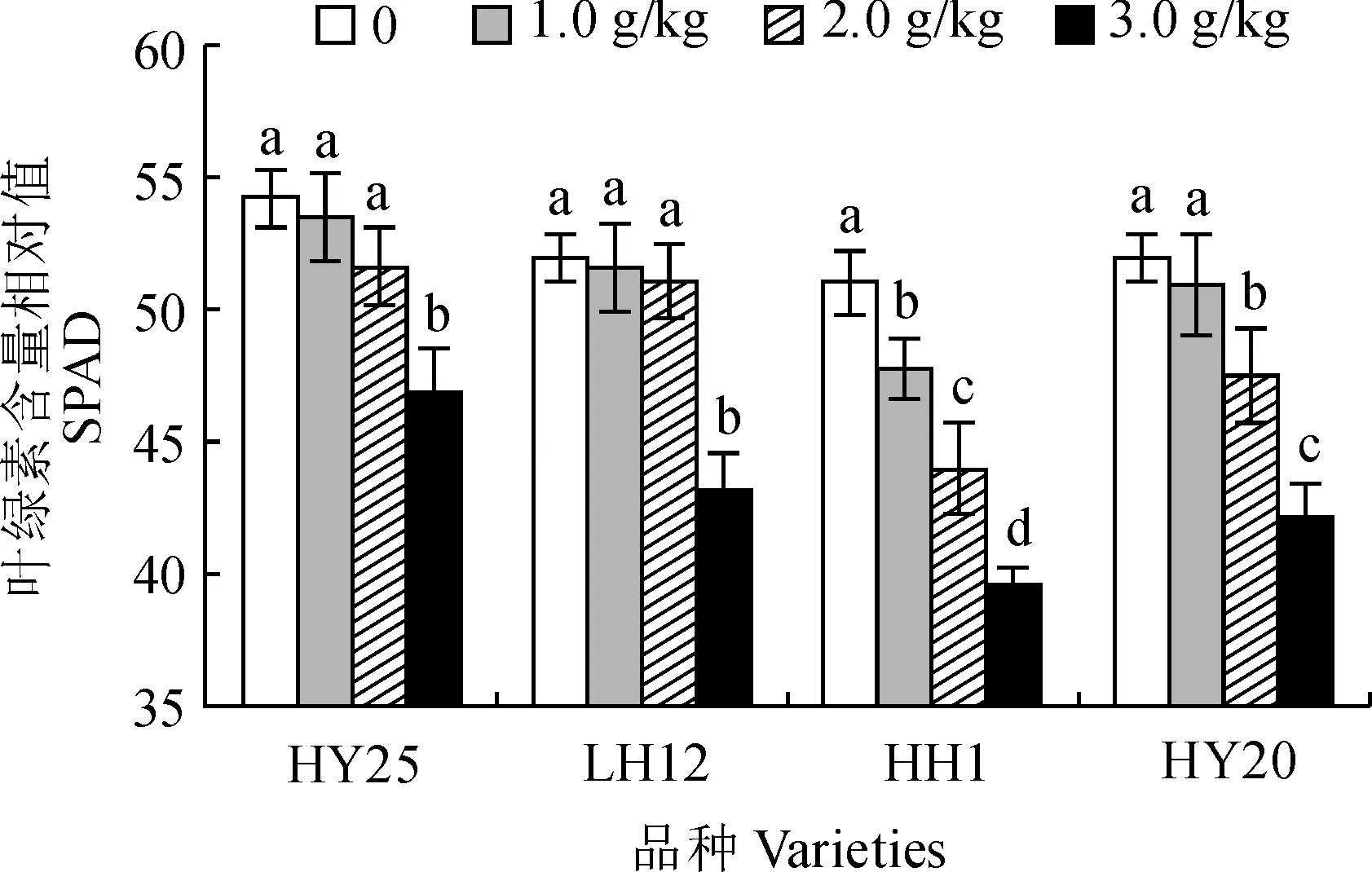
图2 NaCl胁迫下各花生品种叶片SPAD值的变化Fig.2 The SPAD in leaves of different peanut varieties under NaCl stress
2.3 NaCl胁迫对不同类型花生品种叶片光合生理特征的影响
2.3.1 光合-光响应曲线特征图3显示,在NaCl胁迫条件下,各品种光合-光响应特征曲线的变化趋势相同,净光合速率均随光照强度的增强逐渐升高,当光强达到一定数值时趋于平稳,且均随NaCl胁迫浓度的升高呈明显降低的变化趋势;在不同浓度NaCl胁迫下,各品种光补偿点和光饱点差异较大。其中,在0~2.0 g/kg NaCl胁迫条件下,耐盐品种HY25和LH12的光补偿点近于零,而盐敏感品种HY20和HH1则在100~200 μmol·m-2·s-1之间;在3.0 g/kg 胁迫条件下,各品种光补偿点均在200~300 μmol·m-2·s-1之间,尤以耐盐品种HY25较高为400 μmol·m-2·s-1。
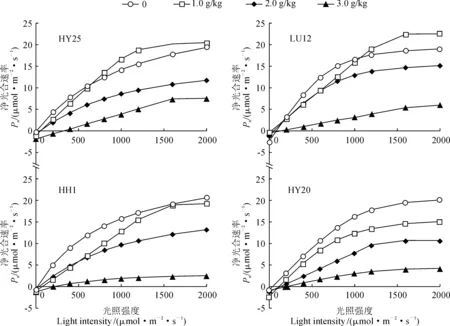
图3 NaCl胁迫下不同花生品种叶片光响应曲线Fig.3 Photosynthetic light response curves of different peanut varieties under NaCl stress
同时,两类型花生品种的光饱和点和净光合速率因NaCl胁迫浓度而出现分异,耐盐品种(HY25和LH12)和盐敏感品种(HY20和HH1)的光饱和点分别出现在1 600 μmol·m-2·s-1左右和1 200~1 300 μmol·m-2·s-1,且较高浓度NaCl(3.0 g/kg)胁迫下,两类品种的最大净光合速率分别为对照的25.0%和12.5%左右;在2.0 g/kg盐胁迫下,当光照强度高于1 000 μmol·m-2·s-1时,耐盐品种HY25和LH12的净光合速率均高于相应CK,但盐敏感品种HY20和HH1则依NaCl胁迫浓度的增加而依次降低。可见,各品种花生叶片的光合作用在NaCl胁迫下均受到明显抑制,较高浓度的NaCl胁迫使花生叶片的光补偿点升高,并使盐敏感品种的光饱和点降低。
2.3.2 叶片最大净光合速率和表观量子效率首先,各花生品种叶片最大净光合速率(Pnmax)受到盐胁迫的显著抑制,并均有随盐胁迫强度的增加而显著降低的趋势(图4,A)。其中,除HH1品种的Pnmax在1.0和2.0 g/kg NaCl胁迫浓度间无显著差异外,其余品种的Pnmax在各处理浓度间差异均达显著水平;在3.0 g/kg NaCl胁迫下,盐敏感品种HH1和HY20的Pnmax明显低于耐盐品种HY25和LH12,HH1和HY20分别较其对照显著降低83.3%、77.7%,HY25和LH12分别较其对照显著降低71.0%、69.6%,尤以盐敏感品种HH1降低幅度最大。
其次,NaCl胁迫也显著抑制各花生品种叶片的表观量子效率(YQ),并随胁迫浓度升高抑制效应有明显增强的趋势(图4,B)。其中,除HY20的YQ在1.0 g/kg NaCl胁迫下与其CK间差异不显著外,其余品种各NaCl胁迫浓度间差异均达显著水平,且各品种盐胁迫处理均显著低于相应CK;HY25、LH12、HH1和HY20各品种YQ在2.0 g/kg NaCl胁迫下分别较相应对照显著降低18.28%、32.67%、53.68%和55.67%,在3.0 g/kg NaCl胁迫下则分别大幅降低78.65%、88.00%、78.55%和78.81%。表明低NaCl胁迫下盐敏感品种吸收和转换光能的色素蛋白复合体较多,利用弱光的能力强于耐盐品种,但较高浓度NaCl胁迫下耐盐品种利用弱光的能力强于盐敏感品种。
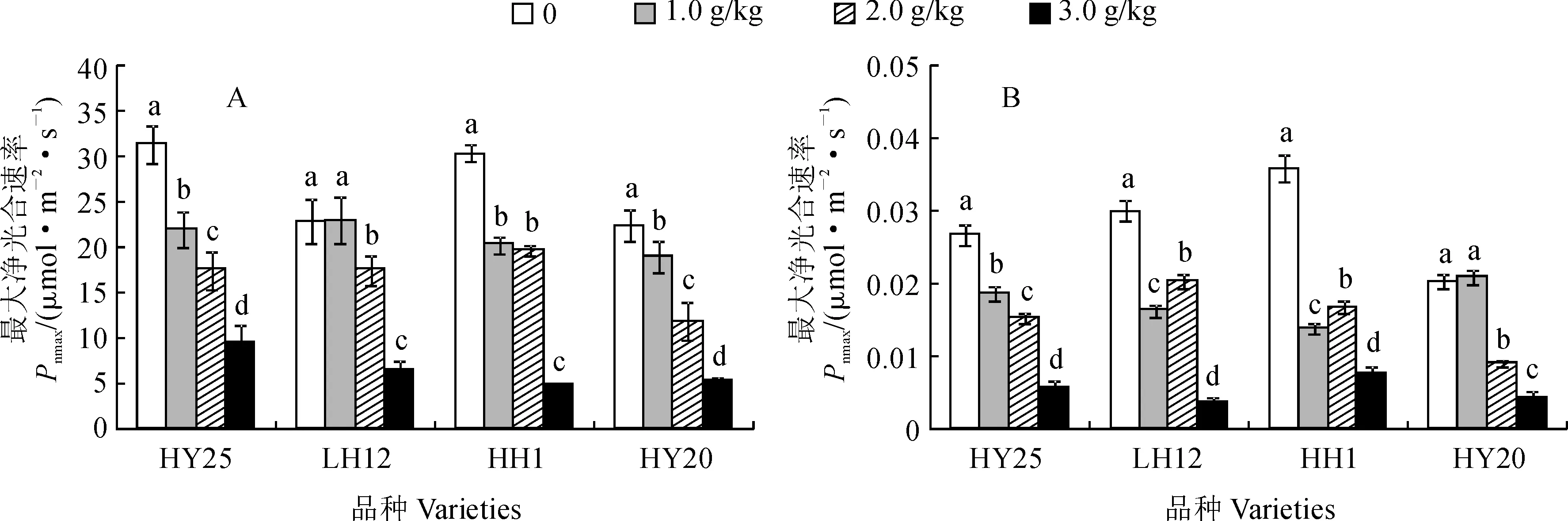
图4 NaCl胁迫下各品种叶片最大净光合速率和表观量子效率的变化Fig.4 Changes of maximum net photosynthetic rate (Pnmax) and apparent quantum efficiency (YQ) in leaves of different peanut varieties under NaCl stress
2.3.3 叶片气孔导度和蒸腾速率HY25、LH12、HH1和HY20各品种的气孔导度(Gs)和蒸腾速率(Tr)在NaCl胁迫下均比CK不同程度降低,且有随着盐胁迫浓度升高而逐渐降低的趋势;除耐盐品种HY25、LH12的1.0 g/kg NaCl处理与CK差异不显著外,各品种内Gs和Tr在NaCl胁迫浓度间及其与CK间的差异均达显著水平(图5)。其中,在2.0 g/kg NaCl胁迫下,除耐盐品种LH12外的品种的Gs均降至对照1/2以下;在3.0 g/kg盐胁迫浓度下,各品种的Gs已不足对照的15%,且耐盐品种的Gs与Tr的降幅均较盐敏感品种小。这表明耐盐品种的Gs在0~1 g/kg NaCl胁迫下没有受到显著影响,而此时盐敏感品种Gs显著降低则使其叶片光合速率明显下降;在0~2.0 g/kg NaCl胁迫下,耐盐花生品种LH12的光合速率降低是非气孔因素所致,2.0~3.0 g/kg NaCl胁迫下,气孔因素是花生光合效率降低的重要原因。
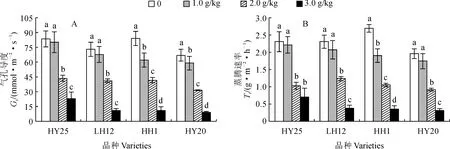
图5 NaCl胁迫下各花生品种气孔导度和蒸腾速率的变化Fig.5 Changes of stomatal conductance (Gs) and transpiration rate (Tr) in leaves of different peanut varieties under NaCl stress
2.4 NaCl胁迫对不同类型花生品种叶片主要抗氧化酶活性和丙二醛含量的影响
首先,各花生品种叶片SOD活性随NaCl胁迫程度增强均有逐渐降低的趋势,并均显著低于相应CK,而NaCl胁迫处理间差异显著性因品种不同而表现不同。其中,耐盐品种HY25和LH12的SOD活性除在1.0与2.0 g/kg处理间无显著差异外,其余盐胁迫浓度间均差异显著;盐敏感品种HH1和HY20的SOD活性除在2.0与3.0 g/kg处理间无显著差异外,其余盐胁迫浓度间均差异显著;HY25、LH12、HH1和HY20各品种在2.0 g/kg NaCl胁迫处理下分别较其对照显著降低35.19%、36.36%、74.14%和76.09%,在3.0 g/kg NaCl胁迫下分别显著降低70.37%、72.73%、75.86%和80.43%(图6,A)。这说明耐盐品种的抗氧化能力明显高于盐敏感品种,且当NaCl浓度低于2.0 g/kg时耐盐品种SOD活性不受影响。

图6 NaCl胁迫下各品种抗氧化酶活性和丙二醛含量的变化Fig.6 Changes of antioxidant enzyme activities and MDA content of different varieties under NaCl stress
其次,各花生品种叶片CAT活性大小受到NaCl胁迫强度和品种耐盐性的影响,表现有较大差异。其中,在1.0 g/kg NaCl胁迫下,各品种叶片CAT活性均不同程度地高于CK,但仅耐盐品种LH12的增幅达到显著水平;在2.0 g/kg NaCl胁迫下,耐盐品种HY25叶片CAT活性显著高于CK,耐盐品种LH12稍高于CK,盐敏感品种叶片CAT活性均比CK大幅度显著降低;在3.0 g/kg NaCl胁迫下,各品种叶片CAT活性均显著低于CK,显著各品种较其CK分别降低66.40%、55.37%、81.13%和72.04%(图6,B)。说明NaCl胁迫下耐盐品种CAT活性的升高是其耐盐抗逆的重要原因之一。
再次,耐盐品种HY25和LH12的POD活性均随NaCl胁迫强度的升高而逐渐显著升高,且均与CK存在显著差异,且3.0 g/kg胁迫处理均显著高于其他处理。盐敏感品种HH1和HY20的POD活性则有先升后降的趋势,均于2.0 g/kg胁迫浓度下达最大值,并显著高于CK和其他盐胁迫处理;但除HH1品种3.0 g/kg胁迫处理外,其余品种盐胁迫处理的POD活性仍均显著高于CK(图6,C)。
另外,各花生品种叶片MDA含量随盐胁迫程度的增强均呈逐渐升高的趋势,且除LH12品种1.0 g/kg NaCl胁迫处理外,其余品种各盐胁迫处理的增幅均达到显著水平(图6,D)。其中,在3.0 g/kg NaCl胁迫处理下,HY25、LH12、HH1和HY20各品种分别显著高于其对照49.55%、72.14%、167.86%和124.05%。
可见,在较低浓度盐(1.0 g/kg NaCl)胁迫条件下,各花生品种叶片SOD活性均降低,而CAT活性和MDA含量增加;当NaCl胁迫浓度超过2.0 g/kg时,耐盐品种HY25和LH12叶片的SOD和CAT活性的降幅以及MDA含量的增幅均低于盐敏感品种HH1和HY20;花生品种中抗氧化酶CAT和POD在抵御盐胁迫逆境过程中的作用强于SOD。
2.5 NaCl胁迫对不同类型花生品种叶片脯氨酸和可溶性糖含量的影响
在NaCl胁迫条件下,各花生品种叶片脯氨酸含量随NaCl胁迫浓度的增加而逐渐升高;与对照相比,耐盐品种HY25的脯氨酸含量增幅在1.0 g/kg NaCl胁迫下就达到显著水平,而其余品种均在2.0 g/kg NaCl胁迫下才开始显著升高;在3.0 g/kg NaCl胁迫浓度下,HY25、LH12、HH1和HY20各品种叶片脯氨酸含量较其CK分别显著升高136.87%、102.36%、76.29%和54.25%(图7,A)。说明盐胁迫下耐盐花生品种叶片脯氨酸含量升幅明显高于盐敏感品种。

图7 NaCl胁迫下各品种脯氨酸和可溶性糖含量的变化Fig.7 Changes of proline and soluble sugar contents of different varieties under NaCl stress
同时,各品种叶片可溶性糖含量随NaCl胁迫强度的增加表现出不同的变化趋势,耐盐品种HY25和LH12表现显著升高趋势,并在3.0 g/kg盐胁迫浓度下显著高于其他处理;而盐敏感品种HH1和HY20在2.0 g/kg NaCl胁迫浓度下叶片可溶性糖含量达最大值,且与1.0 g/kg NaCl胁迫浓度间均无显著差异。其中,HY25、LH12、HH1和HY20各品种叶片可溶性糖含量在3.0 g/kg NaCl浓度下较相应CK分别高出146.64%、146.57%、28.06%和115.09%(图7,B)。可见,在NaCl胁迫条件下,花生叶片通过积累较多的脯氨酸和可溶性糖来抵御盐胁迫危害,耐盐型品种脯氨酸和可溶性糖含量升幅大于盐敏感品种,脯氨酸对盐胁迫逆境的调节作用大于可溶性糖。
3 讨 论
作物种间及同一种作物基因型间对盐胁迫的耐受性在自然变异中存在明显差异[14-15],栽培种植作物耐盐基因型是最经济可行及高效的措施[16]。花生属中等耐盐作物,其耐盐能力与盐分类型、基因型、不同生长阶段等因素有关[17-18]。盐胁迫环境下,花生一方面通过自身生长习性与结构方面等生物特性的调节适应盐胁迫逆境,也可通过渗透调节物质合成与积累、膜脂过氧化物清除系统和气孔关闭等一系列生理生化调节机制来适应或抵抗盐胁迫等非生物胁迫。研究表明,不同花生基因型间、不同生育阶段其耐盐性差异较大,花生芽期和幼苗期对盐胁迫最敏感,萌发至幼苗期可作为鉴选高度耐盐种质的重要生育阶段[16-17]。200 个花生品种(系) 在0.30%~0.45%盐胁迫浓度下的苗期耐盐性鉴选结果认为,花生品种(系)耐盐性可分成高度耐盐型、耐盐型、盐敏感型和高度盐敏感型4类。红鳞蒲桃苗木在2 g/kg低盐浓度且水分充足时,抗氧化酶活性未受到显著影响,并促进了其地径的生长[19]。在水培条件下,甜高粱在低盐(50 mmol/L)胁迫下的MDA、脯氨酸、可溶性糖含量与对照间差异不显著,抗氧化酶活性显著高于对照。说明耐盐作物生长在较低浓度的盐胁迫条件下受到一定的促进作用[20-21]。在本试验条件下,4个花生品种叶片的光合和抗氧化酶系统各指标在0~1.0 g/kgNaCl胁迫浓度下均未受到盐胁迫的显著影响,甚至在低盐胁迫下耐盐品种还有所升高,亦证明了上述结果。
植物复杂的耐盐机制涉及到诸如光合作用、呼吸作用、水利用效率等的主要生理变化过程。以往研究表明,盐胁迫条件下野生大豆光合速率的降低是由于叶片气孔关闭胞间CO2浓度降低所致[22-23],而Yang等[23]认为耐盐型野生大豆在盐胁迫下光合速率下降的主要原因是气孔限制,而盐敏感型野生大豆光合速率下降的主要原因则是非气孔限制。本试验结果表明,盐胁迫下花生光合作用受抑的原因因品种和NaCl胁迫浓度的不同而异,在0~1.0 g/kg NaCl胁迫浓度下,耐盐品种HY25和LH12叶片气孔导度、最大净光合速率、表观量子效率等光合作用及效率指标和抗氧化酶活性及渗透调节物质等生理机能均不受影响,而盐敏感品种则与对照间均表现出显著的差异;在2.0~3.0 g/kg NaCl胁迫浓度下,各花生品种光合作用和生理机能指标均显著降低,但耐盐品种HY25和LH12的降幅较小,受盐胁迫抑制作用较小。在较低NaCl胁迫(0~2.0 g/kg)下,耐盐花生品种光合速率的降低是非气孔因素所致,在2.0~3.0 g/kg NaCl胁迫下气孔因素是导致其光合速率降低的重要原因。
为适应不同盐胁迫环境,不同植物已经在长期的进化过程中形成了一系列相应保护机制,其中植物活性氧清除能力的提高是维持植物在盐渍条件下正常生长的重要手段之一[24-26]。但这种保护能力并不是无限制的,当盐胁迫浓度超出一定范围时,保护酶活性和渗透调节物质积累便会下降,对植物的保护能力也随之大大降低[27-28]。盐胁迫下不同抗盐能力的土豆抗氧化能力的增强利于提高抗盐品种的抗盐能力,并且非酶系统比酶系统起的作用更为重要[29]。本试验结果也证明此观点,在较低盐胁迫条件(1.0 g/kg NaCl)下,各花生品种叶片SOD活性降低,而CAT活性和MDA含量增加;当NaCl胁迫强度超过2.0 g/kg时,耐盐品种HY25和LH12叶片的SOD和CAT活性的降幅以及MDA含量的增幅均低于盐敏感品种HH1和HY20,同时抗氧化酶CAT和POD对盐胁迫逆境的抵御作用强于SOD。另外,在NaCl胁迫条件下,本研究中花生叶片还能通过积累较多的脯氨酸和可溶性糖抵御盐胁迫危害,耐盐型品种脯氨酸和可溶性糖含量升幅大于盐敏感品种,且脯氨酸对盐胁迫逆境的调节作用大于可溶性糖。
植物耐盐机制主要生理过程的复杂化使得耐盐品种或盐敏感品种间的耐盐性表现存在差异。本研究中HY25和LH12虽同样鉴选确定为耐盐品种,但其CAT活性等相关指标随NaCl胁迫浓度的变化不同。其中,HY25叶片CAT活性在2.0 g/kg胁迫处理下显著高于其他胁迫浓度,而LH12则以1.0 g/kg处理较高;LH12叶片脯氨酸含量在2.0 g/kg胁迫处理下显著高于其他胁迫浓度处理,HY25品种则于3.0 g/kg处理下较高。说明LH12叶片抗氧化酶系统在低盐胁迫浓度下即表现出响应,而HY25对中盐胁迫可快速启动抗氧化酶系统给予调节适应;在脯氨酸积累方面,LH12对于中盐胁迫能快速启动调节机制,大量增加脯氨酸含量,维持细胞质膜稳定性,减少膜脂过氧化伤害。
综上所述,花生光合作用受NaCl胁迫的明显抑制,表观量子效率和最大净光合速率随其胁迫浓度的升高明显降低,光补偿点和光饱点因品种耐盐性和盐胁迫浓度的不同其差异较大,光补偿点有随盐胁迫浓度的提高而升高的趋势,但盐敏感品种的光饱和点降低。盐敏感品种利用弱光的能力在低于2.0 g/kg NaCl胁迫下强于耐盐品种,在较高的盐胁迫浓度(3.0 g/kg)胁迫下其最大净光合速率明显低于耐盐品种。可见,在盐胁迫条件下,耐盐花生品种叶片光补偿点和最大净光合速率提高,叶片持水能力、物质代谢能力增强,以及抗氧化和渗透调节能力升高是其抗盐耐逆的主要原因之一。
近年来,对植物盐胁迫应答和抗盐生理机制的研究取得了较大进展,涉及到增强植物耐盐性的相关基因挖掘、克隆、转录,但从基因组学、蛋白组学和代谢组学等研究植物耐盐胁迫分子机理仍存在许多严峻挑战[30]。目前,虽然对植物种子萌发与幼苗阶段等耐盐性的研究比较深入,但从植物不同生长阶段以及整个生命过程入手,比较各项指标间的差异研究较少。在明确花生对盐胁迫适应机制的基础上,通过栽培调控手段提升其抗盐能力有待继续在实际生产中运用验证。今后,随着分子生物学、基因组学和新一代高通量 DNA 测序技术的快速发展,利用基因工程等新技术,培育耐盐能力增强的品种,从分子和细胞基础领域深入探究植物对盐胁迫耐受机制,开发利用耐盐植物资源,增强植物对盐害的耐受性等方面具有重要意义。

