海岛棉GbHCT13基因的功能验证
滕 露,郑 凯,曲延英,陈全家
(新疆农业大学 农学院/农业生物技术重点实验室,乌鲁木齐 830052)
棉花为锦葵科(Malvaceae)棉属(Gossypium)植物的种籽纤维,是世界性重要经济作物。世界主要棉产国有中国、美国、印度和巴基斯坦及中亚地区,主要栽培品种为陆地棉。在新中国成立70年以来的生产实践中,棉花生产取得的长足进步为实现国家富强、改善和提高人民生活水平做出了巨大贡献。依靠科技进步实现棉花生产的可持续发展尤为重要[1]。中国是世界上主要棉花生产和消费国之一,棉纤维作为其主要产品而倍受关注。然而,广泛种植的陆地棉其纤维品质较差,不能满足现代纺织工业对原棉多样性的要求[2],高品质棉纤维仍需进口,成为制约棉花相关产业发展的瓶颈之一。故改良纤维品质已成为棉花育种行业的主要目标。而海岛棉纤维品质优良,研究其纤维发育相关基因,用以改善纤维品质并满足生产需求具有重要理论意义和应用价值。
目前广泛认同的棉纤维发育模式是由Jasdanwala于1977年提出的纤维起始、伸长、次生壁加厚和脱水成熟4个时期[3],该时期的确定对后来纤维的发育调控研究具有重要指导意义[4]。棉花纤维发育是一个高度程序化的过程,期间经历多种化学物质的复杂生理生化变化。该历程也受到多种基因的调控[5-6],纤维发育的4个时期没有明显的分界线又互相交叠,并且这种现象在品种间也存在差异。棉花纤维与人民生活紧密相关,纤维品质的优劣对于农业工业生产也影响巨大[7],故研究棉花纤维发育的分子机制具有重要的生物学意义以及实践生产价值。木质素是苯丙烷代谢途径的重要产物之一[8],是进行植物体物质运输的重要场所,被称为植物生理学的支柱[9]。其合成过程需要大量酶的参与,这些合成酶在植物不同组织中存在表达差异[10],其中HCT基因位于合成木质素途径中的上游位置,是G/S木质素单体合成的主要控制基因,因此可以通过调控HCT基因来实现木质素单体的生物转化,从而达到改变植物木质素单体组成以及降低木质素含量的目的。HCT基因在木质素合成过程研究得较晚,随着研究深入,该基因越来越受到重视。转HCT的杨树茎杆木质部细胞发生形态结构改变,细胞壁薄而中腔增大,纤维丝排列方向改变[11];下调HCT引起植株木纤维细胞和导管分子细胞显著减小[12];前人通过沉默烟草中HCT探究该基因对植株木质化的影响发现,HCT蛋白在烟草茎秆中的活性较根和其他组织高,主要分布在木质化组织中,证实了HCT抑制对木质素合成有直接影响,其中茎秆和根组织中最幼嫩的组织受影响最大[13]。进一步研究了HCT基因沉默对木质素结构的影响发现,沉默植物木质素结构的变化主要是S单元的减少和H单元的增加,表明HCT在不同木质素单体转化之间的作用。对成熟棉纤维中的木质素含量测定发现,不同发育时期单位棉铃纤维的木质素含量变化具有一定规律性,木质素会随着发育时期的变化逐步增加,同时在纤维的超微结构中,次生壁加厚也具有相同的趋势,即木质素积累的变化与纤维素的沉积具有相同的趋势[14]。范玲等[15]通过多种研究方法证实了棉花纤维发育过程中存在苯丙烷代谢途径,并且证实了该代谢途径的中间产物与细胞壁相关。棉纤维细胞壁的组分含量,直接关系到棉花纤维的品质和产量。因此,了解棉纤维发育过程及该过程中纤维细胞壁组分的变化对于正确认识棉纤维品质形成的分子生物学基础有着重要的意义。
本研究通过克隆海岛棉HCT基因,并构建过表达和基因沉默载体转化拟南芥和棉花,观察转基因植株的表型并测定相关指标,进而分析HCT基因在棉花纤维发育中的表达情况,为了探索苯丙烷类化合物对发育中的棉纤维的影响,进一步检测该途径中关键基因在纤维中的表达情况,对研究纤维发育相关基因的作用及其分子机制奠定实验基础。
1 材料和方法
1.1 材 料
本实验材料为海岛棉‘新海21’、陆地棉ND203和哥伦比亚野生型拟南芥(col),种子均保存于新疆农业大学农业生物技术重点实验室。本研究所用大肠杆菌菌株是(Escherichiacoli)DH5α,载体转化采用根癌农杆菌(Agrobacteriumtumefaciens)菌株GV3101,植物表达载体是pCAMBIA3301,VIGS基因沉默所用病毒载体pTRV1和pTRV2,以及CLA基因均由新疆农业大学农业生物技术重点实验室保存。
1.2 方 法
1.2.1GbHCT13基因转化拟南芥及棉花1)GbHCT13植物过表达载体构建。设计双酶切引物GbHCT13-F和GbHCT13-R扩增GbHCT13基因(表1),反应体系为:DNA 2 μL,10×HiFi-缓冲液 5 μL,上下游引物各1 μL,ddH2O 11 μL,dNTP混合物4 μL,HiFi酶1 μL。将测序结果正确的GbHCT13基因片段与pCAMBIA3301质粒经限制性内切酶BglⅡ和Eco91 Ⅱ经37 ℃酶切40 min,反应体系为:目的片段7 μL,酶均为1 μL,10×PCR 缓冲液 4 μL,ddH2O 7 μL。检测后连接GbHCT13基因与载体大片段,并转化DH5α。利用pCAMBIA3301载体通用引物bar-F和bar-R对转化后的阳性菌落进行PCR检测,将正确重组质粒命名为pCAMBIA3301-GbHCT13。

表1 实验中所用引物序列表
2) 菌液的准备。将含有pCAMBIA3301-GbHCT13质粒的农杆菌菌液,于28 ℃、200 r/min恒温摇床中培养至OD为0.6,培养时添加50 mg/mL的抗生素卡那霉素和利福平;转接入新鲜LB培养基继续培养至菌液OD为1.0~1.2;制备好的菌液4 000 r/min离心10 min,弃上清后用10%蔗糖溶液重悬菌体沉淀至OD为0.6~0.8。
3) 转基因操作。转化前一天标记即将开花的棉花花朵,次日上午对标记的花朵进行菌液喷施,保证喷雾覆盖整个花冠,菌液能完全侵染花药和柱头;用小皮筋轻柔捆扎喷施后的花朵,以防止菌液快速蒸发。拟南芥转化操作前修剪多余果夹,保留顶端花序用于侵染;目标菌液侵染植株整个花序时间不超过60 s;侵染完成后先经25 ℃黑暗培养24 h;再转为16 h/8 h光照条件下正常培养至收获种子;根据实际转化情况,于1周之后开展第2次侵染,步骤同上。
4) 转GbHCT13基因拟南芥与棉花植株筛选与鉴定。设置3种浓度(0.06%、0.07%和0.08%)的除草剂用于转基因棉花抗性筛选及PCR样品检测,引物为bar-F/R。待转化后的拟南芥T0代种子幼苗的2片子叶完全展开即可进行抗性筛选,将200 μL 10%的除草剂原液和400 μL表面活性剂吐温20,溶于400 mL水中,连续喷施3次,1周后观察幼苗表型,分离黄化与正常绿色植株,常绿植株移栽至新的营养土中培养至收获种子。
5) 转基因植株表型鉴定及相关检测。转基因棉花采取梳绒方法并测定纤维长度,纤维样品送公司测定指标。对GbHCT13转基因拟南芥进行表型拍照,统计其茎秆表皮毛数量、6~8叶期的叶片数量、抽薹数量。茎秆截取2~3 cm用FAA固定液保存,进行番红-固绿染色,用ImageJ软件进行图片分析。利用qRT-PCR检测苯丙烷代谢通路上相关基因的表达变化。
1.2.2 转GbHCT13基因棉花VIGS沉默1)GbHCT13基因沉默载体构建。根据GbHCT13全长序列,选取非保守区大小为328 bp插入序列与pTRV2载体连接,设计带酶切位点的特异性引物VIGS-GbHCT13-F和VIGS-GbHCT13-R(表1)进行PCR扩增(退火温度为62 ℃),分别用EcoRⅠ与BamHⅠ对质粒和PCR纯化产物进行双酶切,酶切产物经纯化后,用T4连接酶将酶切产物于22 ℃连接20 min,将连接产物转化大肠杆菌DH5α,菌液PCR检测阳性克隆,再送至北京华大测序有限公司测序。
2)GbHCT13基因沉默操作步骤。将制备好的pTRV1、pTRV2、pTRV2-CLA和pTRV2-GbHCT13分别转入农杆菌GV3101中,活化后离心重悬菌体,调节OD600为1.0~1.5;将3种菌液按照1∶1比例混合后注射完全展开的棉株子叶背面,注射菌液覆盖叶片80%以上;注射的植株暗培养24 h后置于28 ℃恒温培养。
3)GbHCT13基因沉默效率检测。注射2周后随机选取2个品种的基因沉默植株与对照植株,用植物多糖多酚RNA提取试剂盒提取新生叶片RNA(北京天根),并用RNase-free DNase I试剂盒合成cDNA第一链,经1.2%琼脂糖凝胶电泳检测后作为PCR模板。使用SYBR Green Master Mix(美国ABI)在ABI Prism7500系统中进行qRT-PCR,以棉花ubiquitin 7(UBQ7)基因作为内参,每个样品进行3次重复检测,结果采用2-ΔΔCt法进行数据分析。
4)GbHCT13沉默植株表型观察。拍照观察GbHCT13基因沉默植株长势变化,采用体式显微镜观察其茎秆和叶柄表皮毛数量及密度变化,数据统计和显著性分析采用Graphpad Prism软件。
5)GbHCT13沉默植株茎秆组织切片分析。截取GbHCT13基因沉默的2个品种植株子叶节点以上的整段茎秆,切分为2~3 cm的小段后保存于FAA固定液中,送至武汉赛维尔生物公司进行切片和番红固绿染色处理。
6)GbHCT13沉默植株木质素含量测定。本实验参考曹双瑜等[16]的硫酸木质素(Klason)方法,在此基础上略有改动。称取待测植株茎秆各2 g,经缓冲液(50 mmol/L Tris-HCl,10 g/L Triton X-100,1 mol/L NaCl)清洗2次,80%丙酮洗2次,纯丙酮洗1次,烘干备用;将定量滤纸用3%硫酸浸润后烘干至恒重W1(g);将烘干的茎秆样品置于50 mL离心管内,加15 mL 4 ℃下预冷的72%硫酸,室温静止2 h,期间每隔10 min充分混匀1次,直至茎秆完全被降解;加水稀释至硫酸终浓度为3%;经0.1 Mpa,121 ℃的灭菌锅降解1 h;冷却至室温后用处理好的滤纸过滤残渣;滤纸及残渣烘干至恒重记为W2(g);灼烧后测定过滤物的灰分W3(g);计算酸不溶木质素量%=(W2-W1-W3)/2×100%。
2 结果与分析
2.1 拟南芥中GbHCT13基因功能验证
2.1.1 pcAMBIA3301-GbHCT13重组载体检测双酶切验证以前期克隆完成的T5-GbHCT13质粒为模板,连接GbHCT13与pCAMBIA3301载体,转化根癌农杆菌GV3101后筛选含有正确连接GbHCT13片段的阳性重组载体菌液,结果表明重组载体成功转化农杆菌(图1,A)。采用BglⅡ和Eco91 Ⅰ酶对重组载体进行双酶切验证(图1,B),GbHCT13片段大小为1 311 bp,pCAMBIA3301载体大片段9 264 bp,将片段大小正确的重组载体命名为pCAMBIA3301-GbHCT13保存备用。
2.1.2 转GbHCT13基因拟南芥植株筛选鉴定如图2所示,转GbHCT13基因的拟南芥经除草剂筛选,部分幼苗出现枯黄死亡现象,移栽正常生长的绿色幼苗至新鲜营养土(珍珠岩∶蛭石∶有机质=1∶2∶2)中继续培养至收获T2代种子,经50 mg/mL抗性培养基进一步筛选,移栽能够正常生长的绿色幼苗,白化苗拔除。经过每次均单株收获种子的多代筛选,获得T3代植株,培养后开展表型及分子鉴定。

M.DL2000; A. 1-5. 重组载体;B. 1. 重组载体双酶切图1 pCAMBIA3301-GbHCT13重组载体筛选及双酶切验证M. DL2000; A. 1-5. Recombinant vectors; B. 1. Recombinant vector with double enzyme cutFig.1 pCAMBIA3301-GbHCT13 recombinant vector screening and double enzyme verification
2.1.3 拟南芥分子检测及表型观察qRT-PCR检测结果表明,转基因植株中目的基因表达量较野生型极显著增加。T3代植株生长至6~8片莲座叶时期,摘取叶片进行DNA分子检测表明,4株苗均检测到抗除草剂bar基因的目的条带(图3,A),与pCAMBIA3301空载体质粒DNA对照相比,条带清晰且单一,表明重组载体转入拟南芥中,初步获得转基因阳性植株(图3,B)。转基因植株同一时期整体的生长情况较野生型旺盛,株形与野生型不同,在同一生长时期的叶片数、抽薹数和茎秆表皮毛的数量(图3,C-E)较野生型存在差异。
分别对转GbHCT13基因和野生型拟南芥植株进行2次抽薹、叶片和茎秆表皮毛等的数量统计,发现6叶期转基因植株的抽薹数和叶片数量较野生型增加,达到极显著差异,而8叶期则无显著差异;转GbHCT13基因植株花期的茎秆表皮毛数量也极显著高于对照(图4)。
2.1.4 转GbHCT13基因拟南芥植株切片观察及相关基因表达检测为了进一步观察GbHCT13基因在拟南芥中过表达对植株生长变化的影响,选取转基因待测植株的茎秆进行切片及染色分析,观察其内部组织变化,发现转基因植株较野生型茎秆初生木质部生长活跃,次生木质部导管细胞壁横截面积变大,表明GbHCT13基因在拟南芥中过量表达使导管增粗,髓质细胞无明显变化。
基因的表达对植株生长变化的调控作用往往是通过多种基因的协调配合而实现的,通过观察GbHCT13的过表达对该基因代谢途径上相关基因的影响,对拟南芥筛选出HCT基因合成与代谢通路上的5个相关基因,检测发现CAD、CCoAOMT、CCR、PAL和4CL这5个关键基因较对照存在不同的表达趋势(图5),过表达拟南芥植株CAD、CCoAOMT、PAL和4CL的表达量分别是对照的25.28倍、1.57倍、3.12倍和4.29倍,其中CAD表达量极显著增加,而CCR表达量显著下降,表明拟南芥中GbHCT13基因过量表达使木质素合成途径基因发生不同程度改变,其中CAD、CCoAOMT、PAL和4CL与GbHCT13基因的表达呈正相关。
2.2 GbHCT13基因在棉花中功能验证
2.2.1 转GbHCT13基因植株田间筛选与鉴定转基因T1代成铃率为26.5%,GbHCT13转基因T2代植株田间种植350株,筛选后存活43株,存活率为12.29%,单株收获种子,采用检测到的阳性植株开展后续鉴定工作。
2.2.2 转GbHCT13基因棉株分子检测分别对T1、T2代转GbHCT13基因植株进行随机采样,带回室内提取叶片DNA进行PCR分子检测,样品中均检测到包含抗除草剂bar基因的475 bp目的带,做好标记待收获单株种子。T3植株经半定量检测到明亮单一的目的条带,认为初步获得转基因植株(图6)。
2.2.3 转GbHCT13基因T2代植株纤维表型分析随机选取转GbHCT13基因的T2代棉花纤维,进行3组重复,每组5个样本,梳理发现,对照棉纤维长度均值2.58 cm,转基因棉纤维长度均值2.60 cm,并无明显增长(图7)。
纤维5项指标测定结果表明,GbHCT13转基因T2代棉花纤维长度较对照无明显增加,这与前期手工梳绒结果一致,但伸长率显著增加,说明测定的转纤维样品较非转基因而言,纤维有增长趋势;转基因前后纤维整齐度均良好;马克隆值显著降低,在纤维品质分类上可由原来的C2级达到B2级;断裂比强度增加,但未达到显著差异(图8)。
2.2.4GbHCT13基因沉默载体构建将GbHCT13与pTRV2载体连接后通过菌液PCR筛选阳性克隆(图9),检测到预期大小相符的328 bp目的基因插入序列,对检测含有目的片段的阳性菌液提取质粒,经EcoRⅠ与BamHⅠ双酶切验证(图10),酶切正确的质粒送测序,将测序结果与所选片段序列完全吻合的质粒命名为pTRV2-GbHCT13。

A.T2代幼苗;B.T3代幼苗筛选前;C.T3代幼苗筛选后;D.转基因存活植株移栽图2 喷施除草剂后转基因拟南芥幼苗状态A. T2 generation seedlings; B. T3 generation seedlings before screening; C. Screening of T3 generation seedlings;D. Transplanting viable transgenic plantsFig.2 Seedling status of transgenic Arabidopsis thaliana after herbicide spraying

A. T3代转基因拟南芥DNA检测:M. DL2000;1. 阴性对照(野生型拟南芥);2. 阳性对照(pCAMBIA3301空载体);3. 空白对照(水);4-7. 转基因拟南芥;B. 转基因拟南芥中GbHCT13基因表达检测:WT. 野生型col(对照);1-4. 转基因拟南芥;*和** 表示处理与对照之间显著(P<0.05)和极显著差异(P<0.01),下同;C. 植株表型;D. 茎秆表皮毛;E. 抽薹前植株叶片;C-E图中左为对照(野生型col),右为转基因拟南芥(T3)图3 转基因拟南芥T3代分子检测及表型分析A. DNA detection of transgenic T3 generation Arabidopsis thaliana: M. DL2000; 1. Negative control (wild-type Arabidopsis thaliana); 2. Positive control (pCAMBIA3301 empty plasmid DNA); 3. Blank control (water); 4-7. Transgenic Arabidopsis thaliana; B. Detection of GbHCT13 gene expression in transgenic Arabidopsis thaliana; col. Wild-type(control); 1-4. Transgenic Arabidopsis; * and ** indicate significant (P<0.05) and extremely significant differences (P<0.01) between control and treatment, the same as below; C. Phenotypic observation of the whole plant; D. Observation of stem surface fur; E. Observation of plant leaves before mossing; C-E Control on the left is wild Arabidopsis thaliana, experimental group on the right is transgenic Arabidopsis in FigureFig.3 Molecular detection and phenotypic analysis of transgenic Arabidopsis thaliana T3 generation

A. 6叶期抽薹数;B. 6叶期叶片数;C. 8叶期抽薹数;D. 8叶期叶片数;E. 花期茎秆表皮毛数量图4 转GbHCT13基因拟南芥T3代植株生物学统计A. Number of bolting at 6 leaf stage; B. Number of leaf at 6 leaf stage; C. Number of bolting at 8 leaf stage; D. Number of leaf at 8 leaf stage; E. Number of fur at stem in flossomFig.4 Biological statistics of T3 generation transgenic Arabidopsis thaliana with GbHCT13 gene
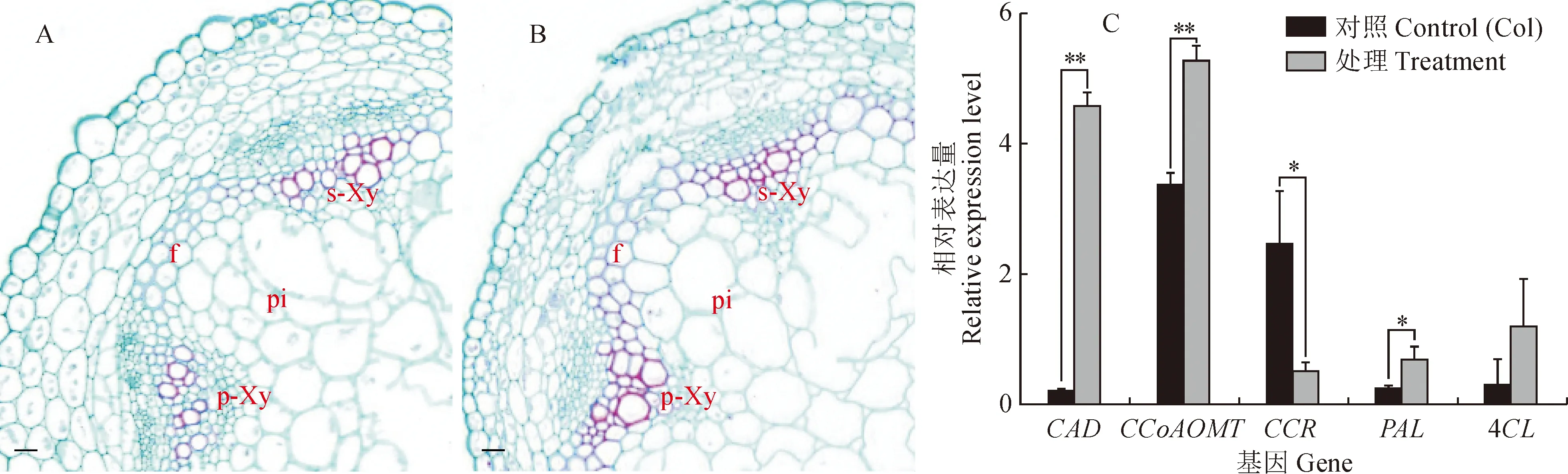
A.对照(野生型col);B. 转基因拟南芥; pi. 髓;s-Xy. 次生木质部;p-Xy. 初生木质部;标尺=100 μm; C. 相关基因表达图5 转GbHCT13基因拟南芥T3代植株切片观察A. Control (wild type col); B. Transgenic Arabidopsis thaliana; pi. Pith; s-Xy. Secondary Xylem; p-Xy. Primary Xylem; Bar=100 μm; C. Related gene expressionFig.5 Section observation of T3 generation Arabidopsis thaliana transgenic with GbHCT13 gene
2.2.5GbHCT13基因沉默效率检测基因表达检测表明,实验组GbHCT13基因表达量较对照极显著降低,‘新海21’中沉默效率分别为63.05%、72.92%和80.04%(图11,A),ND203中沉默效率分别为63.11%、4.08%和45.80%(图11,E)。沉默组较阴性对照植株株高明显降低,阳性对照白化苗的株高低于阴性对照,可能由于CLA基因沉默影响叶绿色合成从而造成植株矮化与培养条件无关(图11,B、F)。由于‘新海21’植株表皮毛极不明显(图11,C、D),对更具有代表性的ND203品种进行茎秆表皮毛观察与统计(图11,G、H),表明GbHCT13基因沉默使ND203植株茎秆和叶柄表皮毛数量显著减少(图12)。
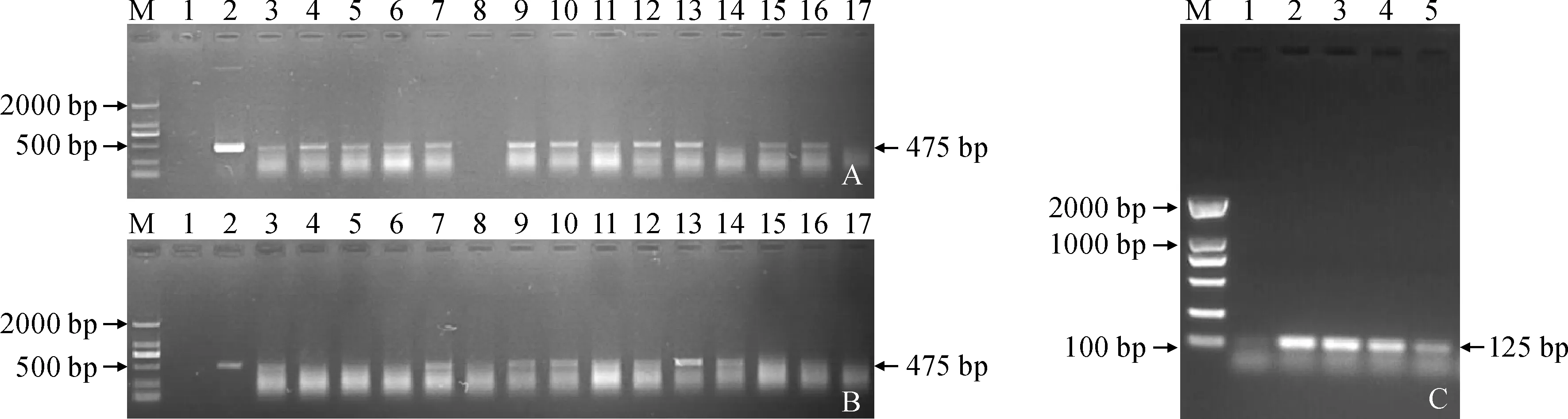
A、B. T1和T2代植株DNA检测:M. DL2000;1. 阴性对照(水);2. 阳性对照(pCAMBIA3301);3-17. 转基因棉花; C. T3代植株半定量检测:1. 阴性对照(水);2. 阳性对照(pCAMBIA3301);3-5. 转基因棉花图6 转GbHCT13基因棉花后代PCR检测A, B. DNA detection of T1 and T2 generation plants; M. DL2000; 1. Negative control (water); 2. Positive control (pCAMBIA3301); 3-17. Transgenic cotton; C. Semi-quantitative detection of T3 generation plants: 1. Negative control (water); 2. Positive control (pCAMBIA3301); 3-5. Transgenic cottonFig.6 PCR detection of transgenic cotton with GbHCT13 gene

A. 非转基因棉纤维;B. 转基因T2代棉纤维;C. 棉纤维长度比较:对照. 非转基因棉花;处理. 转基因棉花;下同图7 转GbHCT13基因棉花T2代纤维观察A. Non-genetically modified cotton fibers; B. Transgenic T2 cotton fiber; C. Cotton fiber length compared: Control. Non-transgenic cotton; Treatment. Transgenic cotton; The same as belowFig.7 Observation of GbHCT13 transgenic T2 cotton fiber

A. 纤维上半部平均长度;B. 纤维整齐度;C. 马克隆值;D. 纤维断裂比强度;E. 纤维伸长率图8 转GbHCT13基因棉花T2代纤维指标测定A. Average length of the upper half of the fiber; B. Fiber uniformity; C. Incompatible micronaire; D. Fiber breaking strength; E. Elongation of fiberFig.8 Determination of fiber index of GbHCT13 transgenic T2 cotton
M. DL2000; 1-10为检测菌液样品图9 VIGS-GbHCT13菌液PCR检测M. DL2000; 1-10 For detecting the sample of the fungusFig.9 PCR detection of VIGS-GbHCT13 bacterial fluid
M1. DL15000;M2. DL2000;1. pTRV2载体大片段9 335 bp,VIGS-GbHCT13片段328 bp图10 VIGS-GbHCT13重组载体双酶切验证M1. DL15000; M2. DL2000; 1. The pTRV2 vector is a large segment of 9 335 bp; VIGS-GbHCT13 segment of 328 bpFig.10 Determination of VIGS-GbHCT13 plasmid by double enzyme digestion
2.2.6 棉花茎秆组织切片分析为了进一步了解GbHCT13基因沉默对棉花植株内部组织结构的影响,对两品种的棉花茎秆进行切片处理(图13,A、B、D、E),对照中木质部被染成红色细胞数量是沉默植株的2.78倍,细胞壁染色厚度是沉默植株的1.56倍,差异极显著,此外沉默植株中木质部管状分子的排布不规则,导管细胞形状发生明显改变,整个木质部减小(图13,B、E)。

A 和E.对照. 非转基因棉花;1-3. 基因沉默棉花;A-D. ‘新海21’基因表达、植株表型、茎秆和叶柄;E-H. ND203基因表达、植株表型、茎秆和叶柄;C、D、G、H中左为对照,右为基因沉默棉花图11 基因沉默效率检测及2周后植株生长表型观察与统计A and E. Control. Non-transgenic cotton; 1-3. Gene silenced cotton; A-D. Gene expression of XH21; Plant growth performance; Stem and Petiole of XH21; E-H. Gene expression of ND203; Plant growth performance; Stem and Petiole of ND203; C, D, G and H. The left is the control; The right is the gene silenced cottonFig.11 Detection and statistics of GbHCT13 gene silencing efficiency and observation of plant growth phenotype after two weeks

对照. 非转基因棉花;1-3. 基因沉默棉花图12 GbHCT13基因沉默ND203植株表皮毛数量统计Control. Non-transgenic cotton; 1-3. Gene silenced cottonFig.12 GbHCT13 gene silencing ND203 plant surface fur number statistics
ND203植株切片结果显示,对照植株中木质部导管细胞排列规则整齐,被染色细胞数量及细胞壁厚度分别是沉默植株的4.29倍和1.71倍,差异极显著,沉默GbHCT13基因之后植株的木质部染色面积减少,导管变细,排列较对照不规则(图13,E)。
木质素测定结果表明,沉默GbHCT13基因的植株中木质素含量较对照极显著降低(图14,A)。检测了GbHCT13沉默植株中HCT基因通路相关基因的表达量变化发现‘新海21’和ND203两品种中CAD、CCoAOMT、CCR、PAL和4CL这5个关键基因均表现出相同的趋势,除4CL基因表达量极显著增加以外,其他4基因的表达呈现降低的趋势(图14,B、C)。GbHCT13基因沉默引起‘新海21’中4CL基因表达量增加到对照的10.29倍,两基因的表达呈现极显著负相关。

对照. 非转基因棉花;处理. 基因沉默棉花;A-D. ‘新海21’对照、处理、染色细胞数量和细胞壁厚度;E-H. ND203对照、处理、染色细胞数量和细胞壁厚度;ca. 形成层;pi. 髓;te. 管状分子;s-Xy. 次生木质部;p-Xy. 初生木质部;标尺=50 μm图13 GbHCT13基因沉默对木质素影响的组织化学分析Control. Non-transgenic cotton; Treatment. Gene silenced cotton; A-D. Control and treatment plant of Xinhai 21; Statistics on the number of cells and cell wall thickness of Xinhai 21; E-H. ND203 control and treatment plant; Number of ND203 staining cells and cell wall thickness; ca. Cambium; pi. Pith; te: Tracheary element; s-Xy. Secondary Xylem; p-Xy. Primary Xylem; Bar=50 μmFig.13 Histochemical analysis of the effect of GbHCT13 gene silencing on lignin in cotton

A.木质素含量变化; B. 新海21;C. ND203;对照. 非转基因棉花;处理. 基因沉默棉花图14 棉花GbHCT13基因沉默植株的木质素含量变化及其代谢通路相关基因表达A. Change of lignin content; B. Xinhai 21; C. ND203; Control. Non-transgenic cotton; Treatment. Gene silenced cottonFig.14 Expression of GbHCT13 pathway related gene and the changes of lignin content
3 讨 论
有研究表明棉花纤维发育中有苯丙烷类物质-木质素的合成,HCT基因在木质素合成中扮演关键作用。本研究对前期克隆的GbHCT13(GenBank 登录号:MW048849)进行基因功能验证,结果显示,该基因在拟南芥中异位表达使其表型发生改变,转基因拟南芥中GbHCT13基因表达量较野生型明显增加,植株生长旺盛,能够显著增加拟南芥抽薹数和莲座叶片数量,使其茎秆初生木质部细胞发生改变。棉花中过表达GbHCT13基因使纤维伸长率增加,比强度增加,马克隆值降低,表明纤维品质有所提升。棉花中沉默GbHCT13基因使植株茎秆表皮毛数量减少,而植物表皮毛的形成受到苯丙烷途径物质合成的影响[17],暗示GbHCT13基因抑制了苯丙烷代谢;木质素含量减低,初生木质部生长受到抑制,导管数量减少,细胞壁染色厚度降低,通路上关键基因表达量出现不同表达变化,而植株株高未发生明显矮化现象。鉴于HCT位于苯丙烷代谢通路的上游位置,它的抑制可能不仅影响木质素,而且影响其他代谢物,通过与该途径上其他基因的协调配合实现纤维品质改变。由此可以推测HCT基因主要参与棉花纤维细胞次生壁的合成,并且能调控棉纤维中的木质素含量。本实验中拟南芥植株木质素含量不便测定,后续有待选用合适的方法测定其含量。木质素由苯丙烷途径产生,其上游调控主要涉及3种酶:PAL,C4H[18]和4CL[19],它们表达活性的高低与木质素的总量密切相关[20]。在烟草中抑制PAL和C4H的表达均会不同程度降低木质素的含量,反义抑制PAL活性使木质素的含量下降并伴随S/G比值升高,严重影响植物的生长发育[21];抑制烟草中C4H的活性则发现S/G比值降低,但未对植物生长造成不良影响[22]。这种现象表明C4H可能参与S/G木质素单体的合成调控。Hu等通过反义RNA技术抑制黑杨4CL基因表达,90%以上的转基因株系中木质素含量下降达45%,且伴随纤维素含量增加了15%[23];杨雪萍等将4CL1基因反义转入到烟草中,发现植株的纤维素含量比对照提高了11.4%,而木质素含量比对照降低了19.1%[24],证明4CL可能是木质素合成中的限速酶之一,并且植物体内木质素和纤维素的合成具有一定的内在联系。植物本身的自我调节机制使其在改变某单一性状时对其他性状也产生影响。木质素合成的苯丙烷途径中包含HCT在内的多种关键酶基因的表达差异对木质素合成存在影响,通过调控相关基因活性的改变来分析木质部微观结构变化具有可行性。位于木质素合成途径中的关键基因通过互相调节实现木质素的合成,其中PAL和4CL位于木质素合成上游,决定碳元素流向,CAD、CCoAOMT、CCR则通过对木质素单体含量的改变来影响其总含量。本研究分析GbHCT13沉默植株中木质素合成相关基因表达变化,4CL基因表达量极显著增加,CAD、CCoAOMT、CCR降低,表明GbHCT13的沉默引起4CL补偿性增加,而植株中木质素含量降低则是由于CAD、CCoAOMT、CCR引起的单体含量减少,这对于通过代谢手段探究GbHCT13功能提供理论基础。
本研究表明,GbHCT13基因主要参与纤维发育伸长期,可能在胚珠纤维起始期促进棉纤维的生长,其他时期几乎不表达。棉花中沉默GbHCT13基因结果表明,抑制GbHCT13使棉花生长代谢受阻,影响纤维发育起始。GbHCT13基因能增加棉纤维伸长率,增加纤维强度,进而改善棉纤维品质。通过对GbHCT13基因表达的调控,可实现在不影响棉花植株正常营养和生殖生长的情况下,改善纤维品质。本实验为后续利用海岛棉优良基因改善陆地棉纤维品质提供实验基础和理论支持。

