LiCl-KCl、NaCl-KCl和KCl熔盐体系中Ce(Ⅲ)的电化学行为
张 磊,王有群,2,谢书宝,王文涛,郑卫芳,*
1.中国原子能科学研究院 放射化学研究所,北京 102413;2.东华理工大学 核科学与工程学院,江西 南昌 330013
干法后处理技术是利用高温下铀钚化合物与裂片元素挥发性的差异、熔盐中与裂片元素高温萃取行为差异或与裂片元素电化学性质差异,分离出铀、钚等物质并加以回收的化学过程。目前,干法后处理技术中的熔盐电化学分离技术被认为是一种最具发展前景,可行性、经济性、可靠性均较好的后处理技术,已在国际上得到广泛研究,但其中较为突出的问题之一就是电流效率较低[1]。熔盐电解还原过程中,除了关注的目标离子会进行还原外,基体盐中同时存在大量的阳离子,并且其浓度一般高于目标离子,尤其在进行到电解后期,实验条件如控制不当,极易造成基体盐的大量电解,导致电流效率迅速降低[2]。
以氯化物熔盐为电解体系的电解精炼技术已用于实验室规模的金属制备,考虑到放射性实验的难度和风险,选择CeCl3作为研究对象进行不同熔盐体系中的电化学行为研究。Ce(Ⅲ)在LiCl-KCl熔盐体系中的电化学行为研究较为广泛,但在高于金属Ce熔点(1 071 K)温度下的NaCl-KCl和KCl熔盐体系中的电化学行为鲜有报道,而实际工况的电解温度须高于其熔点温度。
本工作拟研究不同温度下,Ce(Ⅲ)在LiCl-KCl、NaCl-KCl和KCl体系中的电化学行为,采用多种电化学方法考察Ce(Ⅲ)在Mo电极上的电化学还原过程。通过不同温度下的电化学行为差异,得出温度对电解还原过程的影响。该变化规律同样适用于其他金属离子,研究结果可为高温下的熔盐电解工艺提供参考依据。
1 实验部分
1.1 试剂和仪器
无水LiCl,纯度为99%,上海中锂实业有限公司;NaCl(分析纯)、KCl(分析纯),AgCl(纯度为99.5%),上海麦克林生化科技有限公司;CeCl3,纯度为99.9%,包头稀土研究院;Ag丝、Mo丝,直径均为1 mm,纯度为99.99%,Alfa-alser(天津)有限公司;高纯度Al2O3包覆的石墨棒,φ4 mm,上海炭素厂;Pyrex玻璃,φ6 mm,美国康宁公司;莫来石,6 mm×4 mm×500 mm(牌号:HB),日本Nikkato株式合作社;刚玉坩埚,定制,巩义市颖辉高铝瓷厂;L2测温片,日本JFCC;高纯液氩,纯度为99.999%,北京氙禾玉商贸有限公司。
Satorius BSA224S电子天平,精度0.1 mg,德国赛多利斯集团;Gamry Reference 5000电化学工作站,美国Gamry公司。
1.2 电化学系统
Ce(Ⅲ)在LiCl-KCl、NaCl-KCl和KCl熔盐体系中的电化学行为研究装置示于图1。所有实验均在高纯氩气气氛手套箱内(H2O、O2含量低于10 mg/m3)进行。手套箱下部安装加热炉进行加热,采用热电偶进行温度控制和反馈。恒温过程中坩埚内温度采用测温片进行校正。

图1 电化学实验装置示意图
1.3 实验方法
采用三电极体系进行Ce(Ⅲ)的电化学行为测定,惰性工作电极为φ1 mm的钼丝,对电极为φ4 mm的光谱纯石墨棒,使用前均采用细砂纸打磨并用酒精清洗干净。参比电极采用自制的Ag/AgCl(x=2%)电极[3-4]。实验过程中使用的熔盐均是经过纯化处理后配制成的LiCl-KCl(摩尔比59∶41)、NaCl-KCl(摩尔比1∶1)混合熔盐。
2 结果与讨论
2.1 LiCl-KCl熔盐体系的电化学行为
(1) 循环伏安曲线(CV)
751 K时LiCl-KCl-CeCl3熔盐体系于Mo电极上扫描速率为50~250 mV/s时的循环伏安曲线(CV)示于图2。由图2可知,-2.18 V附近出现一对氧化还原峰A和A’,A峰为先缓慢升高后迅速下降,A’则是先快速下降后缓慢上升,是典型的溶-不溶过程[5],即Mo电极上沉积的金属溶解和熔盐中Ce的沉积过程,也即Ce氧化为Ce(Ⅲ)和Ce(Ⅲ)还原为Ce的过程。同时,阴极峰电位(Ep)随扫描速率(v)的增加基本保持不变,表明Ce(Ⅲ)在Mo电极上的还原过程为可逆反应。

T=751 K,S=0.64 cm2,c(Ce(Ⅲ))=6.49×10-5 mol/cm3
对于溶-不溶的可逆反应体系Ce(Ⅲ)/Ce,循环伏安曲线的峰电位与半峰电位符合关系式(1)[6]。
(1)
其中:Ep为阴极峰电位,V;Ep/2为阴极半峰电位,V;R为理想气体常数,8.314 J/(mol·K);T为开尔文温度,K;n为电子转移数;F为法拉第常数,通常取96 500 C/mol。将循环伏安曲线中的Ep、Ep/2值代入式(1),计算得到n≈3。这表明Ce(Ⅲ)在LiCl-KCl熔盐体系中Mo电极上的还原为三电子转移过程。
对于溶-不溶可逆体系,阴极峰电流(Ip)和扩散系数的关系可采用Berzins-Delahay方程(式(2))表示[7]。
(2)
式中:S,电极表面积,cm2;c0,溶质摩尔浓度,mol/cm3;D,溶质离子的扩散系数,cm2/s;v,电位扫描速率,V/s。将扫描速率的平方根与阴极峰电流(Ip)进行作图示于图3。由图3可知:不同扫描速率的平方根(v1/2)与峰电流成正比,表明反应是扩散控制。由循环伏安法计算得到的扩散系数列入表1。

表1 不同温度时的Ce(Ⅲ)扩散系数

S=0.64 cm2,c(Ce(Ⅲ))=6.49×10-5 mol/cm3
图4为Ce(Ⅲ)在不同温度时的CV曲线,对于溶-不溶体系,Ce(Ⅲ)/Ce的表观还原电位(E⊖,*(Ce(Ⅲ)/Ce))可由峰电位(式(3))计算[8]。

v=100 mV/s,S=0.64 cm2,c(Ce(Ⅲ))=6.49×10-5 mol/cm3
(3)
式中:X为LiCl-KCl熔盐体系中CeCl3的摩尔分数。
由式(3)计算得到的表观还原电位列入表2。
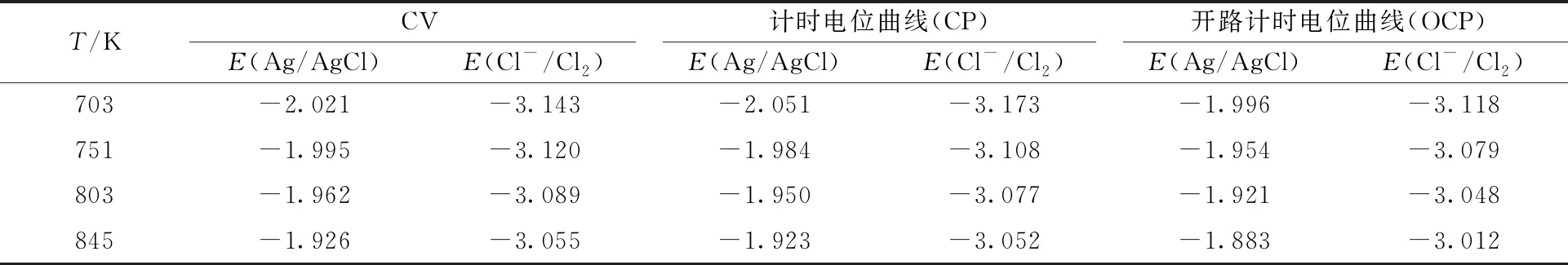
表2 不同温度时Ce(Ⅲ)/Ce的表观还原电位
(2) 方波伏安法(SWV)
方波伏安法可消除电容和残余电流[9],因此可用于测定熔盐中离子在电极上反应的转移电子数。为进一步研究Ce(Ⅲ)在Mo电极上的还原过程,采用方波伏安法确定Ce(Ⅲ)还原反应过程中的电子转移数,判断Ce(Ⅲ)的还原步骤,结果示于图5。对于可逆反应,半峰宽w1/2仅与温度T和电子转移数n有关,如式(4)所示[10]。
(4)
根据图5计算得到n=3.03接近于3,与CV法计算结果一致,表明Ce(Ⅲ)的还原过程是一步三电子转移(式(5))。

f=10 Hz,S=0.64 cm2,c(Ce(Ⅲ))=6.49×10-5 mol/cm3

(5)
(3) 开路计时电位法
不同温度下LiCl-KCl-CeCl3熔盐体系的开路计时电位曲线(OCP)示于图6。由图6可知:不同温度时,恒电位E=-2.30 V电解20 s断开电流后的OCP曲线在-2.15~-2.05 V左右出现一平台,为沉积的金属Ce氧化生成Ce(Ⅲ)的过程;同时温度由703 K升至845 K时,平台的电位由-2.13 V升至-2.05 V,与Nernst方程相符。由于开路时,电流极小,氧化反应处于准平衡状态,因此表观还原电位可由Nernst方程计算[11-13]:
S=0.64 cm2,c(Ce(Ⅲ))=6.49×10-5 mol/cm3
(6)
其中:Eeq为准平衡电位,V。
(4) 计时电位法
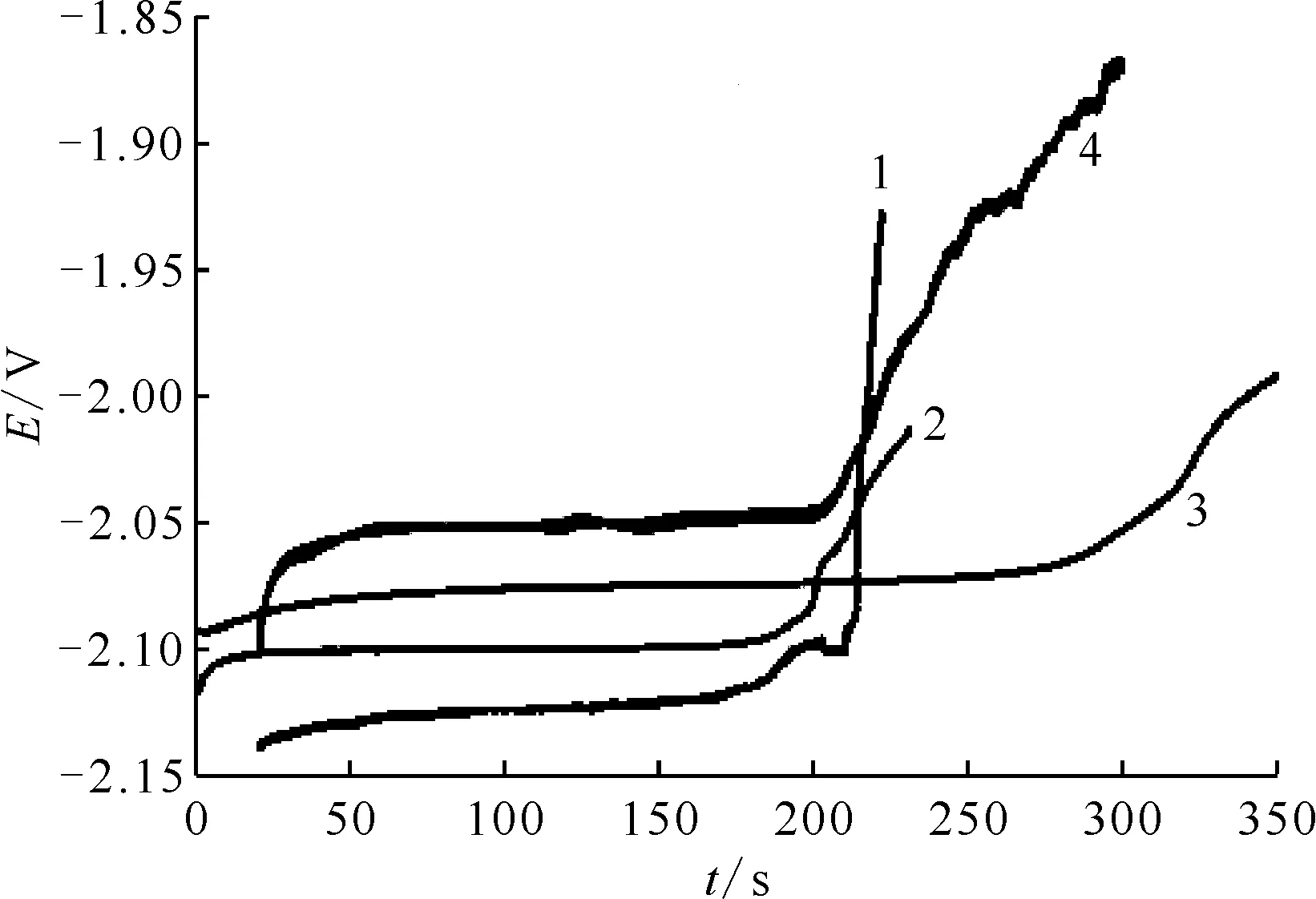
施加电流从-20 mA到-36 mA时的计时电位曲线(CP)示于图7。由图7可知,随着施加电流时间(t)的延长,电位在-2.50~0 V出现两个平台,其中-2.50 V左右的平台为金属Li生成过程;-2.10 V左右出现的平台为Ce(Ⅲ)还原为Ce的过程,与CV和SWV曲线一致。
S=0.64 cm2,c(Ce(Ⅲ))=6.49×10-5 mol/cm3,T=751 K电流,mA:1——-20,2——-25,3——-27,4——-32,5——-36
CP曲线中的转移时间(τ)与施加电流(I)之间的关系可由Sand方程(式(7))表示[14-15]。
(7)
Ce(Ⅲ)的扩散系数D可由上式中I-1对τ1/2作图(图8)中的斜率计算,以CP法计算得到的扩散系数值列入表1。

图8 LiCl-KCl-CeCl3计时电位曲线中τ1/2与1/I的关系
对于溶-不溶可逆过程,Ce(Ⅲ)/Ce的表观还原电位可由式(8)计算[11-13]。
E⊖,*(Ce(Ⅲ)/Ce)=
(8)
以E对ln[1-(t/τ)1/2]作图,得到图9,由曲线的截距可得到E⊖,*(Ce(Ⅲ)/Ce)。

图9 LiCl-KCl-CeCl3于Mo电极上的计时电位曲线中电位(E)与ln[1-(t/τ)1/2]的关系
(5) 扩散系数
采用CV法和CP法计算得到Ce(Ⅲ)在LiCl-KCl熔盐体系中的扩散系数,结果列入表1。由表1可知,随着温度的升高,扩散系数也相应的增大,表明升高温度,有利于Ce(Ⅲ)的还原及沉积。其中CV法和CP法计算得到的扩散系数与温度的关系式分别如式(9)、(10)。
lnD=-4 341.5/T-7.97
(9)
lnD=-4 346.6/T-7.39
(10)
Iizuka[15]和Marsden等[16]采用CV法分别测得在673~823 K和653~973 K时Ce(Ⅲ)在LiCl-KCl熔盐中的扩散系数与温度的关系式如式(11)、(12)。
lnD=-3 845/T-6.194
(11)
lnD=-4 494/T-5.595
(12)
由式(11)计算得到673、723、773 K时的扩散系数分别为6.74×10-6、1.00×10-5、1.41×10-5cm2/s。由式(12)计算得到673、723、773 K时的扩散系数分别为4.67×10-6、7.42×10-6、1.11×10-5cm2/s。以上结果表明随着温度的升高,CeCl3的扩散系数增大,由于测试方法和实验的误差,使得在相同温度下得到的扩散系数相差较大,但均在同一数量级。由式(9)和式(10)计算得到的扩散活化能分别为36.09 kJ/mol和36.13 kJ/mol,与Iizuka[15]和Marsden等[16]计算得到的活化能值(31.97 kJ/mol和37.37 kJ/mol)相近。
(6) 表观还原电位
由CV法、CP法和OCP法计算得到的Ce(Ⅲ)/Ce的表观还原电位列入表2。由表2可知,采用三种方法计算得到的还原电位相差较小。表观还原电位(E⊖,*(Ce(Ⅲ)/Ce))平均值与温度的关系式为式(13)。
E⊖,*(Ce(Ⅲ)/Ce)=0.000 72T-3.650
(13)
本工作与Marsden等[16]、Castrillejo等[17]和Fusselman等[18]的结果相近(表3)。同时可以看到,随着温度的升高,表观还原电位的绝对值逐渐减小。

表3 LiCl-KCl熔盐中CeCl3的E⊖,*(Ce(Ⅲ)/Ce)值的对比
2.2 NaCl-KCl熔盐体系的电化学行为
NaCl-KCl体系中Mo电极上Ce(Ⅲ)的循环伏安曲线示于图10。由图10可知:两对氧化还原峰,B和B’分别为基体盐中金属的还原峰和氧化峰,A和A’分别为Ce(Ⅲ)的还原峰和Ce金属的氧化峰。Ce的还原峰电位约为-2.10 V,氧化峰电位约为-1.75 V。与图2中751 K条件下测得的氧化还原峰相比,右移非常明显,并且可以看到Ce的峰与基体盐的峰并未完全分开,说明在此温度和体系下进行电解,金属Ce和金属Na很可能会同时析出。
1 053 K时NaCl-KCl熔盐体系中加入CeCl3,在Mo电极上得到的循环伏安曲线示于图11。图11记录了与图2趋势一致的一系列循环伏安曲线,即金属Ce的沉积和溶解。与图10相比,图11中Ce(Ⅲ)的还原峰并不明显,但有明显的氧化峰,说明此过程确实存在Ce的氧化还原,但由于Ce和基体盐的氧化还原电位较接近,同时伴随着Na、K和Ce的析出,使得还原峰无法分离。生成的金属Na、K在高温下观察不到氧化峰,因此图11中的氧化峰为Ce的氧化峰。

T=973 K,ν=50 mV/s,S=0.63 cm2,c(Ce(Ⅲ))=1.13×10-4 mol/cm3

T=1 053 K,S=0.32 cm2,c(Ce(Ⅲ))=2.75×10-4 mol/cm3
不同温度和不同CeCl3含量条件下得到的循环伏安曲线示于图12。由图12可知:曲线1和2,因还原峰电位不明显,对氧化峰电位进行比较,1 103 K时的氧化峰电位较1 053 K时向右偏移;对比曲线2和3可明显看出,增加CeCl3浓度,氧化峰电位明显右移(右移约0.06 V),这一趋势与Nernst方程计算得出的趋势一致。这说明升高温度和增加CeCl3浓度均会使峰电位向右偏移,在电解条件下金属Ce更易析出。为有效降低基体盐的电解,应在高目标离子浓度下进行工艺实验,提高电流效率。

ν=50 mV/s,S=0.32 cm2
2.3 KCl熔盐体系的电化学行为
2.3.1NaCl-KCl体系与KCl体系的对比 因Na(Ⅰ)与Ce(Ⅲ)的还原电位接近,电解过程中Na更易析出,因此考虑采用KCl体系减少基体盐的析出。图13为NaCl-KCl体系和KCl体系的循环伏安对比图,可以看到,单纯的KCl体系具有更负的还原电位,在相同的电解条件下可以降低基体盐的电解。

T=1 123 K,ν=50 mV/s,S=0.32 cm2
2.3.2KCl熔盐体系的循环伏安曲线 1 123 K下在KCl熔盐体系中分别进行-1.8~0 V、-1.9~0 V和-2.0~0 V的循环伏安扫描,结果示于图14。由图14可知,在-1.8~0 V扫描过程中出现了Ce的还原峰和氧化峰,表明Ce(Ⅲ)在-1.8 V时即开始电解析出。随着扫描范围的增大,还原峰电流和氧化峰电流不断增大。对比图14(a)和(b)可见,随着Ce(Ⅲ)浓度增大,电流增大且峰位置向右偏移。

T=1 123 K,v=50 mV/s,S=0.32 cm2 c(Ce(Ⅲ)),mol/cm3:(a)——2.58×10-4,(b)——5.16×10-4
3 结 论
以Mo为工作电极,Ag/AgCl为参比电极,通过多种电化学测量手段,研究了Ce(Ⅲ)在LiCl-KCl、NaCl-KCl和KCl熔盐体系中的电化学行为,得出如下结论。
(1) LiCl-KCl熔盐体系中Ce(Ⅲ)在Mo电极上的反应为得失三个电子的一步还原反应,采用CV法和CP法计算得到扩散系数与温度的关系式分别为:lnD=-4 341.5/T-7.97和lnD=-4 346.6/T-7.39;表观还原电位与温度的关系式为E⊖,*(Ce(Ⅲ)/Ce)=0.000 72T-3.650。
(2) 高温条件下,基体盐大量存在时,Na(Ⅰ)和Ce(Ⅲ)的还原电位较接近,并且随着温度的升高,Ce(Ⅲ)的还原峰逐渐被掩盖。温度由751 K升至1 123 K过程中,Ce/Ce(Ⅲ)的氧化还原峰由-2.18 V右移至-1.8 V左右。在1 103 K条件下,Ce(Ⅲ)浓度增大一倍(2.75×10-4mol/cm3和4.32×10-4mol/cm3),氧化峰电位右移约0.06 V。为提高电流效率,可采用较高的目标离子浓度进行电解,及时补充电解质。
(3) 高温条件下,采用KCl熔盐体系可以减少基体盐的电解析出。

