CuCoAl催化剂中各金属在合成气制备低碳醇反应中的作用
张文文,栾春晖,黄 伟
(1. 太原理工大学 省部共建煤基能源清洁高效利用国家重点实验室,山西 太原 030024;2. 太原理工大学 化学化工学院,山西 太原 030024)
近年来,由于石油资源急剧减少和能源消耗逐渐增加,环境污染及能源短缺问题日益严重,新型清洁燃料及燃料添加剂的开发也成为全球科研人员关注的重点[1]。 由天然气、煤以及生物质资源经合成气(CO+H2)转化为高级醇等液体燃料以及其他高附加值的化学品成为实现含碳资源高效洁净转化的最有前途的方法之一[2,3]。
CuCo基催化剂是低碳醇合成研究中最常用的催化剂之一,至今已有数十年的研究历史,但其活性位结构、表面酸碱性、活性金属价态、各活性金属作用等与制备方法、助剂引入等的密切关联尚没有被完全厘清。 烃产率较高、醇选择性较低、产物碳数分布均一等问题一直未得到很好地解决[4-6]。 Xu等[5]认为,CuCo催化剂是一个CuCo协同作用的双功能活性中心体系,其中Cu有利于非解离吸附的CO加氢,将CO插入金属和CH2*之间,Co有利于解离吸附的CO加氢,促进碳链增长。 但在反应过程中,由于烷烃、H2O和CO2等副产物的产生,会导致醇的选择性较低[6]。Wang等[7]采用浸渍法制备了负载型CuCo基催化剂, 探究了SiO2、Al2O3等载体对CuCo基催化剂的影响,结果表明,以Al2O3为载体时,有利于形成Cu-Co双金属混合物种,催化性能明显地优于其他载体。Cao等[8]采用碱性共沉淀的方法制备了不同n(Cu)/n(Co)的(CuxCoy)2Al-LDHs 催化剂,其中n(Cu)/n(Co) = 0.5时,催化性能最佳,CO转化率高达51.8%,醇的选择性为45.8%。 该催化剂的催化性能明显好于传统的Cu-Co基催化剂。 在本课题组的前期研究中,杨展董等[9]将CuCoCe担载到氮掺杂的碳纳米管上,研究结果表明氮掺杂可以降低催化剂表面酸中心的强度和数量,抑制长链烃的生成,提高醇的选择性;王梦星等[10]探究了催化剂共沉淀过程中沉淀pH对CuCoAl-LDHs催化剂CO加氢反应性能的影响,结果表明,沉淀pH会对催化剂的酸碱性产生一定程度的影响,且催化剂的强碱中心和弱酸中心的数量是影响CuCoAl-LDHs催化剂性能众多因素中最重要的因素,强碱中心的数量越多,弱酸中心数量越少,则乙醇在总醇中占比越高。
本文在已有工作基础上,通过制备CuCo、CuAl、CoAl双组份LDHs型催化剂, 并与CuCoAl三组分催化剂比较,同时运用XRD、H2-TPR、N2吸/脱附、NH3-TPD等表征手段结合催化剂性能实验结果关联催化剂的构效关系,以探究该类型催化剂各组分在反应中的催化作用。
1 实验部分
1.1 实验试剂
Al(NO3)3·9H2O、Cu(NO3)2·3H2O、Co(NO3)2·6H2O、Na2CO3、NaOH,AR,天津科密欧化学试剂有限公司;石英砂,AR,天津市化学试剂三厂。
1.2 催化剂的制备
采用碱性共沉淀法制备了一系列CuxCoyAlz(x:y:z=3:0:1,0:3:1,1:2:0,1:2:1)层状双金属氢氧化物(LDHs)催化剂前驱体。 制备过程具体如下:将Al(NO3)3·9H2O、Cu(NO3)2·3H2O、Co(NO3)2·6H2O溶解在适量去离子水中(c(Cu2+) + c(Co2+) + c(Al3+) = 1.0 mol/L)配成金属盐溶液,同时按照c(CO32-) = 2c(Al3+)、c(NaOH)=1.5 mol/L配置碱溶液(不含Al3+的催化剂只用NaOH配置碱溶液); 随后通过蠕动泵将配置好的金属盐溶液、 碱溶液加入有少量蒸馏水的烧杯中快速搅拌,控制水浴温度为60 °C、溶液pH值恒定为9进行沉淀,沉淀结束后继续搅拌30 min。将所得的溶液于80°C老化10 h然后抽滤,用去离子水洗涤至中性后置于80°C下干燥12 h得催化剂前驱体。 将催化剂前驱体在马弗炉中300°C焙烧5 h(升温速率为2°C/min)制得所需催化剂。 最后经压片、破碎、过筛至40~60目待用。制得的催化剂记为CuxCoyAlz,各组分的投料比与实测比如表1所示。 可知,投料比与实测比偏差均在可接受范围内,符合制备LDHs纯相所需的2价和3价金属离子比例要求。

表1 催化剂各元素投料理论比与实测比Table 1 Theoretical and measured ratio of each element of catalysts
1.3 催化剂的表征
催化剂的晶相分析在日本理学公司的DX-2700型X-ray衍射仪上进行。 Cu Kα射线为辐射源,管电流为100 mA,电压为40 kV,扫描范围2θ=5°~ 85°,扫描速率为8 (°)/min。 H2-TPR程序升温还原表征在天津先权工贸发展有限公司的TP-5000型化学吸附仪上进行:样品装填量为50 mg,首先在He气气氛中150°C下吹扫30 min,然后降温至50 °C,切换至5%H2/N2吹扫30 min,保持10 °C /min的升温速率升温至900 °C,采用TCD检测器检测耗氢量。 催化剂酸碱强度及酸碱位点数由天津先权工贸发展有限公司的TP-5080型化学吸附仪进行分析: 样品装填量为100 mg,首先在He气气氛下升温至400 °C, 切换5%H2/N2还原30 min,然后切换He气吹扫降温至50 °C后分别吸附NH3、CO2,最后切换为He气吹扫50 min,以10 °C/min的升温速率升温至800 °C, 采用TCD检测器检测尾气。 催化剂的织构性质测定在美国康塔公司生产的Quanta Chrome QDS-30型物理吸附仪上进行: 取待测样品150 mg,首先在200 °C下预处理4 h,然后使用液氮降温至-196 °C进行吸/脱附实验,采用BJH模型分析孔容和孔径, 采用BET方程计算催化剂的比表面积。 催化剂表面的元素分布使用Quanta 400FEG型的场发射电子显微镜的EDS模块进行分析。
1.4 催化剂的评价
1.4.1 催化剂的活性评价
采用固定床反应器对催化剂进行活性评价。 将0.8 g 40~60目的催化剂用相同目数的石英砂稀释至3 mL后装填到反应管中,催化剂两端以石英棉填充, 反应管两端分别装填10~20目的石英砂固定催化剂床层。 先用总流速为90 mL/min的H2/N2混合气(V(H2):V(N2) = 2:1)对催化剂进行还原,以2 °C /min的升温速率升温至400 °C,常压下还原130 min。 还原后降至室温,切换成流速为150 mL/min的H2/CO合成气(V(H2):V(CO) = 2:1)评价催化剂的CO加氢性能,反应压力为3 MPa、温度为300 °C。 尾气经冷凝后气液相分离,气相产物每24 h采样分析检测三次,液相产物每满24 h收集一次。气相产物中的CH4、H2、CO、CO2等通过气相色谱TCD检测器进行分析,烷烃、甲醇、乙醇等有机物通过FID检测器进行分析,柱温均为130 °C;液相产物由FID检测器进行分析,柱温为180 °C。
1.4.2 数据处理方法
各组分的含量均采用外标法进行定量分析,CO转化率(XCO)和各产物的选择性(Si)分别按式(1)、式(2)进行计算:
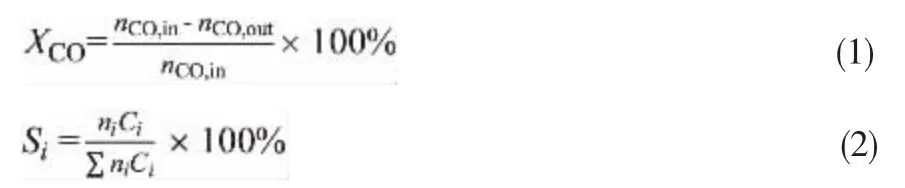
式中,nCO,in为进口气体中CO的物质的量,mol;nCO,out为出口气体中CO的物质的量,mol;ni为产物i的物质的量,mol;Ci为产物中含C化合物i对应C的化学计量数。
2 结果与讨论
2.1 活性评价
催化剂活性稳定后的评价结果、醇分布情况分别如表2、表3所示。 从产物分布来看,四种催化剂中Cu3Al催化剂总醇选择性最高,为40.87%,但C2+OH的占比较低,为5.37%,进一步观察醇产物分布可知,该催化剂的产物主要是甲醇。Co3Al催化剂有利于烃的生成,其选择性高达64.97%,但CO转化率明显优于其他催化剂。 CuCo2催化剂中,CO2和烃的选择性很高,总醇的选择性很低。 相比于其他催化剂而言,CuCo2Al催化剂具有最优的催化性能:CO的转化率较高,CO2和烃的选择性较低, 总醇选择性为35.70%,与其他三种催化剂相比显示出最高的C2+OH选择性(21.54%)。 此外,该催化剂与CuCo2催化剂相比较,可以看出Al组分可以在一定程度上降低CO2和烃的选择性。
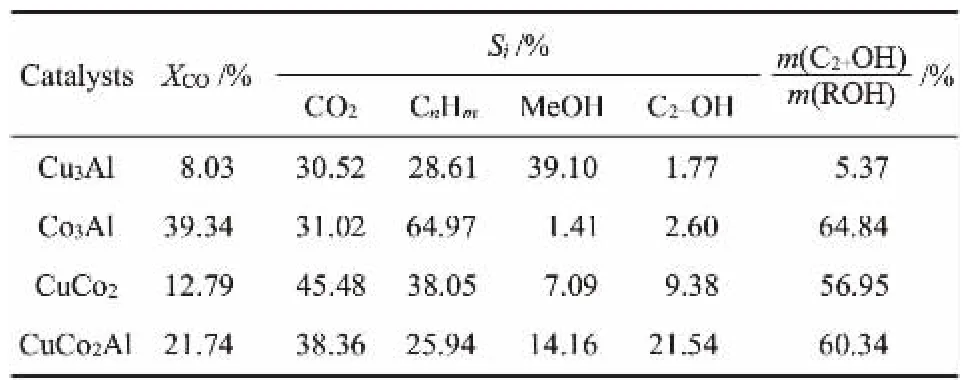
表2 催化剂的催化性能Table 2 Catalytic performance of catalysts

表3 不同催化剂作用下产物质量分布Table 3 ROH mass distribution under different catalysts
2.2 XRD表征
催化剂及其前驱体的XRD谱图如图1所示。 由图1(a)可知,Cu3Al、Co3Al、CuCo2Al催化剂前驱 体均在2θ为11.6°、23.6°、35.4°、39.8°、48.0°、59.3°、61.0°时出现特征衍射峰, 分别对应LDHs结构的(003)、(006)、(012)、(015)、(018)、(110)、(113)晶面[11]。 样品中没有检测到其他杂质相,说明样品中LDHs结构的纯度较高。 由于Cu2+的存在导致了明显的姜-泰勒效应,因此催化剂前驱体中(110)、(113)晶面对应的特征衍射峰强度相对较弱[12]。而CuCo2催化剂没有形成明显的LDHs结构, 这可能是缺乏足够的3价阳离子所致[13]。
由图1(b)可知,类水滑石结构对应的衍射峰消失,金属氧化物的衍射峰出现,说明在焙烧过程中类水滑石结构的双层金属氢氧化物转化为金属氧化物。另外,没有观察到Al2O3对应的特征衍射峰,说明Al2O3处于非晶态或高分散态,没有达到XRD可检测的聚集态。 Cu3Al催化剂在2θ为35.5°、38.9°出现衍射峰归属于CuO相,且该衍射峰峰形较宽,说明CuO晶粒的尺寸较小;Co3Al催化剂在2θ为31.3°、36.8°出现明显的衍射峰,可归属于Co3O4尖晶石相;CuCo2催化剂出现了CuO相和Co3O4尖晶石相的特征衍射峰;CuCo2Al催化剂焙烧后出现了Cu-Co尖晶石相和/或Co3O4相的特征衍射峰。 已有研究报道表明将Cu-Co负载到Al2O3上, 经过焙烧后在表面形成Cu-Co尖晶石物种, 其还原后形成的Cu-Co金属簇活性中心有利于生成较多的低碳醇[14]。 但是根据XRD很难区分Co3O4相和Cu-Co尖晶石相, 因为两者的XRD特征衍射峰重叠。CuCo2催化剂中几乎看不到CuO相对应的特征衍射峰,这一方面归结为Cu和Co在煅烧过程中结合形成了Cu0.9Co2.08O4尖晶石结构, 另一方面是残余CuO相处于高度分散不具XRD可探测的聚集态。鉴于Cu与Co投料的物质的量比为0.5,与Cu0.9Co2.08O4中Cu、Co的化学计量相差不大, 推断Cu应该主要以Cu0.9Co2.08O4的形式存在。 这与XRD表征结果一致,也与文献[11]报道一致。由此并结合CuCo2Al催化剂XRD表征结果可以推测,CuCo2Al催化剂中Cu和Co主要以Cu0.9Co2.08O4的形式存在, 少部分以CuO或Co3O4的形式存在。
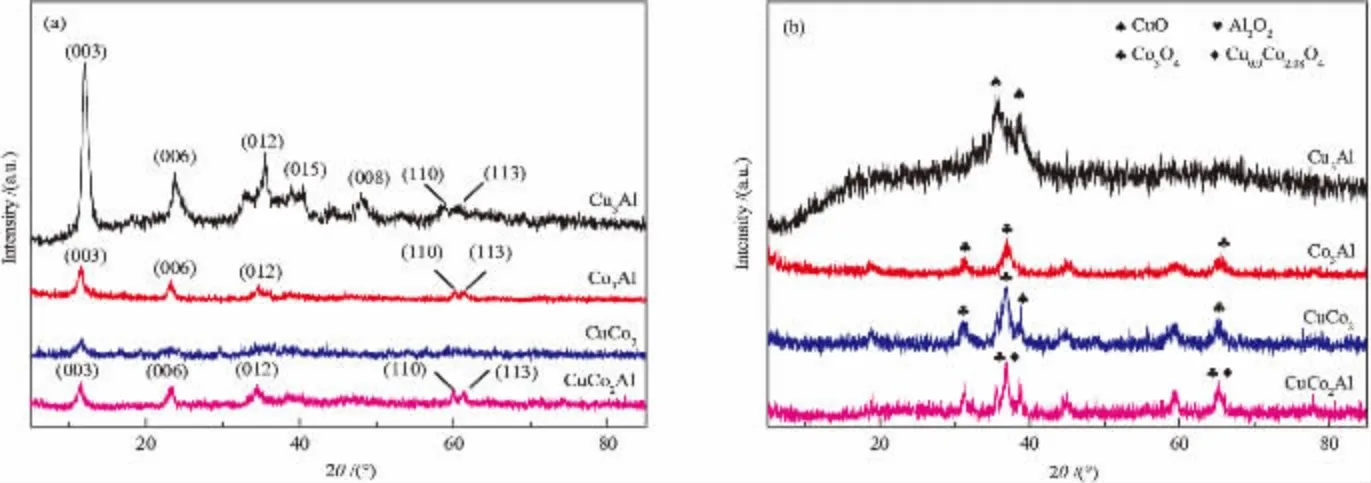
图1 各前驱体(a)及催化剂(b)的XRD谱图Fig. 1 XRD patterns of (a) precursors and (b) catalysts
2.3 H2-TPR表征
催化剂的H2-TPR谱如图2所示。 可知,所有催化剂都存在两个还原峰。 Cu3Al催化剂的低温还原峰(218 °C) 归属于高度分散CuO还原, 高温还原峰(288 °C)归属于CuO体相还原或CuO与载体之间的强相互作用。Khodakov等[15]指出,对于金属氧化物与载体之间的相互作用,颗粒越小,相互作用越强,因此较小尺寸的金属氧化物就越难被还原。对于Co3Al催化剂, 在279 °C和634 °C的两个还原峰峰值的H2消耗比接近1:3, 分别归属于Co3O4被还原为CoO和CoO被还原为金属钴; 这一结果也说明钴的存在形式主要为Co3O4,与XRD分析结果一致。CuCo2催化剂的低温峰归属于CuO的还原,高温峰归属于Co3O4和部分CuO的还原,CuCo2催化剂与Cu3Al催化剂相比,CuO的还原峰向低温方向偏移,表明Co的加入可以促进Cu物种的还原[16,17]。 CuCo2Al催化剂中,XRD结果表明,催化剂主要相为Cu0.9Co2.08O4,高温峰是由于Cu0.9Co2.08O4还原为金属铜和金属钴。由于Cu0.9Co2.08O4还原形成的CuCo2双金属可以促进铜离子的还原,导致CuO还原温度降低, 所以在260 °C的还原峰中可能包含CuO的还原峰。 由CuCo2Al催化剂和Co3Al催化剂比较可知,Cu的加入使得高温还原峰还原温度降低,进一步证明了CuCo2Al催化剂中形成了容易还原的Cu0.9Co2.08O4物种。
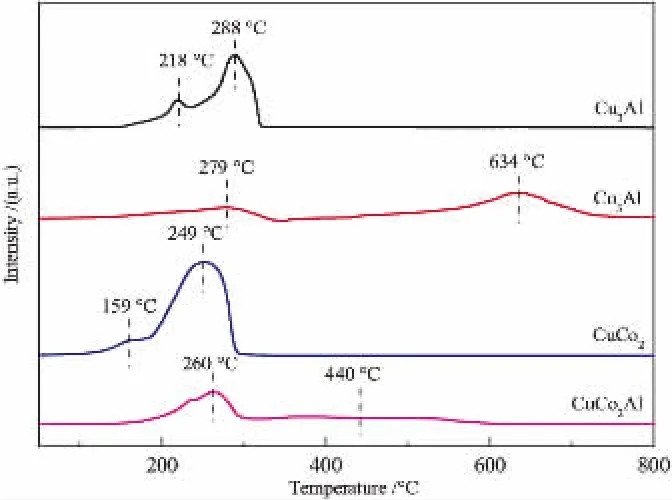
图2 各催化剂的H2-TPR谱图Fig. 2 H2-TPR profiles of catalysts
2.4 NH3/CO2-TPD-MS表征
前期研究发现,酸、碱中心的数量是影响CuCo2Al催化剂催化性能众多因素(孔容、孔径、比表面积等)中最重要的因素,强碱中心数量越多,弱酸数量越少,乙醇在总醇中占的比例越高[14]。而催化剂酸中心的强度和数量影响着C2+OH生成过程中的链增长(C-O键断裂),碱中心的强度和数量影响着C2+OH生成过程中的含氧化(CO插入表面碳物种),进而影响低碳醇的合成[18-21]。 各催化剂的NH3/CO2-TPD-MS测试结果如图3所示。 由图3(a)可知,Cu3Al和Co3Al、CuCo2Al催化剂分别在157 °C、183 °C、183 °C附近存在着NH3的脱附峰,说明催化剂中含有弱酸性位。其中,Cu3Al、Co3Al催化剂弱酸性位数量较多,CuCo2Al催化剂中弱酸性位数量较少,这是由于该催化剂中Al的含量低于前两者所致。CuCo2催化剂基本没有弱酸中心,说明酸中心主要来源于Al。 由图3(b)可知,Cu3Al、Co3Al、CuCo2、CuCo2Al催化剂分别在112 °C、129 °C、164 °C、112 °C位置存在CO2的脱附峰,归属于催化剂的弱碱中心。 CuCo2Al、Co3Al、CuCo2催化剂分别在580 °C、722 °C、640 °C位置存在着CO2的脱附峰,归属于催化剂的强碱性位。 CuCo2Al催化剂弱碱中心位和强碱中心位数量最多,但碱强度相对较弱。Luk等[22]认为,催化剂碱性位点存在时,可以促进醇的生成,抑制烃的生成。 结合催化剂活性评价结果可知, 催化剂的弱酸位点和强碱位点同时存在时,催化剂的催化性能最好。

图3 各催化剂的NH3-TPD-MS (a)和CO2-TPD-MS (b)谱图Fig. 3 (a) NH3-TPD-MS and (b) CO2-TPD-MS spectra of catalysts
2.5 N2物理吸/脱附表征
催化剂的吸/脱附曲线和孔径分布如图4所示, 织构性质参数如表4所示。

图4 各催化剂的N2吸/脱附曲线(a)和孔径分布(b)Fig. 4 (a) N2 adsorption/desorption isotherms and (b) pore size distribution curves of catalysts
由图4(a)可知,各催化剂吸/脱附曲线均为IV型等温线,具有H3型迟滞环。进一步结合孔径分布(图4(b))及织构性质参数(表4)分析可知,催化剂的主要孔结构均为平行板聚集的狭缝介孔。此外由表4还可知,Co3Al催化剂的比表面积最大,Cu3Al催化剂的比表面积最小。 通过对比可以推测,Co的加入能够增大催化剂的比表面积,其原因可能与存在的物相有关。结合催化剂活性评价结果可知,较大的比表面积更利于低碳醇的形成,这说明适量Co的加入可以通过增加催化剂的比表面积进而促进低碳醇的形成。
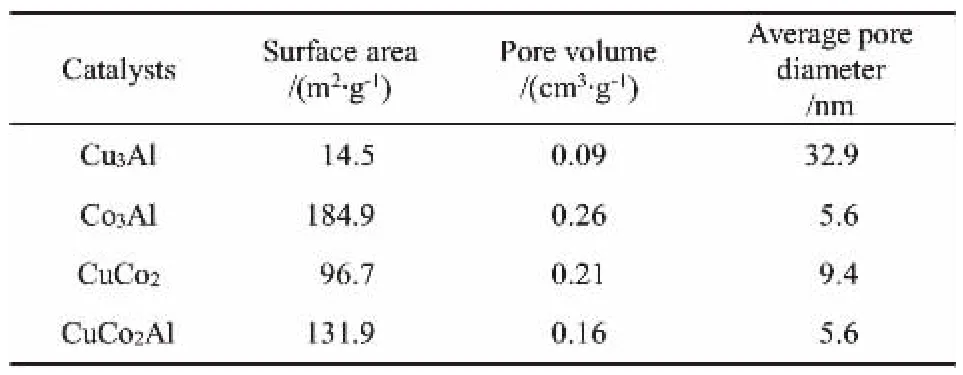
表4 各催化剂的织构性质Table 4 Textural properties of catalysts
2.6 SEM-EDS-Mapping表征
催化剂的SEM-EDS-Mapping分析结果如图5所示。图5(a)为CuCo2Al催化剂的分析结果图,其中红色的点代表Cu元素,蓝色的点代表Co元素,绿色的点代表Al元素,三种颜色的点均匀分布,表明CuCo2Al催化剂中Cu、Co、Al元素分布均一。 图5(b)中红色的点代表Cu元素,绿色的点代表Co元素,在视野范围内红色点和绿色的点在左上角分布的较为密集,其余部分分布较为稀疏, 推测CuCo2催化剂中Cu颗粒和Co颗粒发生了一定的团聚。 通过图5(a)和图5(b)的对比, 可见Al的作用是使得催化剂中Cu、Co元素的分散更加均匀。

图5 催化剂样品CuCo2Al(a)和CuCo2(b)的SEM-EDSMapping图Fig. 5 SEM-EDS-Mapping images of (a) CuCo2Al and (b)CuCo2 catalyst samples
3 结论
本文主要通过碱性共沉淀法制备了一系列CuxCoyAlz(x:y:z = 3:0:1,0:3:1,1:2:0,1:2:1)催化剂,并用于合成气制低碳醇,主要结论如下。
(1)四种催化剂中,Cu3Al总醇选择性最高,但醇产品主要为甲醇,甲醇选择性大于94%;Co3Al的烃选择性最高,为64.97%,醇选择性很低,不到5%,但醇分布中C2+OH最高,达64.84%;CuCo2Al催化剂的催化性能最好,CO 转化率为21.74%, 醇的选择性为35.70%,C2+OH含量较高,占总醇的60.34%;CuCo2催化剂各项指标居中。其中CuCoAl催化合成低碳醇遵循表面碳物种插入机理。
(2)结合表征结果可知,除Cu、Co已认知的作用外 (即Cu的作用是非解离分子态CO插入和选择性加氢,Co的作用是CO解离吸附生成表面碳物种并聚合实现链增长),Al的引入可以提高Cu、Co的分散性;Co的加入还能增加催化剂比表面积, 同时引入了较多更强的碱性位, 提高了Co3Al和CuCo2催化剂的C2+OH选择性,并与Al共存产生大量对C2+OH生成至关重要的强碱性位,使得CuCo2Al催化剂C2+OH生成性能最优。

