基于实时荧光PCR技术的羊乳掺伪检测分析
尹丹韩,肖舒珺,杜黎丹,方陈玉,肖海龙
(1.杭州市食品药品检验研究院,杭州 310022;2.浙江科技学院 生物与化学工程学院,杭州 310023)
羊乳富含200多种营养素和生物活性物质,是世界公认最接近人乳的乳品,其营养成分全面,且易于被人体吸收[1-3]。在古代,中医对羊乳有很高的评价,据《本草纲目》记载,羊乳性甘温,能补寒冷虚乏、润心肺、治消瘦、疗虚劳、益精气、和小肠气、利大肠、医小儿惊厥[4];在现代,许多研究也证明羊乳具有极高的营养价值,在国际营养学界被誉为“乳中之王”,因此越来越多的消费者倾向于选择羊乳制品来代替牛乳。羊乳的成分比例与人乳接近,羊乳中最主要的蛋白质酪蛋白颗粒及脂肪球比牛乳小,更利于人体吸收。由于羊乳的消费量不断上涨,但其产量相对较少,并随季节波动较大,导致市场上供不应求,价格远高于牛乳。为了谋求暴利,一些厂家在羊乳制品中掺入牛乳对外销售,而羊乳消费的主力军是婴儿和老人或是一些牛乳过敏者,若食用了掺假羊乳,会对消费者造成经济与身体健康的双重损害。目前中国关于乳与乳制品的研究主要在安全性指标、标签、膳食营养方面[5-7],乳与乳制品中成分掺假的检测技术很少涉及。因此,找到一种能较准确地检测羊乳中牛源性成分掺假情况的分析方法十分重要。目前应用于乳品掺假的检验方法主要有色谱法[8-9]、毛细管电泳法[10]、分子生物技术[11]、酶联免疫[12]和近红外光谱法[13-14]等,其中实时荧光聚合酶链式反应(real-time fluorescent polymerase chain reaction,实时荧光PCR),因其低耗时、强特异性、高灵敏度及高通量的优势,广泛应用于乳制品掺假掺杂检测中[15-16]。近年来陆续出现利用实时荧光PCR技术定量检测动植物源性成分的研究[17-18],但研究对象主要集中于肉制品,对乳制品很少涉及。同时,仍存在一些有待研究的问题,如复杂样品的DNA提取、混合样品的检出限和定量曲线的适用性等。本研究在牛源性成分检测方法的基础上,针对乳制品特殊性探索样品前处理方法,构建羊乳制品中牛源性成分检测体系,并对检测体系的定量检测潜力进行初步探索;同时收集70批次市售羊乳制品,对羊乳进行牛源性成分鉴定,欲为鉴别羊乳真假提供参考。
1 材料与方法
1.1 材 料
1.1.1 样品采集
目前市场上销售的羊乳制品主要以液态羊乳和羊乳粉为主,因此我们此次收集的样品为这两类产品。共收集市售羊乳样品70批次,其中42批次为羊乳粉,28批次为液态羊乳。所有样品包装完整,有食品标签。样品收集后,固态乳粉和常温液态乳置于干燥常温环境中保存,鲜乳置于0~5 ℃冰箱冷藏保存。鲜羊乳及鲜牛乳均购于本地乳品企业。
1.1.2 试 剂
血液/细胞/组织基因组DNA提取试剂盒,北京天根生化科技有限公司;2倍浓度荧光PCR预混液,生工生物工程(上海)股份有限公司;引物,生工生物工程(上海)股份有限公司;磷酸盐缓冲盐溶液(phosphate buffered saline,PBS),生工生物工程(上海)股份有限公司。
1.2 仪器与设备
ViiA7实时荧光定量PCR仪,美国应用生物系统公司;X-30R超速冷冻离心机,美国贝克曼库尔特公司;MK-10干式恒温器,杭州奥盛仪器有限公司;超微量紫外分光光度计,赛默飞世尔科技。
1.3 试验方法
1.3.1 DNA提取及浓度检测
液态乳提取步骤如下:取10 mL液态乳制品样品,4 ℃条件下5 000×g离心10 min后,弃上清及上层脂肪层,将离心产物中加入1 mL PBS后涡旋数秒混匀;4 ℃条件下13 000×g离心5 min,弃上清及上层脂肪层,留下沉淀,后续步骤按照血液/细胞/组织基因组DNA提取试剂盒说明书进行DNA提取,并对提取的DNA进行质量浓度和纯度的检测。
固态乳提取步骤如下:直接取样品2 g至离心管,加入10 mL PBS后涡旋数秒混匀;4 ℃条件下5 000×g离心10 min后,弃上清及上层脂肪层,将离心产物中加入1 mL PBS后涡旋数秒混匀;4 ℃条件下13 000×g离心5 min,弃上清及上层脂肪层,留下沉淀,后续步骤按照血液/细胞/组织基因组DNA提取试剂盒说明书进行DNA提取,并对提取的DNA进行质量浓度和纯度的检测。
1.3.2 实时荧光PCR反应体系
测定用引物和探针序列见表1。本试验所用引物和探针均由生工生物工程(上海)股份有限公司合成。
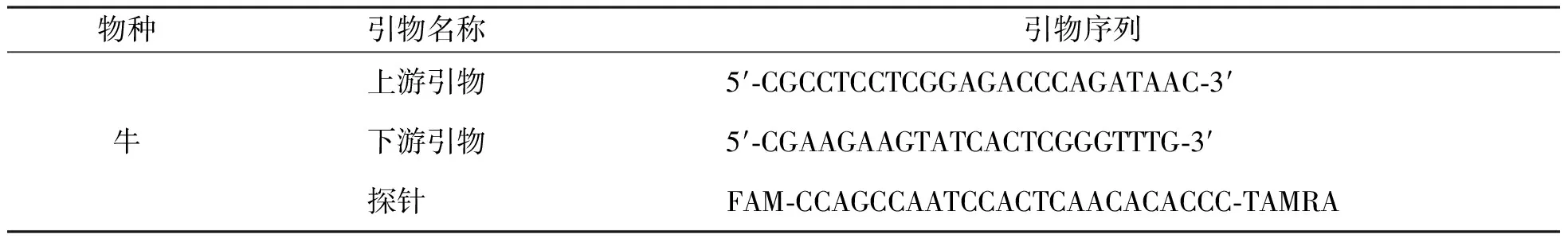
表1 引物和探针序列Table 1 Primer and probe sequences
反应体系(25 μL)如下:2倍浓度荧光PCR预混液12.5 μL、上下引物各1 μL(10 μmol/L)、探针1 μL(10 μmol/L)、样品DNA 1 μL、无菌双蒸水8.5 μL,同时做阴性和阳性对照反应体系,即分别用1 μL无菌双蒸水和1 μL阳性DNA代替1 μL样品DNA。
牛源性成分反应条件如下:95 ℃预变性10 s;95 ℃变性5 s,60 ℃退火延伸30 s,40个循环每循环退火时收集荧光信号。
1.3.3 方法验证
用特异性引物及探针分别对牛乳、羊乳及其他植物蛋白饮料(豆、核桃、花生)的DNA及水(空白对照)进行扩增,以检测方法的特异性。反应循环阈值(cycle threshold,CT值)小于35的判定为检出牛源性成分。DNA提取并定量后,用无菌双蒸水将目标DNA进行梯度稀释,共7个梯度,即每个反应添加1 μL稀释度分别为100、10-1、10-2、10-3、10-4、10-5、10-6的DNA模板。以不同质量浓度的DNA为模板进行实时荧光PCR反应,确定本方法对单一模板的检出限。每个质量浓度重复检测3次,通过标准差(standard deviation,SD)和相对标准差(relative standard deviation,RSD)来确定本方法的可重复性。使用已测得仅含羊源性成分的纯羊乳,仅含牛源性成分的纯牛乳,按照体积比例,分别配比出牛乳体积分数为100%、80%、50%、10%、1%、0.5%、0.1%、0.05%、0.01%、0.005%的混合样品。分别提取混合样品的DNA,对其进行实时荧光PCR扩增,确定本方法对混合模板中牛源性成分的检出限,重复3次。
1.3.4 市售羊乳样品牛、羊源性成分检测
测定样品DNA质量浓度,用特异性引物及探针扩增检测样品中牛源性成分,同时设空白对照(用无菌双蒸馏水代替模板)、阴性对照(羊乳DNA)、阳性对照。
2 结果与分析
2.1 DNA质量浓度及纯度测定
乳制品主要包含蛋白质、脂肪、糖类等物质,DNA含量相对较少,且主要物质会严重干扰DNA提取和后续PCR效率。因此在探索检测方法时,首先需要考虑优化羊乳制品DNA提取方法,以提高样本代表性同时减少其他物质的污染。研究过程中我们在通用的柱式过滤提取法的基础上,增加了羊乳制品DNA提取的前处理过程,通过多次低温离心的方式富集DNA,同时去除脂肪,减少脂肪等杂质对后续提取步骤的干扰,优化了羊乳制品的DNA提取过程,大幅增加DNA的提取效率和纯度。经过紫外分光光度计测定,样品DNA质量浓度在10.6~121.5 ng/μL,260 nm与280 nm的吸光度比值(OD260/280)在1.4~1.9之间,DNA中存在少量的蛋白质污染,基本上能满足实时荧光PCR检测的要求。通过检测发现从液体和固体样本获得的DNA在含量和纯度上无明显差别,这可能是由于乳制品在加工的过程中温度不高,有效DNA降解少,因此在后续试验中可采用一种类型样本(液态)DNA进行方法验证。在肉类及植物蛋白成分鉴定的研究中,有不少研究者对样品质量与相应物种DNA含量的比值进行了研究,获得了两者间的显著线性关系[17-18],但还未在乳制品成分鉴定中开展类似研究,因此本研究对羊乳制品质量与DNA含量的线性关系进行的初步摸索是有意义的。本研究发现从相同蛋白含量的羊乳样品提取获得的DNA量存在一定差异,相同蛋白质含量与对应DNA含量之间无显著的线性关系。这可能是由于样品基质复杂或DNA分布不均匀导致的。
2.2 特异性试验结果
用引物和探针对羊乳、牛乳、植物蛋白饮料(大豆源、花生源、核桃源)的DNA进行牛源性成分实时荧光PCR扩增试验。7个样品的牛源性成分扩增曲线如图1所示。3个牛乳样品(1个牛乳粉、2个液态牛乳)出现特异性扩增曲线,CT值分别为17.693、20.754、18.857,羊乳、豆源植物蛋白饮料、花生源植物蛋白饮料、核桃源植物蛋白饮料4个样品DNA均未出现典型扩增曲线。以上结果表明,本研究用于成分检测的引物和探针具有特异性,适用于羊乳中牛源性成分的鉴定。
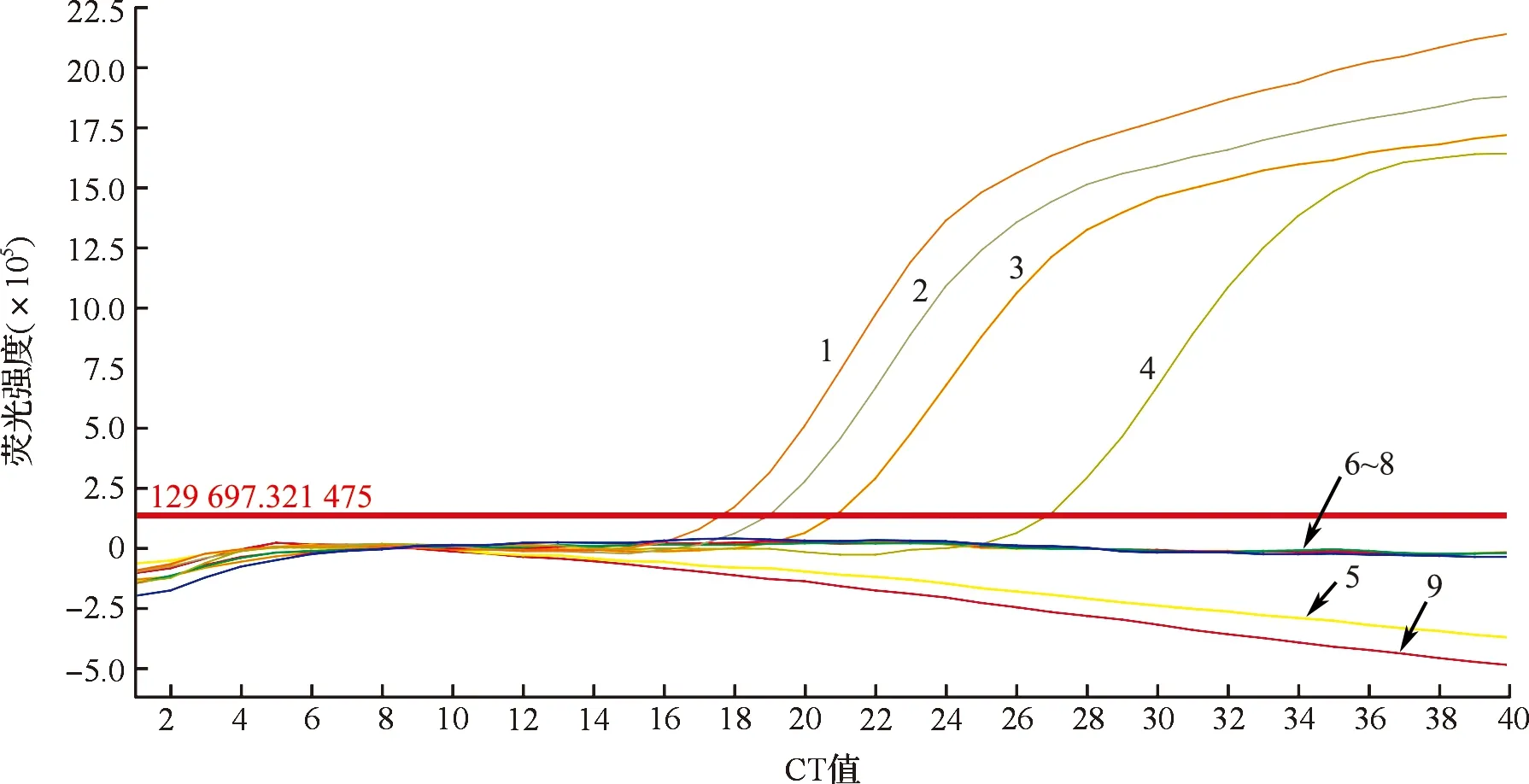
1—牛乳粉;2—液态牛乳1;3—液态牛乳2;4—阳性对照;5—液态羊乳;6—大豆植物蛋白饮料;7—花生植物蛋白饮料;8—核桃植物蛋白饮料;9—无菌双蒸水。图1 7个样品的牛源性成分扩增曲线Fig.1 Amplification curves of bovine derived materials in 7 samples
2.3 方法的检出限
单一模板的检出限试验结果如图2所示。当牛乳的DNA质量浓度稀释至0.001 ng/μL时,实时荧光PCR检测结果均有扩增曲线,CT值分别为32.167±0.019,小于35;而当样本DNA质量浓度达到0.000 1 ng/μL时,CT值均大于35。这说明本方法单一成分检出限可达0.001 ng。混合模板的检出限试验结果如图3所示。对体积分数分别为100%、80%、50%、10%、1%、0.5%、0.1%、0.05%、0.01%、0.005%的牛乳样品DNA进行实时荧光定量PCR扩增试验。如图3所示,当牛乳体积分数达到0.005%仍有扩增曲线,CT值为33.508±0.018,小于35,这说明在复杂成分的样本中使用本方法检出限可达0.005%(相当于0.001 ng/μL),复杂成分中牛源性成分的检出限与单一成分检出限基本上一致。可见,在混合样本中检测羊源性成分不对牛源性成分的检测产生干扰。
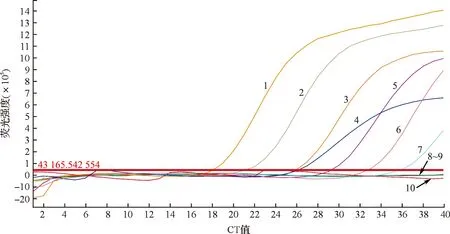
1—稀释度100;2—稀释度10-1;3—稀释度10-2;4—阳性对照;5—稀释度10-3;6—稀释度10-4;7—稀释度10-5;8—稀释度10-6;9—阴性对照;10—无菌双蒸水。图2 单一模板的检出限试验结果Fig.2 Detection limit test results of single template
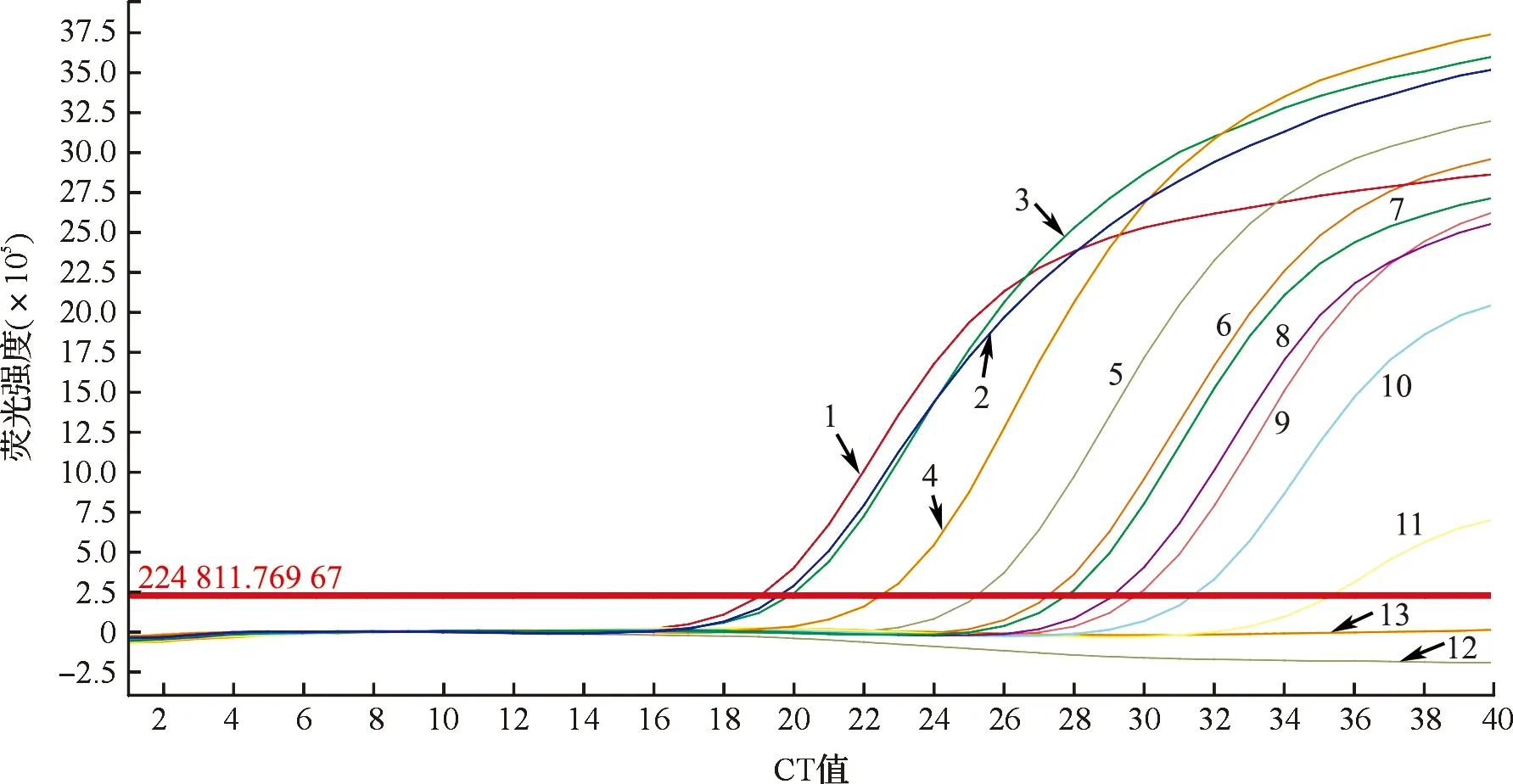
1—体积分数100%;2—体积分数80%;3—体积分数50%;4—体积分数10%;5—体积分数1%;6—体积分数0.5%;7—阳性对照;8—体积分数0.1%;9—体积分数0.05%;10—体积分数0.01%;11—体积分数0.005%;12—阴性对照;13—无菌双蒸水。图3 混合模板的检出限试验结果Fig.3 Detection limit test results of mixed templates
2.4 DNA含量与CT值之间的定量曲线
方法重复性试验结果见表2,牛源性DNA的扩增标准曲线如图4所示,x为物种DNA质量浓度的对数,y为对应平均CT值。表2显示各平行试验的相对标准差均小于5%,这表明本方法的可重复性满足要求。利用图4中的线性关系,通过检测乳品中牛源性的CT值可计算样品中牛源性DNA模板质量浓度。这表明检测方法中的引物和探针不仅可以对乳制品的牛源性进行定性检测,而且可定量检测样品中牛羊源性DNA质量浓度,有一定的定量检测能力。
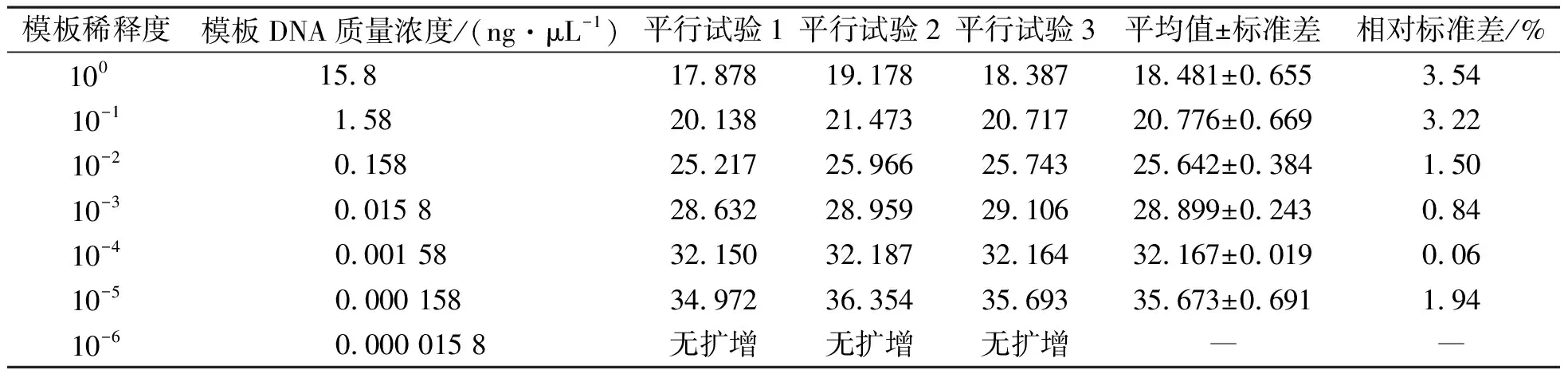
表2 方法重复性试验结果Table 2 Results of repeated test
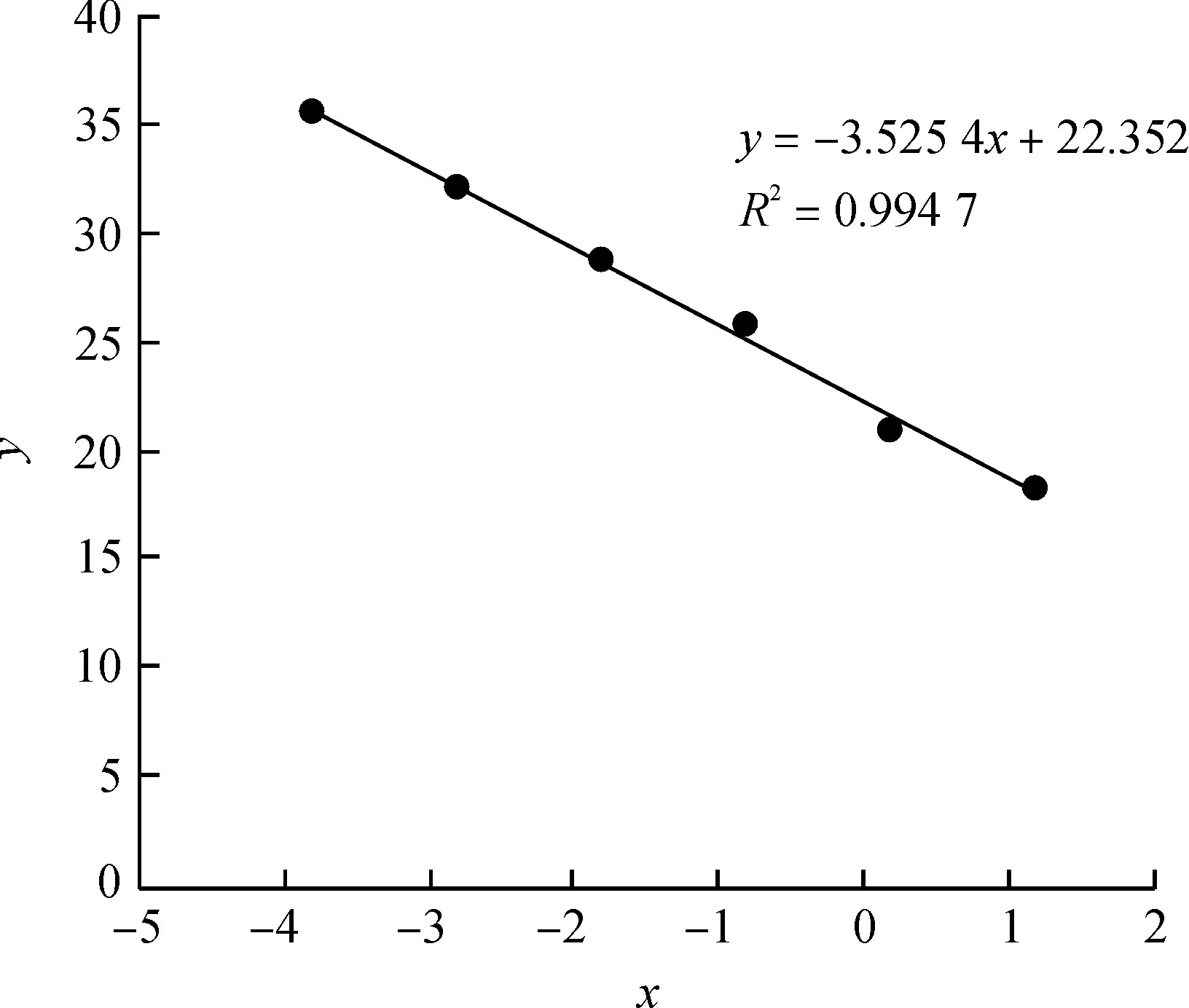
图4 牛源性DNA的扩增标准曲线Fig.4 Amplification standard curve of bovine derived DNA
2.5 市售羊乳样品牛源性成分检测结果
利用建立的实时荧光PCR方法对70批次市售羊乳样品的牛源性成分进行检测分析,取2次平均值进行计算。由于实时荧光PCR的灵敏度较高,容易出现假阳性,因此根据2.3节中检出限的结果,将CT值大于32小于35的样品归为可疑样品,进行重新取样检测。若第二次CT值小于32判定为检出;若第二次仍大于32则判定未检出。在70批次市售羊乳样品中,30批次检出牛源性成分,检出率为42.86%。检出牛源性成分的30批次样品中,有9批次配料表中标明加入了脱盐牛源乳清粉,总的问题样品率为30%。具体如下:在28批次液态羊乳样品中,有9批次检出了牛源性成分,问题样品率为32.14%;在20批次婴儿配方羊乳粉中,有9批次检出了牛源性成分,但这9批次配料表已标明含牛源性成分,问题样品率为0;在22批次成人羊乳粉中,有12批次检出牛源性成分,问题样品率为54.54%。从样品类型看,羊乳粉的检出率要高于液体羊乳,但一般婴儿配方羊乳粉生产企业相对比较规范,会在配料表中将添加的成分标识清楚,3种类型产品中成人羊乳粉的问题样品率最高。检出牛源性成分的30批次样品牛源性成分对应的CT值在20~31之间(DNA质量浓度0.002~3 ng/μL),由此可见,即使检测发现羊乳样品中牛源性DNA质量浓度较低时,也不能排除人为掺入的可能性。从对市售羊乳制品进行风险调查的总体结果中可以看出,市场上的确存在羊乳制品尤其是羊乳粉中添加牛源成分的风险,添加的成分可能为乳清粉等牛源蛋白类物质,在不同类型的产品中,成人羊乳粉的掺伪掺杂风险最高。
3 结 语
通过检测体系引物探针特异性、灵敏度及模拟混掺样品的检出限等试验,我们确定牛源性成分的检测限为0.001 ng/μL,羊乳中掺入牛乳的检测限可达到0.005 %(0.001 ng/μL),这说明建立的检测体系具有检测速度快、准确性高、特异性好、灵敏度高等优点。经市售乳制品检测验证了其可行性和适用性,可快速有效地甄别羊乳制品中掺假掺杂牛源性成分,实现基因水平的定量分析。由于缺乏合适的质量和DNA质量浓度定量模型,本研究还无法实现质量水平的定量分析,因此我们将在后续的研究中探索可以实现羊乳制品掺假成分的定量分析技术,从而为制定相关产品标准提供科学依据。

