己酸菌的筛选及发酵特性研究
晋湘宜,凌 荔,毛 豪,董孝元,常 煦,叶 凯,陈茂彬,方尚玲
(1.湖北工业大学生物工程与食品学院,湖北省酿造工艺与装备工程技术研究中心,湖北武汉 430068;2.黄鹤楼酒业有限公司,湖北武汉 430050;3.湖北安琪酵母股份有限公司,湖北宜昌 443000)
浓香型白酒作为我国四大基础香型白酒之一,广受大众欢迎,具有窖香浓郁、醇厚绵甜、丰满协调的特点[1]。研究发现,己酸乙酯为浓香型白酒的特征香气成分,己酸乙酯的含量决定其品质。浓香型白酒的发酵采用独特的泥窖发酵工艺,属于多种微生物共同发酵。生产实践证明,一般窖龄越老,产酒质量越好。研究发现,己酸乙酯主要是由栖息在窖泥中的梭状芽孢杆菌生成的己酸与酵母代谢生成的乙醇反应生成的[2]。这类梭状芽孢杆菌被统称为己酸菌,其在窖泥中的含量以及产酸能力决定了窖泥的好坏,直接影响着酒的品质。
自20 世纪60 年代起,我国逐渐开展关于窖泥己酸菌的研究。已陆续分离出许多不同的己酸菌,包括克氏梭菌、生孢梭菌、埃氏巨型球菌等。彭兵[3]从窖泥中分离出1 株产酸能力为4.36 g/L 的克氏梭菌;鲁少文[4]从窖泥中分离出利用乳酸合成己酸的瘤胃菌科己酸菌。以己酸菌为主的复合己酸菌液常被应用于人工窖泥的培养、窖池的保养,改善窖池微生物环境,提高酒质。只有不断分离出性能较好的己酸菌,并对其生长和发酵特性进行研究,才能更好地应用到白酒的生产当中。
本研究通过对优质老窖泥进行富集、筛选,对产己酸能力较高的己酸菌进行分离,通过镜检、分子生物学方法对其进行鉴定,然后在不同培养时间、培养温度、乙醇添加量情况下对菌株的生长和发酵特性进行研究,为后续菌株的应用打下基础。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 材料
窖泥:湖北某酒厂优质老窖泥。
1.1.2 培养基
乙醇乙酸钠培养基(ES)[3]:酵母膏1.0 g,无水乙酸钠0.5 g,MgSO4·7H2O 0.02 g,K2HPO40.04 g,(NH4)2SO40.05 g,蒸馏水100 mL,115 ℃灭菌20 min,然后无菌操作加入干热灭菌后的CaCO31 g,2%无水乙醇。
固体培养基需要加入2 %的琼脂,115 ℃灭菌20 min。
1.1.3 试剂
酵母膏、无水乙酸钠、无水乙醇、MgSO4·7H2O、K2HPO4、(NH4)2SO4、CaCO3、液体石蜡、氯化钠、无水硫酸铜、二氯甲烷、乙醚均为国药集团化学试剂有限公司分析纯,乙酸、丁酸、己酸为国药集团化学试剂有限公司色谱纯。厌氧产气袋,日本三菱公司。
1.1.4 仪器设备
LRH-250生化培养箱,上海智城分析仪器有限公司;HH-6数显恒温水浴锅,浙江金坛市富华仪器有限公司;LDZX-50KBS 高压蒸汽灭菌锅,上海申安医疗器械厂;2.5 L 厌氧培养袋,青岛高科技工业园海博生物技术有限公司;WFJ 2000 分光光度计,江苏海门市麒麟医用仪器厂;5977B-7890B 气相色谱质谱联用仪,美国安捷伦公司。
1.2 实验方法
1.2.1 富集培养
取若干支装有30 mL 已灭菌ES 培养基的试管(装液量为90%),各加入1 g窖泥,上层加入0.4 mL液体石蜡进行液封,置于34 ℃的培养箱内静置培养7~10 d。培养过程中每天观察产气情况,培养结束取发酵液进行己酸的定性检测。将定性结果及产气较多的试管置于水浴锅内80 ℃处理10 min,然后各取1 mL发酵液分别接种到装有30 mL ES培养基的试管内。重复富集3~4 次,将硫酸铜显色结果较好试管内的发酵液进行有机酸的定量测定[5]。
1.2.2 高产己酸菌的分离筛选
己酸菌的平板培养和斜面培养在厌氧环境下培养,厌氧条件由厌氧培养袋和厌氧产气袋提供;己酸菌液体培养采用液体深层培养,试管装液量为90%。将己酸含量较高的发酵液进行80 ℃、10 min的热处理[6]后,分别梯度稀释涂布到ES 固体平板上,然后将培养基倒置放到厌氧培养袋内,迅速放入1包厌氧产气袋,密封后放到34 ℃培养箱内进行培养。培养4~5 d 观察到平板上有菌落长出后,挑取单菌划线接种到ES 固体培养基上进行平板倒置培养5 d,待平板上菌落长出后,挑取单菌转接到ES 斜面固体培养基上进行培养。将长好的己酸菌斜面接种到装有30 mL ES 液体培养基的试管内静置培养,发酵过程中观察是否有产气,发酵7 d 检测有机酸含量。
1.2.3 己酸菌的鉴定
(1)参照试剂盒要求提取基因组;(2)PCR 扩增16S rDNA:94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸90 s,进行30 个循环,然后72 ℃保温10 min。PCR 扩增产物经1 %琼脂糖凝胶电泳分离,采用凝胶成像系统检测;(3)将PCR产物送到华大基因测序。将测序结果进行NCBIBLAST对比[7]。
1.2.4 己酸菌发酵性能测试
1.2.4.1 己酸菌生长曲线及产酸测定
将己酸菌种子液按2 %(v/v)的接种量接入到若干支装有ES 培养基的试管内,置于培养箱内静置培养。每天定时取出2 支试管使用分光光度计测定600 nm 波长下的吸光度,以未接种的ES 培养基作空白对照,同时用气相色谱-质谱联用仪测定发酵液中的有机酸。
1.2.4.2 发酵温度对己酸菌产酸的影响
将己酸菌种子液按2 %(v/v)的接种量接入到ES 培养基内分别于33 ℃、34 ℃、35 ℃、36 ℃、37 ℃、38 ℃下进行培养,发酵12 d 后测定发酵液中的产酸情况,每组做3个平行。
1.2.4.3 乙醇含量对己酸菌产酸的影响
在ES培养基中乙醇的加入量分别为1 mL/100 mL、1.5 mL/100 mL、2 mL/100 mL、2.5 mL/100 mL、3 mL/100 mL 的情况下,各自加入2%(v/v)的己酸菌种子液,34 ℃进行培养,发酵12 d 后取样检测,每组3个平行。
1.2.5 发酵液组分分析
1.2.5.1 己酸的定性测定
己酸的定性测定采用硫酸铜显色法[8]。取2 mL发酵液加入到试管内,然后加入2 mL 2%的硫酸铜溶液,混匀后加入1 mL 无水乙醚充分摇匀,静置分层。乙醚层出现蓝色说明发酵液中含有己酸,上层蓝色越深则说明己酸含量越高。
1.2.5.2 有机酸的定量测定
有机酸的测定采用液液微萃取-气质联用法。液液微萃取[9]:取200 μL 发酵液,然后加入100 μL的2 %稀硫酸将pH 值调至约为2,加入2 mL 二氯甲烷,使用涡旋振荡仪充分振荡,静置30 min 待溶液分层。将上层发酵液吸出,然后加入过量无水硫酸钠,在-80 ℃冰箱放置4 h 除去水分。然后使用0.22 μm 有机滤膜过滤,每1 mL 发酵液中加入20 μL内标溶液,装入进样瓶自动进样。
气相色谱条件(GC):DB-Wax 石英毛细管柱(30 m×0.25 mm×0.25 μm),初始柱温为45 ℃,保留1.5 min,以6 ℃/min 升温至85 ℃,保持0 min,再以4 ℃/min 升温至115 ℃,保持0 min,再以3 ℃/min升温至190 ℃,保持0 min,再以5 ℃/min 升温至225 ℃,保持3 min,进样口温度260 ℃,载气为氦气(He)(99.999%),载气流量为10.7 mL/min,分流进样,分流比10∶1,溶剂延迟5 min。
质谱条件(MS):离子源为电子电离源(electron ionization,EI),离子源温度为230 ℃,四极杆温度为150 ℃,电子能量为70 eV,发射电流为34.6 μA,倍增器电压为1294 V;接口温度为280 ℃,质量范围为50.00~600.00 m/z,对采集到的质谱图根据化合物峰离子对照NEST数据库检索定性。
2 结果与分析
2.1 高产己酸菌的分离
经过反复进行富集、分离,得到1 株硫酸铜显色结果较好的己酸菌,命名为E-6。硫酸铜显色结果见图1,上层蓝色较深,初步认为产己酸较高。将发酵液用气相色谱-质谱联用仪进行检测,测得己酸达9 g/L。

图1 菌株E-6的硫酸铜显色结果
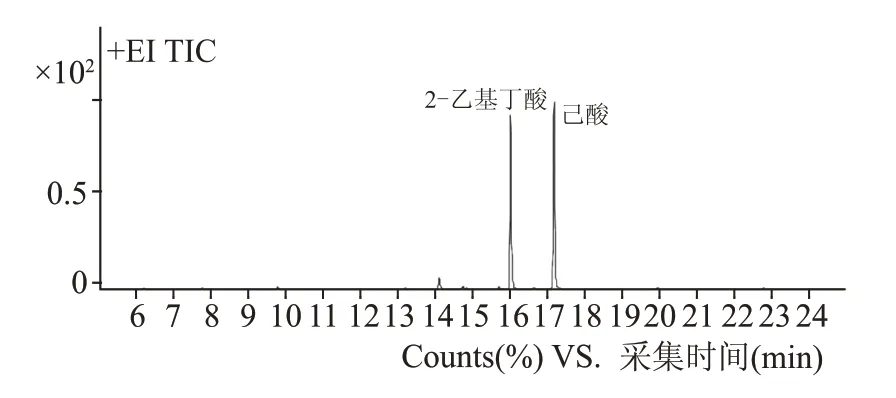
图2 菌株E-6的色谱图
2.2 菌株E-6的菌落形态及细胞形态观察
经过对E-6 进行菌落形态和革兰氏染色观察,结果见图3。表面菌落呈圆形,中间稍凸起,乳白色。E-6 为梭状芽孢杆菌,芽孢在细胞顶端,呈鼓槌状。
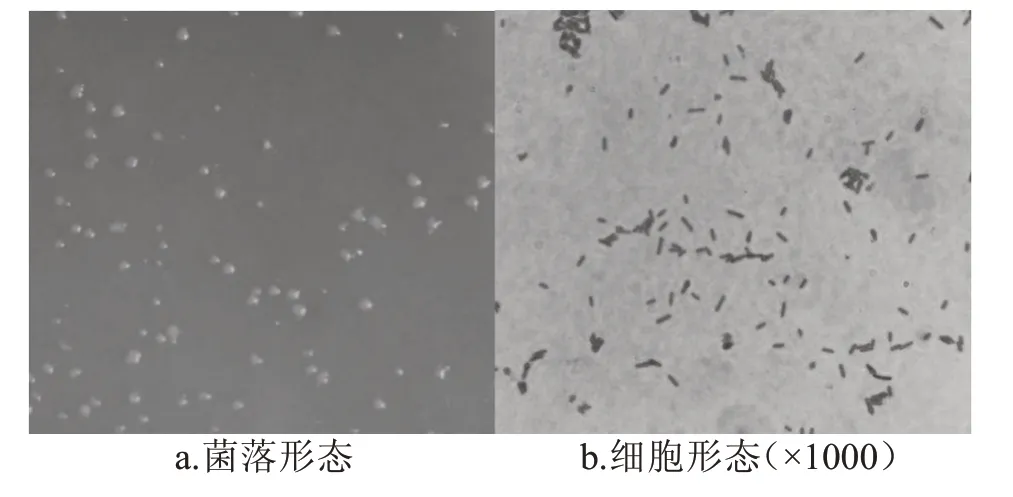
图3 菌株E-6的菌落形态及细胞形态
2.3 菌株E-6的分子生物学鉴定
菌株E-6 的16S rDNA 扩增产物琼脂糖凝胶电泳结果如图4所示,PCR扩增片段约为1500 bp。测序完成后将测序结果在Genbank 数据库进行比对,E-6为Clostridium celerecrescens。
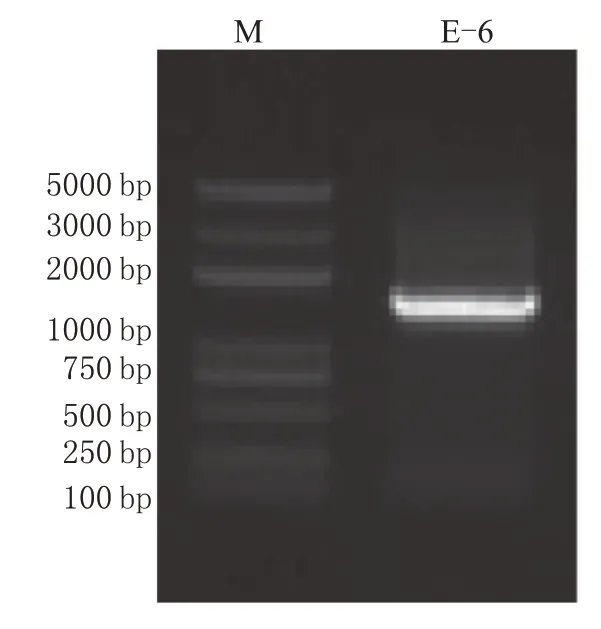
图4 菌株E-6的16SrDNA PCR扩增产物琼脂糖凝胶电泳结果
2.4 菌株E-6发酵性能测试
2.4.1 菌株E-6的生长曲线及产酸变化
如图5 所示,己酸菌E-6 的生长周期较长,前期生长缓慢,第6 天开始进入对数生长期,第11 天时菌数开始下降。
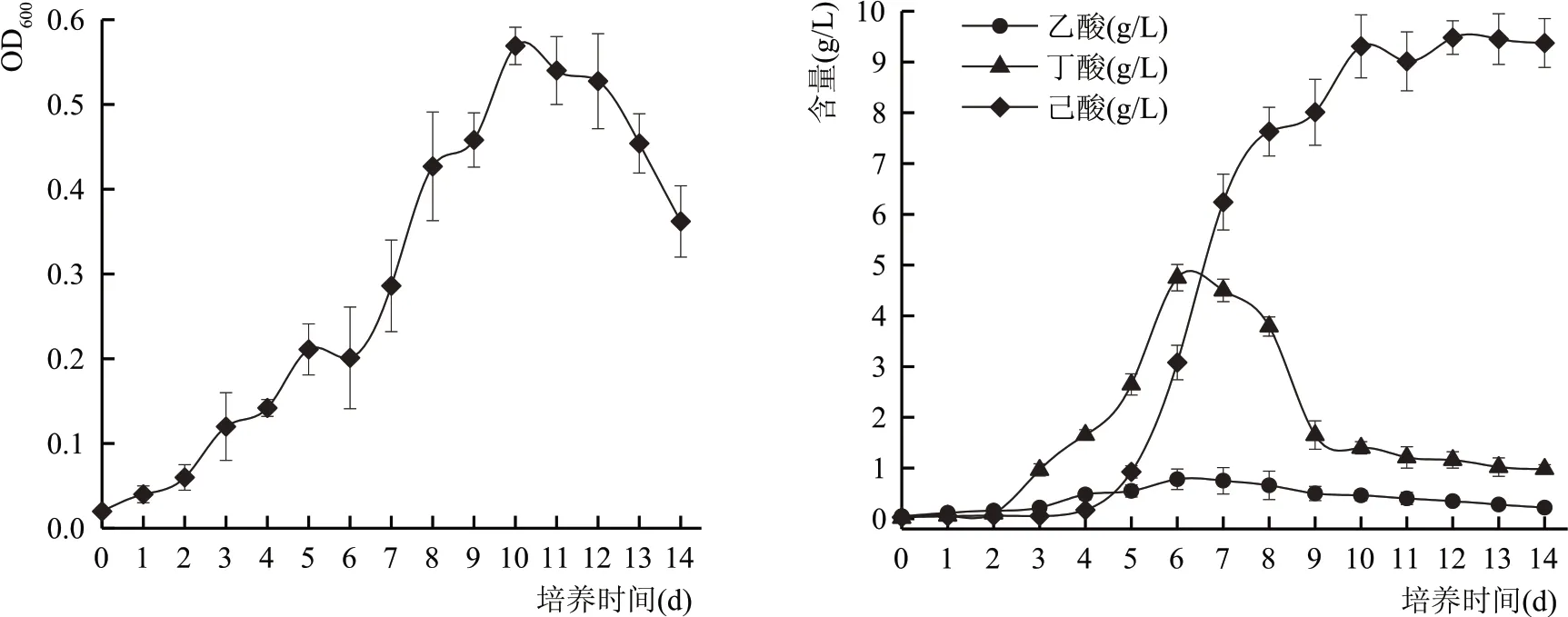
图5 E-6的生长曲线及产酸变化

图6 己酸菌代谢途径
发酵液中丁酸的含量呈先上升后下降的趋势,在对数生长期的前期开始生成。乙酸含量一直处于较低的水平,缓慢上升后逐渐下降。己酸在前期几乎无变化,在发酵第6 天开始出现产量的跃迁,第10~14 天己酸的含量无太大变化,最高产量为9.4g/L。
根据目前对己酸菌厌氧产酸代谢途径的研究,己酸菌代谢乙醇产酸通过逆β氧化过程进行,主要包括以下几个步骤:(1)6 分子的乙醇约有1分子被氧化生成乙酸,其余转化为乙酰辅酶A;(2)步骤1 生成的乙酰辅酶A 与乙酸结合,碳链上增加了2 个碳原子,形成己酸;(3)步骤1 生成的乙酰辅酶A 与步骤2 生成的丁酸结合,碳链进一步延长生成己酸[10-12]。
丁酸是己酸生成过程的前体物质,其生成时间要早于己酸,部分丁酸转化生成己酸,故其含量先增加后减少。逆β氧化过程中参加反应的乙酸来源于培养基中添加的乙酸钠和反应过程中生成的少量乙酸,这解释了为什么乙酸在反应过程中先缓慢增加后又逐渐减少。
2.4.2 发酵温度对菌株E-6产酸的影响
如图7 所示,E-6 在33~37 ℃范围内均可产己酸,己酸的产量随温度的升高先上升后下降,34 ℃时己酸产量最高,为9.4 g/L,超过34 ℃后产酸随温度升高受到抑制。最佳发酵温度为34 ℃。

图7 温度对E-6产酸的影响
2.4.3 乙醇含量对菌株E-6产酸的影响
如图8 所示,己酸的产量随乙醇添加量先升高后降低,乙醇添加量为2 mL/100 mL 时己酸产量最高。在己酸菌生长及代谢的过程中,乙醇是己酸菌生长所需碳源,是富含能量的还原性物质,是合成己酸的电子供体,氧化后能为后续的逆β氧化过程提供能量、NADH 和乙酰辅酶A[13]。在乙醇添加量为1~2 mL/100 mL 时,乙醇含量不足,合成己酸所需要的底物不足,因此己酸产量随着乙醇添加量而增多。乙醇添加量大于2 mL/100 mL 时,由于乙醇自身具有毒性,浓度过高,会抑制己酸菌的生长和代谢[14],因此己酸产量会随乙醇添加量增多而下降。
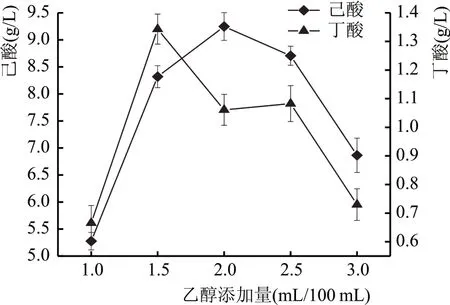
图8 乙醇添加量对E-6产酸的影响
3 结论
经过对老窖泥进行多次富集、筛选,最终分离出1 株己酸菌,命名为E-6,经分子生物学鉴定为1株速生梭菌(Clostridium celerecrescens)。该菌株培养约第6 天时开始进入对数生长期,发酵10 d 后产酸基本结束。最佳培养温度为34 ℃,乙醇添加量为2 mL/100 mL 时最适宜产己酸,此条件下培养己酸产量可达到9.4 g/L。
窖池经过多轮次发酵,窖泥中原有的营养成分会逐渐被微生物利用,发酵过程生产的有害物质也会逐渐积累,此外各种因素也会导致窖泥中的关键功能微生物的生长和繁殖受限,使窖泥出现老化现象,生产出的酒己酸乙酯含量降低,酒质较差[15]。因此,需要定期对窖池进行养护,通过泼洒酒尾、大曲粉、己酸菌酯化液等措施补充营养物质,添加酿酒功能微生物如己酸菌、酵母菌等,调节窖池环境。后续可将筛选出的己酸菌制备成纯种己酸菌液或将其与其他微生物复配制成复合己酸菌液应用到窖池进行养护,针对性地为窖泥补充大量己酸菌。而如何有效提高菌液中的己酸菌数,己酸菌与哪些微生物复配制成的菌液更适合于对窖池进行养护仍需进一步研究。此外浓香型白酒窖泥自然老熟的时间过长,己酸菌可应用于人工窖泥的培养当中,后续实验需要对己酸菌用于培养人工窖泥的工艺参数,不同理化因素对窖泥培养效果的影响等进行研究。

