乙型肝炎肝纤维化患者肝组织黏着斑激酶和整合素β1的表达及临床意义
张蔓娜万亿田彬杨兴林孙芳芳王欣
1贵阳市公共卫生救治中心感染科550002;2贵阳市公共卫生救治中心病理科550002;3贵阳市公共卫生救治中心检验科550002;4贵阳市妇幼保健院药剂科550001
肝纤维化是乙型肝炎恶变的必经阶段,严重危及患者的身心健康和生命安全。现阶段,针对肝纤维化的诊断主要基于肝组织活检,由于该方法存在一定的创伤性及并发症,推广普及具有局限性[1],故需要寻找其他安全、经济、简单、方便及可复检的检测方法[2]。研究表明,肝星状细胞(HSC)活化相关通路是肝纤维化发生发展的重要环节[3],其中黏着斑激酶处于整合素β1及生长因子等多种信号通路的交汇点,与HSC活化相关通路密切相关[4-5]。因此,本研究检测不同肝纤维化分期患者组织中黏着斑激酶和整合素β1的表达情况,同时分析它们的诊断效能可以为乙型肝炎肝纤维化诊断及防治提供参考依据。
资料与方法
一、一般资料
选择2018年10月至2020年8月在贵阳市公共卫生救治中心诊治的92例临床资料完整的乙型肝炎患者作为研究对象。
纳入标准:经血清学检查确诊为乙型肝炎,并符合乙型肝炎临床诊断标准[6];肝纤维化符合诊断标准[7]。排除标准:在参与本研究前半年内接受过抗病毒、抗纤维化及免疫调节等影响本研究治疗者;其他肝病患者;合并恶性肿瘤者;肝外器官纤维化、肝内占位性病变及存在腹腔积液者;合并穿刺禁忌者。
根据肝穿刺活检组织病理结果参照肝纤维化分期标准[8-9]分为3组:A组为S0~S1级,共37例;B组为S2~S3级,共49例;C组为S4级,共6例。其中A组男24例、女13例;年龄(41.49±8.10)岁,范围26~67岁;B组男34例、女15例;年龄(42.86±12.34)岁,范围25~69岁;C组男4例、女2例;年龄(42.61±9.77)岁,范围25~70岁。三组性别、年龄、病程、HBsAg阳性率、ALT和AST的差异均无统计学意义(P均>0.05),具有可比性,见表1。本研究试验对象均知情同意,并经过贵阳市公共卫生救治中心伦理委员会批准(伦理审批号:202111)。
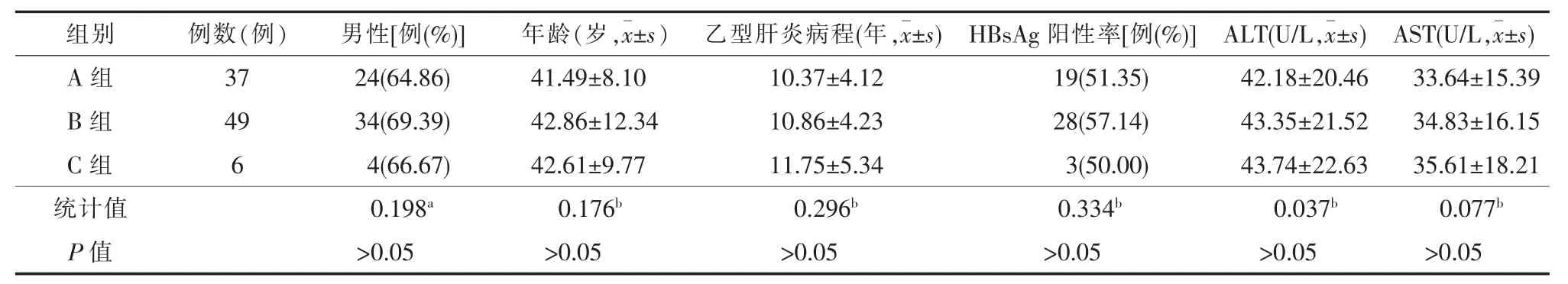
表1 不同分期肝纤维化患者的一般资料比较
二、研究方法
1.样本采集
通过肝穿刺活检术,在超声引导下,对肝组织进行采集(切除位置边缘无病变),采集的组织长度不短于1.5 cm,将采集组织固定于10%的甲醛中,石蜡包埋连续切片厚4 μm。
2.荧光定量PCR
采用RNA提取试剂盒(Invitrogen公司)提取组织总RNA。交由Takara公司设计黏着斑激酶、整合素β1和GAPDH引 物 (见 表2),然 后 参 照PrimeScript RT试剂盒(默沙克生物公司)的说明书将RNA逆转录成cDNA,设定反应条件为:37℃,15 min×3次(逆转录反应),85℃5 s(逆转录酶失活反应)。取反应液予以荧光定量PCR,参照SYBR Premix Ex TaqTMⅡ试剂盒(默沙克生物公司)说明书进行荧光定量PCR操作:95℃预变性30 s,95℃变性5 s,60℃退火延伸30 s,循环40次。采用相对定量法,2-ΔΔCt法计算目的基因黏着斑激酶、整合素β1的相对转录水平。

表2 黏着斑激酶、整合素β1和GAPDH引物序列
3.免疫组化
将组织切片放入60℃温箱烘1 h,常规予以脱蜡脱水,后将其置于3%双氧水中,37℃孵育0.5 h,磷酸缓冲液(PBS)冲洗后放入0.01 mol枸橼酸缓冲液中,95℃煮沸20 min,冷却至室温,PBS冲洗。正常羊血清工作液封闭(37℃持续10 min)。滴加一抗:黏着斑激酶 (稀释比为1∶50,Cell Signaling Technology公司)、整合素β1(稀释比为1∶100,Santa Cruz Biotechnology公司),4℃过夜,PBS冲洗。滴加相应的二抗(上海玉博生物科技有限公司)室温孵育30 min,苏木素(上海博谷生物科技有限公司)复染,封片。每张切片随机选取5个高倍视野(400×),每个视野数100个细胞,按阳性细胞所占百分比,阳性细胞判定标准:细胞核/细胞质内出现棕黄色颗粒。
4.免疫印迹
对组织中总蛋白进行提取及定量(蛋白提取试剂盒购自北京索莱宝科技有限公司,定量试剂盒采用BCA试剂盒),行SDS-PAGE后,予以PVDF转膜,再封闭1 h,加一抗:黏着斑激酶(稀释比为1∶1 000,Cell Signaling Technology公司)、整合素β1(稀释比为1∶200,Santa Cruz Biotechnology公司),4℃过夜,漂洗,再加相应的二抗室温孵育1 h,洗膜,显影曝光并成像,以GAPDH为内参。通过Image J软件分析灰度值,计算蛋白水平=目标蛋白灰度值/GAPDH条带灰度值。
三、统计学方法
采用SPSS 24.0软件进行统计分析,计数资料用例数和率描述,采用χ2检验进行统计学分析;正态分布的计量资料用x±s描述,多组间相比用单因素方差分析,两两相比用HSD-q检验,相关性分析用Pearson法,诊断效能用ROC曲线法。P<0.05为差异有统计学意义。
结 果
一、不同肝纤维化严重程度黏着斑激酶、整合素β1的表达比较
由表3可见,3组间黏着斑激酶的基因表达、阳性表达率和蛋白表达以及整合素β1的基因表达、阳性表达率和蛋白表达的差异均有统计学意义(F黏着斑激酶=81.220、11.938和138.726,F整合素β1=103.906、35.852和318.706,P均<0.01)。
B组和C组黏着斑激酶基因表达、阳性表达率和蛋白表达以及整合素β1基因表达、阳性表达率和蛋白表达均高于A组(P均<0.01),如图1、图2及表3所示。

图2 不同分期肝纤维化患者肝组织中黏着斑激酶和整合素β1的免疫印迹图
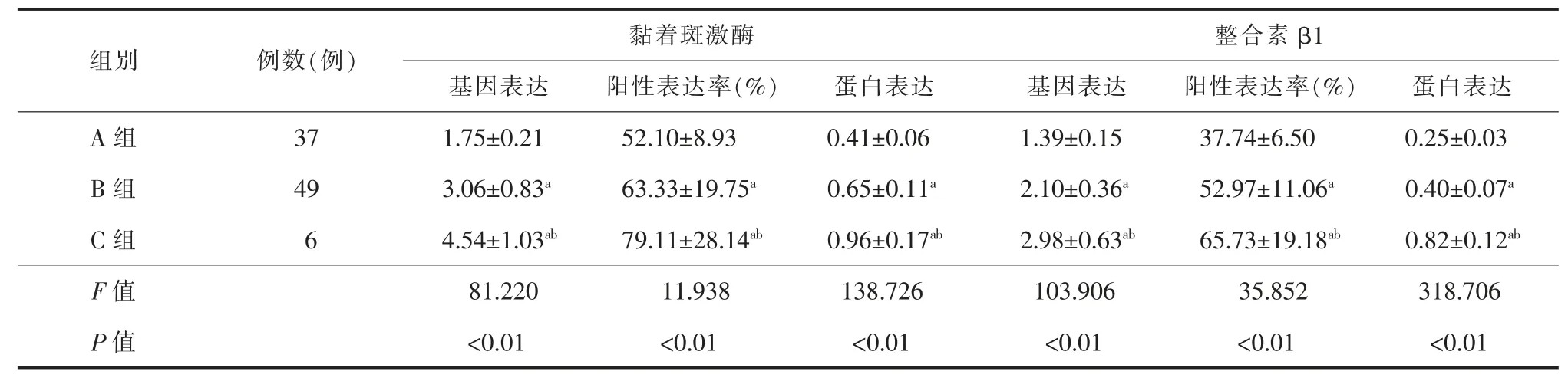
表3 不同分期肝纤维化患者黏着斑激酶和整合素β1的表达(x±s)

图1 不同分期肝纤维化患者肝组织中黏着斑激酶和整合素β1免疫组化图(苏木素复染,×400)
二、相关性分析
研究组中黏着斑激酶的基因表达、阳性表达率、蛋白表达与患者纤维化分期均呈正相关(r=0.610、0.642和0.706,P均<0.01),整合素β1的基因表达、阳性表达率、蛋白表达也与患者肝纤维化分期呈正相关(r=0.520、0.498和0.596,P均<0.01)。
三、ROC分析
乙型肝炎肝纤维化患者肝组织中黏着斑激酶、整合素β1及二者联合基因相对表达诊断的ROC曲线下面积分别为0.791、0.795和0.874;黏着斑激酶、整合素β1及二者联合阳性表达率诊断的ROC曲线下面积分别为0.895、0.827和0.926;肝组织中黏着斑激酶、整合素β1蛋白表达诊断的ROC曲线下面积分别为0.841、0.863和0.889,均具有一定的诊断价值,见表4及图3。

图3 肝组织中黏着斑激酶和整合素β1的基因表达、阳性率表达和蛋白表达对乙型肝炎肝纤维化患者诊断的ROC曲线

表4 肝组织中黏着斑激酶、整合素β1对乙型肝炎肝纤维化患者的诊断效能
讨 论
已有研究证实,HSC在肝损伤时是细胞外基质(ECM)的主要生成细胞,因此HSC的活化和ECM的过量分泌是肝纤维化发生发展的重要环节[7-10]。黏着斑激酶是一种非受体蛋白酪氨酸激酶,研究发现它可调控酪氨酸蛋白酶受体及整合素等信号通路转导至细胞内,该通路介导过程可作为HSC活化有关通路的交叉和枢纽[4-5,11]。整合素β1是一种跨膜糖蛋白受体分子,具有活化HSC及促进ECM分泌的作用[12]。白瑞丹等[13]研究发现,黏着斑激酶抑制剂能够抑制HSC增殖,并促进其凋亡,进而缓解肝纤维化进程。林传钦等[14]研究显示,整合素β1阻断可抑制黏着斑激酶的磷酸化,下调生长因子及纤维化蛋白表达,进而起到改善心肌细胞纤维化的作用。因此,作者推测黏着斑激酶和整合素β1可能参与乙型肝炎肝纤维化病情的发生发展,对该病的辅助检测及诊断具有一定的指导意义。
本研究发现,B组及C组黏着斑激酶和整合素β1的基因表达、阳性表达率及蛋白表达均高于A组;且C组的相关表达高于B组,提示随着患者肝纤维化病情严重程度的加剧,患者肝组织中黏着斑激酶、整合素β1表达呈明显升高趋势,推测两者表达水平与乙型肝炎肝纤维化的发生发展存在一定关系。进一步相关性分析发现,肝组织中黏着斑激酶、整合素β1表达与患者纤维化分期均呈正相关,证实肝纤维化进展与黏着斑激酶、整合素β1表达变化密切相关。ROC分析结果显示,肝组织中黏着斑激酶、整合素β1及二者联合相对表达诊断乙型肝炎肝纤维化患者的ROC曲线下面积均大于0.7,且二者联合相对表达对患者病情的诊断效果最优,说明黏着斑激酶与整合素β1联合在辅助诊断乙型肝炎肝纤维化方面具有较高的诊断价值,对减少不必要的肝穿刺检查具有重要意义。
综上所述,黏着斑激酶和整合素β1在乙型肝炎肝纤维化患者中存在随着病情程度加剧而升高的趋势,且与患者肝纤维化严重程度呈正相关,可作为早期辅助诊断乙型肝炎肝纤维化的有效指标,且二者联合诊断效能相对较优,具有临床应用价值。由于本文为单中心研究,病例数量有限,今后将扩大样本数来验证以上结果。
利益冲突 所有作者均声明不存在利益冲突

