东亚飞蝗pSMC重组抗原表达及多克隆抗体制备
王麒霖,邱 佳,余 瑛,夏玉先
(1.重庆理工大学 药学与生物工程学院,重庆 400054;2.重庆大学 生命科学学院,重庆 400030)
染色体结构维持蛋白(structural maintenance of chromosome,SMC)广泛存在于从细菌到人类的生物中,是一类结构高度保守的ATP酶家族成员蛋白。SMC蛋白呈V形结构,有2条长臂,每一长臂末端都有一个ATP结合的头部结构域,其分子结构中包括5种可识别的结构域:NH2-末端核苷三磷酸(NTP)结合结构域、铰链区、2个由铰链分隔的螺旋线圈和一个COOH-末端结构域[1]。
在真核细胞中,目前发现的SMC蛋白有6个(SMC1-6)[2],这些蛋白质以SMC1与SMC3、SMC2与SMC4、SMC5与SMC6的异二聚体形式与非SMC成员(Kleisin和HEAT亚基)结合行使功能[3]。 SMC与非SMC形成了3种复合物:黏着素(SMC1/3),对染色单体的黏着起关键作用;凝聚素(SMC2/4),促进姐妹染色单体的压缩和后期分离;SMC5/6复合物,促进DNA修复并影响未受损细胞的染色体稳定性[4-5]。
SMC的功能绝不仅仅是维持染色体结构的完整性,它很可能还参与了多种基因的表达调控及免疫调节。Smc家族成员(包括Smc2/3/4/5)可促进LPS诱导的IL-6生成,提示Smc家族成员在促进先天免疫中的作用。其中,Smc4是炎症固有反应的积极调节因子。Smc4通过向nemo启动子招募H4K5ac促进NF-κB和IRF3的固有激活,通过表观遗传方式增强nemo的转录,随后诱导促炎性细胞因子和IL的激活[6]。Smc5/6是抑制乙型肝炎病毒(hepatitis B virus,HBV)转录的限制因子,当定位于核结构域10(ND10)时抑制HBV转录。HBV通过表达HBV X蛋白(HBx)来对抗这种限制,Smc5/6被降解时,HBV和HBx阴性病毒在PHH细胞中建立高水平感染,而不诱导干扰素或其他细胞因子的产生[7]。
Smc与肿瘤的发生有关。临床病理研究表明:SMC在乳腺癌、结肠癌、肝癌等多种肿瘤组织表达[8-10],参与了癌细胞增殖、迁移、侵袭过程[11],但详细的机制仍不清楚。与正常组织相比,肝癌组织中Smc4 mRNA和蛋白高表达。SMC4表达下调则能降低肝癌细胞的增殖[12]。与此类似,在异种移植裸鼠中,SMC2缺失抑制膀胱癌细胞增殖,促进凋亡,减少集落形成,减少肿瘤生长。SMC2的过度表达则恢复TUG1缺失细胞的生长,提示:SMC2是膀胱癌的原癌基因。因此,SMC的抑制或缺失可能对癌症治疗有潜在的意义[13]。此外,染色体结构畸变的诱发也可能与Smc直接相关。SMC蛋白在细胞周期中的重要性可以通过Smc基因在人类癌细胞系中经常发生突变这一事实进一步证实[14]。
近期的文献报道提示:SMC也在一些炎症性疾病中高表达,在T细胞中SMC可能参与了激活TLR和病毒引发的先天性免疫反应[6]。但人们对于SMC在免疫调节中的作用机制仍然知之甚少。本团队最近研究发现了一种SMC在东亚飞蝗血淋巴吞噬细胞中高表达(命名为pSMC),该SMC在吞噬细胞中的功能和天然免疫中的作用有待研究。
本研究以东亚飞蝗为材料,从其血细胞中克隆了含有SMC保守结构域的pSMC249-383抗原片段,经重组表达、纯化获得了重组抗原,以该重组抗原免疫小鼠获得了多克隆抗体,为下一步进行pSMC相关功能研究奠定了工作基础。
1 材料和方法
1.1 材料
1.1.1试剂
Taq DNA聚合酶、dNTP、EcoR Ⅰ、Hind III、DNA连接酶均购自TaKaRa公司,Ultrapure RNA Kit(DNase I)、HiFiScript cDNA Synthesis Kit购自康为世纪公司,质粒提取试剂盒、DNA快速纯化/回收试剂盒购自OMEGA试剂公司,荧光磁珠购自德国Chemicell公司,其他试剂均为国产分析纯。
蛋白质纯化试剂及配方:细胞裂解液:25 mmol/L NaH2PO4(pH值为8.0),0.4 mol/L NaCl,0.1%tween20,0.1 mmol/L PMSF。 平衡溶液:25 mmol/L Tris-HCl (pH值为8.0),0.4 mol/L NaCl,20 mmol/L咪唑。100 mmol/L咪唑洗脱液:25 mmol/L Tris-HCl (pH值为8.0),0.4 mol/L NaCl,100 mmol/L咪唑。400 mmol/L咪唑洗脱液:25 mmol/L Tris-HCl (pH值为8.0),0.4 mol/L NaCl,400 mmol/L咪唑。
1.1.2动物、质粒及菌株
东亚飞蝗由重庆大学基因中心提供。BALB/c小鼠购自重庆医科大学动物中心。质粒pET30a(+)、大肠杆菌DH5α、BL21(DE3)细胞为本实验室保存。
1.1.3pSMC序列
该序列数据来源于东亚飞蝗血淋巴转录组测序结果,具体的氨基酸序列如下:
DGRRPSAPAAASLPRYNSFSSDDEGQREERKT
LPEENGFLTGENSQRQRDKKKPLLEENGFTPADTS
YRQRDNKKPVIEENGFTPADTSYTSGSGSVMGRDV
GPPPPPPPRAASAMSLHLQPPPDKPDRHASTTAPE
EAGLHVSAGELLGRTHEELVLLLIQLRRQSAAVCK
AMETCHMEIEAQARFVELETPKRLEHLKKLEDLK
RHLLDLEKQYEKGKPLVNLVDNMVKLGSLYRGPS
ARERLEFNQKVQEKRLLAEERRDWDRLSPDRTQL
QAKVQQLYRLDRLLQEESSTLQSLQQDKELLERAL
AGLRHKLQNNSHFSPLEVEHFRKQQRALERELSRV
RLLLAHNSKKLEETVAENARLEQELVILRQKLQQPI
TEPGGGTAALEAELRRVQRLVGDLTRQRKQLSLQV
QQLTQQRPGAAGVSSSRGSSSMPSRKRHHSTWLVT
DLDTLETQDLGVETAVSPASSQATTATSPASTLRSP
MYTSREAGGGMEMESEVPPPLPAPPEIPPEYPPPPP
PPPPPSEEALLGPGEQYCPHVDINEADDRMKRFYG
IIPKEKQQEIKTVRIVKRESERRQRDRDRSGNIGIPL
TNGGVSTGKRPSAADESEIANSTSEVQGFQKQQLG
PVEEEVSESSRPFSETLLSASVDDDEEDDDPAIDLQ
FQRSLSLPRGFGKRERLSGAPPPPPIRSASPRGEGM
GTGTNSRQQRVRFKDGDYTSVSSSPSPSPSPSQLSP
VFKSQAARAIVQEVSQSPRKRAVPKEKRRHHTVSS
SKPLLDMESSASRMGSARSRDDLDMERALRPRRIN
APDVVRSTMSHKDFKYNENTIDSILGTPSKIIIPERYI
PEQAPELSAEEQLHRLKKAEAIRKMLSETSAISASE
GIEEEHQTATLKKKVAAEKRQREHLLQLNQLLAR
QQVMEKSKVVAGSTCAPTME
1.2 pSMC基因的生信分析
采用NCBI(https://www.ncbi.nlm.nih.gov/)的BLASTp进行pSMC序列结构分析,亚细胞定位采用Euk-mPLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/euk-multi-2/#)分析,抗原表位采用(http://imed.med.ucm.es/Tools/antigenic.pl)网站工具进行分析。
1.3 pSMC抗原扩增引物设计
采用Primer Premier5设计引物,序列分别为,F引物:5′-GCAGAATTCCAGAAGGTCCAGGAGAAACG-3′;R引物:5′-CTCAAGCTTTCATGGCTCTGTTATTGGCTGT-3′。
1.4 蝗虫血淋巴总RNA的提取与pSMC基因的扩增
用RNA试剂盒提取东亚飞蝗成虫血淋巴总RNA,按试剂盒说明进行反转录获得cDNA。
pSMC249-383PCR扩增条件:94 ℃预变性5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 7 min。扩增结束后用琼脂糖凝胶电泳检测PCR产物。
1.5 pET30a(+)-pSMC249-383原核表达载体的构建
将得到的PCR产物回收纯化,纯化的PCR产物和pET30a(+)质粒分别用EcoR Ⅰ、Hind III进行双酶切处理。酶切后的PCR产物和pET30a(+)质粒用T4DNA连接酶连接,转化DH5α感受态细胞。用含卡拉霉素的LB转化平板筛选转化子。挑取单克隆进行菌落PCR鉴定、质粒酶切鉴定、DNA测序分析,筛选鉴定pET30a(+)-pSMC249-383重组质粒。
1.6 重组pSMC249-383的原核表达及纯化
将鉴定序列正确的重组质粒,转入大肠杆菌BL21(DE3)中,在37℃下诱导培养,待OD600至0.6~0.8时,加入IPTG(1 mmol/L)诱导表达5 h,SDS-PAGE确定重组蛋白的表达形式,超声破碎法破胞。从1L发酵液中收获菌体,用PBS(含1mmol/L PMSF)10 mL制备菌悬液,超声条件为80 Hz,超声5 s,间隔5 s,总时间30 min。超声至溶液透明,高速离心收集上清液,用Ni-NTA柱对上清液中的目的蛋白进行纯化,SDS-PAGE检测目的蛋白纯度,BCA试剂盒测定蛋白浓度。
1.7 Anti-SMC抗体制备及pSMC的细胞定位
对纯化后的重组pSMC249-383蛋白进行SDS-PAGE电泳,用1 mol/L氯化钾染色,切下含有目的蛋白的胶条,然后用超纯水洗涤脱色,在胶条透明无色后,加入液氮研磨,用PBS重悬,注射BALB/C小鼠腹腔进行免疫,免疫剂量为每只小鼠每次100 ug pSMC249-383蛋白,免疫周期为2周1次,3次免疫后对小鼠进行尾部采血测定血清效价,当效价大于5 000时,收获血清。
pSMC的细胞定位采用免疫荧光法检测。向东亚飞蝗体内注射红色荧光标记的纳米磁珠,3 h后采血,制作血涂片。血涂片于37 ℃干燥1 h,PBS洗5 min,重复3次;用4%多聚甲醛固定30 min,PBS洗3次;0.3% Triton X-100处理5 min,PBS洗3次;加封闭液(PBS含3%BSA), 37 ℃,封闭1 h,PBS洗3次;加PBS稀释的血清(1∶1 000),4 ℃孵育过夜,PBS洗3次;加FITC标记的兔抗鼠二抗,37 ℃孵育1 h,PBS洗3次;加入10倍稀释后的DAPI处理2 min,PBS洗3次。荧光显微镜观察并拍照,采集图像软件为OLYMPUS CellSens Standard 1.14。
2 结果与分析
2.1 pSMC基因的生物信息学分析
2.1.1结构域分析
在NCBI(https://www.ncbi.nlm.nih.gov)中对SMC蛋白质结构进行分析。结果(图1)显示:pSMC蛋白由933个氨基酸残基组成,SMC保守结构域主要分布在第200-422区段。
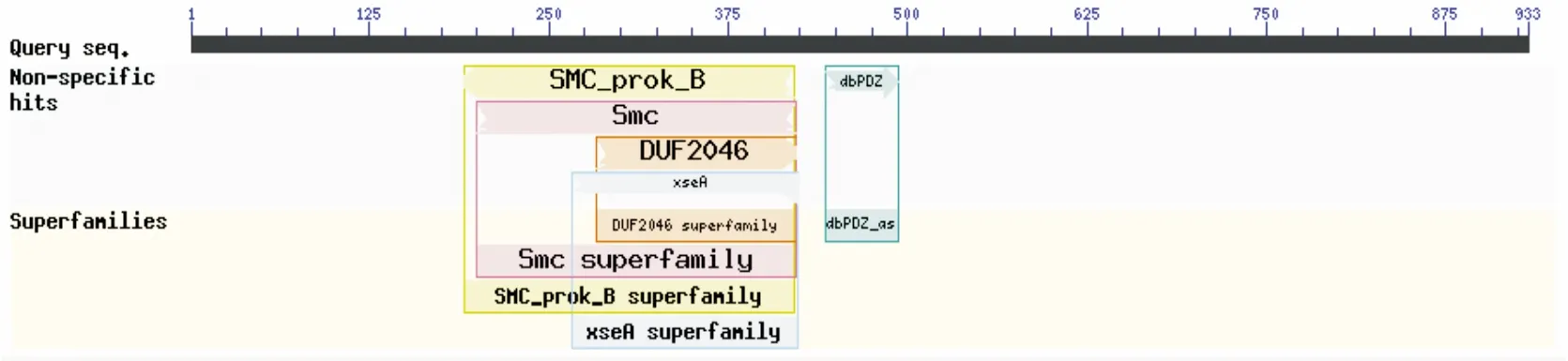
图1 pSMC结构域分析示意图
2.1.2蛋白质的亚细胞定位
对pSMC氨基酸序列进行在线分析(http://www.csbio.sjtu.edu.cn/bioinf/euk-multi-2/#),结果显示pSMC蛋白定位于细胞质和细胞核。
2.1.3抗原表位分析
在线分析(http://imed.med.ucm.es/Tools/antigenic.pl) pSMC蛋白的抗原表位。
结果(图2)显示:pSMC蛋白在N端50-450肽段的抗原表位最为丰富。本研究选择pSMC的249-383肽段作为pSMC抗原区段进行克隆,将该片段命名为pSMC249-383。
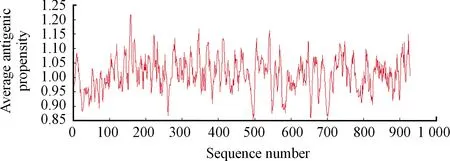
图2 pSMC蛋白抗原表位分析曲线
2.2 蝗虫血淋巴总RNA的提取和pSMC249-383片段的扩增
用RNA提取试剂盒提取蝗虫血淋巴总RNA,琼脂糖凝胶电泳(图3(a))显示RNA条带完整,无降解,且RNA的OD260/OD230值和OD260/OD280值均大于1.8,表明提取的RNA纯度较高,适合作为扩增模板。
将提取的总RNA用反转录试剂盒合成cDNA第一链,以此为模板对pSMC249-383片段进行扩增,电泳检测结果表明扩增产物大小约为405bp(图3(b)),与预期的片段长度符合。
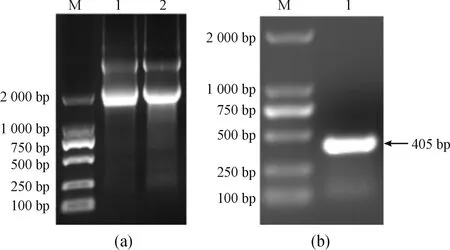
a.蝗虫血淋巴总RNA提取.M:DL2000 DNA marker;1-2:蝗虫血淋巴总RNA;b.pSMC249-383的PCR.M:DL2000 DNA marker;1:pSMC249-383的PCR产物图3 pSMC249-383片段扩增图
2.3 pET30a(+)-pSMC249-383原核表达质粒的构建
扩增的pSMC249-383和pET30a(+)质粒分别用EcoRI和HindIII进行双酶切,然后回收纯化、连接。将连接产物转化DH5α感受态细胞,对转化子进行菌落PCR鉴定,得到阳性菌落的电泳条带大小约405bp(图4(a))。
对菌落PCR鉴定为阳性的克隆进行过夜培养,提取其质粒,用EcoR I和 Hind III酶切处理。结果显示该质粒含有目的条带(图4(b)),为重组质粒。对此重组质粒的DNA测序结果显示:插入片段为pSMC249-383,表明pET30a(+)-pSMC249-383重组表达载体构建成功。
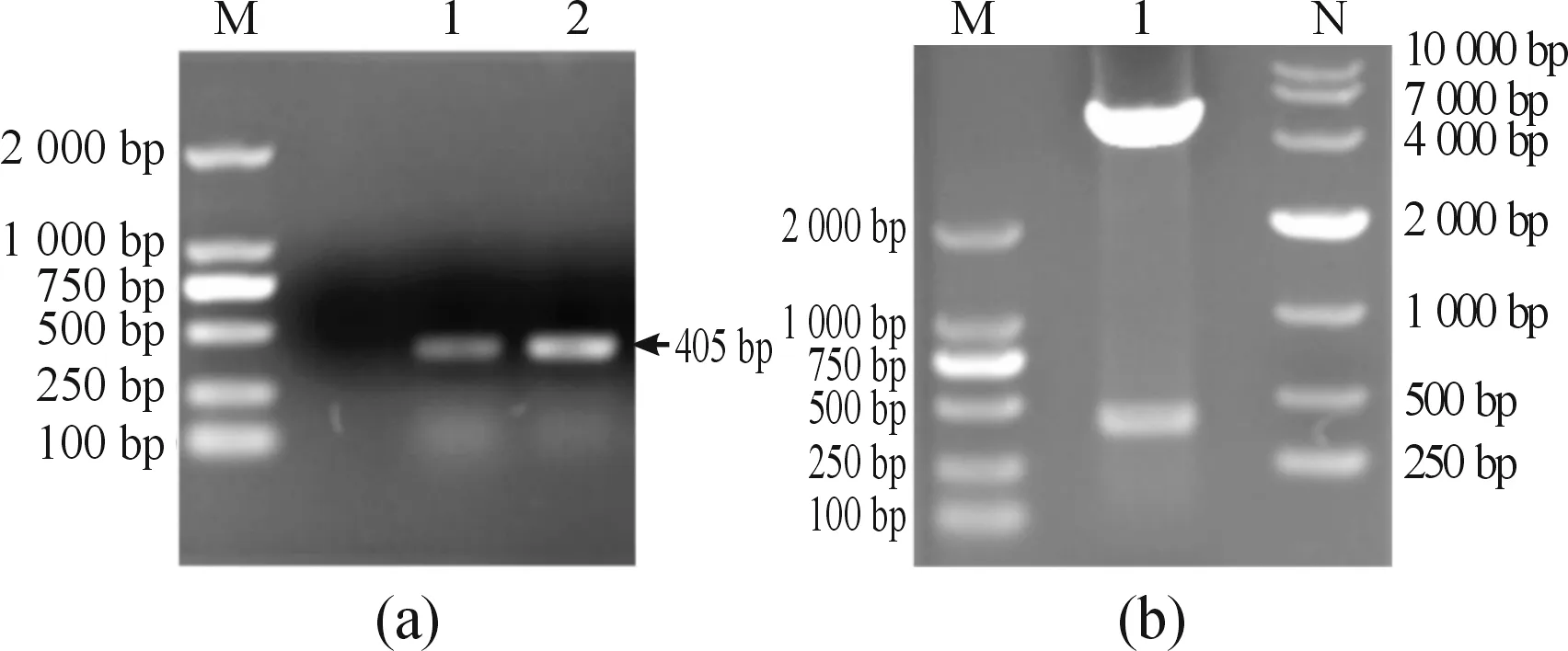
a.转化子的菌落PCR鉴定.M:DL2000 DNA marker;1-2:转化子PCR产物; b.重组质粒pET30a(+)-pSMC249-383的酶切鉴定.M:DL2000 DNA marker;1:EcoR I 和 Hind III 酶切重组pET30a(+)-pSMC249-383;N:DL10000 DNA marker图4 pET30a(+)-pSMC249-383重组质粒鉴定图
2.4 pSMC249-383重组蛋白表达形式分析
将构建成功的pET30a(+)-pSMC249-383重组质粒转化BL21(DE3),在LB培养基中进行发酵培养,经IPTG诱导后分离发酵液中的菌体。菌体经超声破碎后,分离上清与沉淀,进行SDS-PAGE电泳。电泳结果(图5)显示:pSMC249-383重组蛋白大量存在于裂解上清中,在沉淀中较少。说明pSMC249-383重组蛋白在BL21(DE3)中主要为可溶性表达。用电泳法测定的pSMC249-383重组蛋白分子量大小为21.8KD,与预期一致。
2.5 pSMC249-383重组蛋白的纯化
培养1L pET30a(+)-pSMC249-383/BL21(DE3)发酵液,取诱导培养后菌体的裂解上清,用Ni亲和层析技术[11-12]纯化pSMC249-383重组蛋白,对纯化过程中的洗脱样品用SDS-PAGE电泳进行检测(图6)。
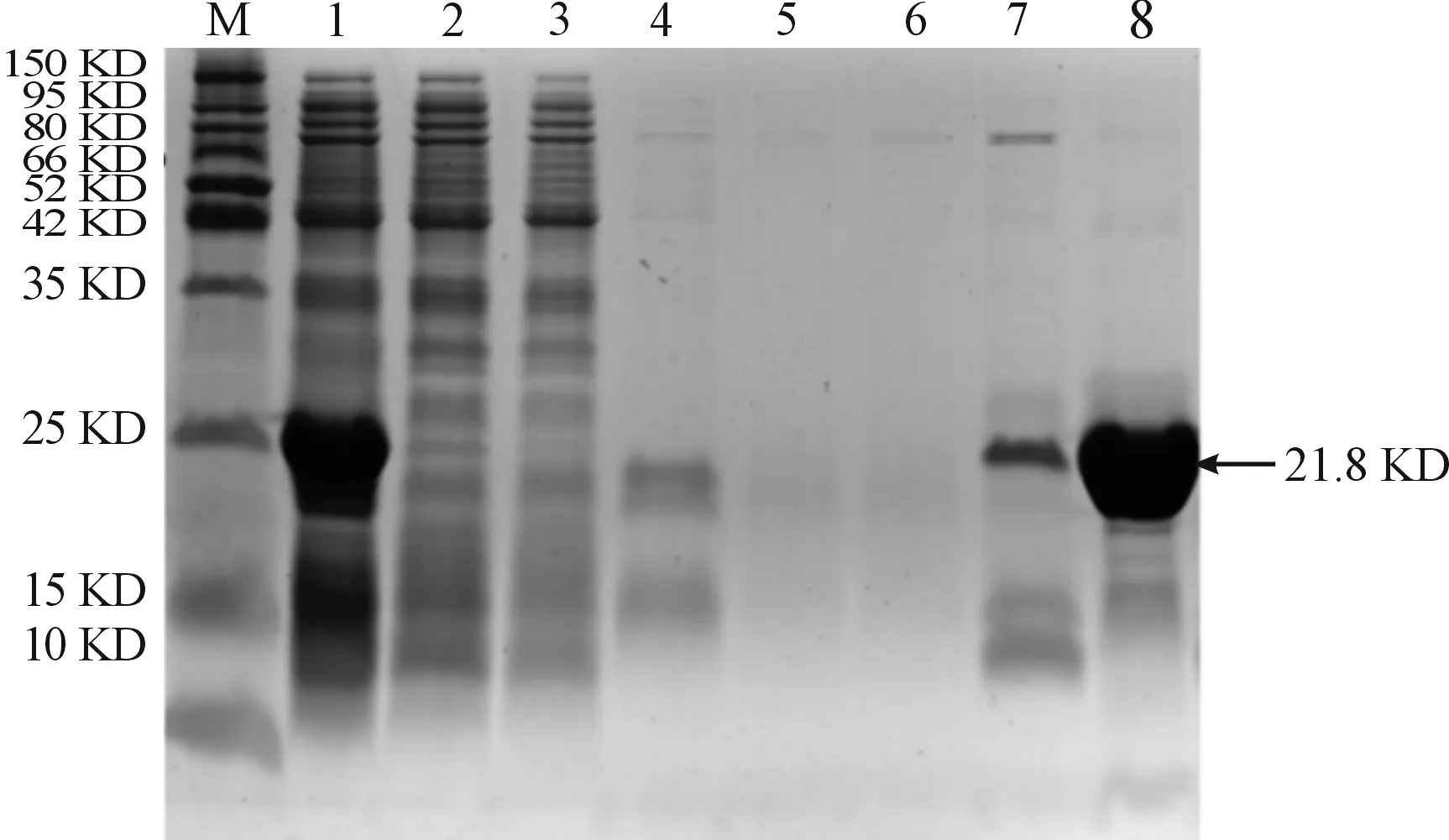
M:蛋白质分子量marker;1:pET30a(+)-pSMC249-383/BL21裂解上清;2:穿柱液;3-4:20mM/L咪唑洗脱液;5-7:100mM/L咪唑洗脱液;8:400mM/L咪唑洗脱液图6 SDS-PAGE检测pSMC249-383蛋白纯化图
结果显示pSMC249-383重组蛋白能较好地被Ni柱吸附,用100 mmol/L咪唑溶液洗去非特异性结合蛋白,再用400 mmol/L咪唑溶液洗脱目的蛋白,可获得纯度较高的重组pSMC249-383蛋白。image J软件分析显示pSMC249-383重组蛋白纯度为80%,浓度为1.98 μg/μL,1 L发酵液可获得纯化后pSMC249-383重组蛋白约20 mg。
2.6 pSMC的抗血清制备与pSMC249-383的亚细胞定位
用SDS-PAGE分离纯化后的pSMC249-383蛋白,切取含有pSMC249-383蛋白条带的胶条,粉碎胶条制成悬液免疫小鼠,ELISA法检测显示获得的pSMC249-383抗血清效价大于1∶64 000。
采用免疫荧光技术检测pSMC在东亚飞蝗血淋巴细胞中的定位。结果(图7)显示:pSMC主要分布于细胞核,且吞噬了红色荧光磁珠的吞噬细胞细胞核中pSMC信号较其他细胞更强,表明pSMC定位于细胞核,在吞噬细胞中高表达。
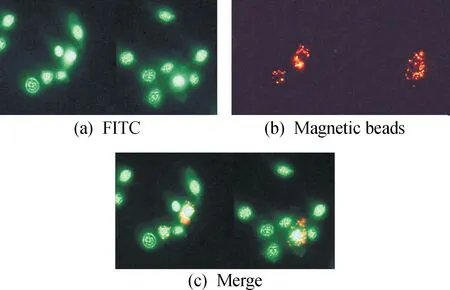
FITC:FITC标记的羊抗鼠二抗;Magnetic beads:红色荧光标记的纳米磁珠;Merge:红绿通道叠加图7 pSMC在蝗虫血淋巴细胞中的定位分析图
3 多克隆抗体制备
本研究采用原核pET系统成功克隆并表达了pSMC249-383抗原,用该重组表达的抗原免疫小鼠获得了高效价的抗血清。一般来说,制备多克隆抗体比单克隆抗体过程简单,周期更短,多克隆抗体灵敏度更高,但特异性通常不如单克隆抗体好[15]。本研究通过对pSMC的核酸、蛋白序列进行生物信息学分析,选取其抗原表位丰富且特异性较好的区段进行克隆,获得了免疫原性及特异性均较好的重组抗原pSMC249-383。该重组抗原在大肠杆菌中以包含体形式表达,不仅表达量高,且因带有6×His标签纯化方便[16]。为了获得高纯度抗原,本研究对Ni亲和层析纯化的目的蛋白进行SDS-PAGE电泳,从凝胶中切取含目的蛋白条带的凝胶胶条,用于免疫小鼠。该方法不仅简化了获得高纯度目的蛋白的纯化步骤,而且凝胶在免疫过程中充当了佐剂的作用[17-18],能有效增强小鼠的免疫应答。本实验使用该方法在3次免疫后SMC多克隆抗体血清效价达1∶64 000,表明该方法便捷且省时高效。
4 结论
对pSMC的序列分析显示,pSMC中含有核定位信号序列;免疫荧光检测结果显示,pSMC在东亚飞蝗血淋巴吞噬细胞高表达,且定位于细胞核。由于吞噬细胞为天然免疫细胞,SMC在DNA复制、基因表达调控中至关重要,pSMC在吞噬细胞中如何维持DNA稳态,影响或调控天然免疫相关过程值得关注。

