喉鳞状细胞癌生物标志物的研究进展*
沈海龙 朱君伟 韩燕勋 王大明 刘业海
喉癌是头颈部第二大常见的恶性肿瘤,超过90%以上的喉癌病理类型属于喉鳞状细胞癌(laryngeal squamous cell carcinoma,LSCC)。在全球范围内,喉癌每年影响约65万人,并且夺走35万人的生命[1]。在美国喉癌的5年生存率在过去40年里从66%下降到63%,而在国内喉癌的5年生存率约为77%[2],因此喉癌的早期诊断、早期治疗、疾病监测和预后判断对于提高喉癌患者的生存率具有重要的意义。肿瘤标志物指特征性存在于恶性肿瘤细胞,或由恶性肿瘤细胞异常产生的物质,或是宿主对肿瘤的刺激反应而产生的物质,能反映肿瘤发生、发展,监测肿瘤对治疗的反应。有些编码基因通过转录RNA及翻译蛋白质可以直接或间接地促进喉癌细胞的增殖、侵袭和转移。基质金属蛋白酶和细胞因子是其中比较特殊的蛋白质,本文进行了重点阐述。非编码RNA和外泌体是当下喉癌生物标志物的研究热点,研究进展也很迅速。希望通过本篇综述,能为喉癌生物标志物的相关基础和临床研究提供思路。
1 基因
有多个与喉癌发生及发展相关的编码基因,通过转录RNA及翻译蛋白质直接或间接地促进了喉癌细胞的增殖、侵袭和转移。殷文娟等[3]通过免疫组化等方法检测106例喉癌组织和13例癌旁组织,发现BRAP在喉癌组织中高表达,并且其表达量与淋巴结转移、TNM分期密切相关。生存分析显示,BRAP低表达组患者生存率明显高于BRAP高表达组。有研究表明[4],与早期喉癌患者相比,晚期喉癌患者BCL2L12表达水平明显下降,因此BCL2L12可以作为晚期喉癌患者的预后标志物。龚志涛等[5]通过免疫组化等实验技术得出PCDH20在喉癌组织中的表达水平与淋巴转移有关,表达量较低的LSCC患者预后较差。基因产物可能是通过影响各种信号通路,促进或是抑制肿瘤进展。Ni等[6]研究了Spondin-2基因在喉癌中的作用,Spondin-2沉默可导致LSCC细胞中AKT(protein kinase B,蛋白激酶B)和PI3K(phosphatidylinositol 3-kinase,磷脂酰肌醇3-激酶)失活,因此Spondin-2可能通过激活PI3K/AKT信号通路促进了喉癌细胞的增殖和转移。Sheng等[7]学者采用qRT-PCR(quantitative real-time Polymerase Chain Reaction,荧光实时定量聚合酶链式反应)等试验技术证实PLOD2过表达增加了Hep-2细胞的类癌症干细胞的特点,激活了Wnt信号通路,使喉癌细胞在体内外都产生了耐药性。基因启动子或者基因甲基化对喉癌的发生发展同样重要,甲基化水平可以作为LSCC的诊断和预后标志物。Fan[8]的研究表明LMX1B基因体甲基化的增加是其表达上调的重要机制。在基因体的CpG位点当中,cg13600622和cg14204784甲基化水平可能是比LMX1B mRNA(messenger RNA,信使RNA)更好的预后标志物。ESRRG启动子甲基化程度在喉癌组织中高于癌旁组织,并且高甲基化与不良预后相关。提示ESRRG启动子甲基化可以作为喉癌诊断和预后的标志物[9]。一项吉林大学第二附属医院的研究[10]通过对50例喉癌及对照组的免疫组化检测得出,CCTα(phosphatidylcholine cytidine transferase α,磷脂酰胆碱苷转移酶α)可以作为LSCC的新的诊断标志物。CCTα在喉癌组织中表达明显增加是因为基因的甲基化减少。与喉癌相关的基因可能通过调节上皮间质转化(epithelial-mesenchymal transition,EMT)过程影响了喉癌的侵袭和转移。陈莉莉等[11]发现B7-H4广泛表达于人喉癌细胞中,并与EMT(epithelial-mesenchymal transition,上皮间质转化)标志物共表达,可能通过促进EMT进程导致喉癌的侵袭及转移。Marioni等[12]发现Nm23-H1在复发的喉癌患者中表达量明显下降。因此可以用来预测喉癌的复发风险。与喉癌相关基因的最新研究情况见表1。

表1 喉癌相关基因的最新研究
2 基质金属蛋白酶(matrix metalloproteinase,MMPs)
MMPs是与肿瘤发生相关的蛋白酶家族中最重要的一类,它们可以引起肿瘤微环境的改变。Fang等[13]用高通量测序等技术研究,MMP1和MMP2在正常组织中含量极低,而在喉癌组织中高表达,它们可以作为LSCC诊断的标志物。MMP1是由肿瘤细胞和肿瘤间质产生,可裂解细胞外基质成分,在肿瘤侵袭中起重要作用[14]。而MMP2对于纤维性胶原碎片的降解至关重要,这种降解促进了肿瘤的侵袭和进展,因为IV型胶原是基底膜的主要成分。MMP2的另一个重要作用是通过促进EMT过程,为癌症的增殖和进展创造适宜的微环境。有文献报道了miR-744-3p控制的一种新的调控途径,它可以增强MMP-9在喉鳞癌中的表达,而MMP-9通过降解周围细胞外基质中的胶原基质促进喉癌细胞迁移[15]。因此MMP1、MMP2、MMP9都与喉癌的发生发展密切相关,可以作为喉癌的诊断和预后标志物。
3 细胞因子
血管内皮生长因子(vascular endothelial growth factor,VEGF)在肿瘤血管生成中发挥着重要作用,肿瘤的增殖和转移离不开血管生长。德国学者的一项研究指出,VEGF是在喉癌早期阶段的有效预后标志物[16]。CCL18是M2型肿瘤相关巨噬细胞分泌的细胞因子,参与了多个恶性肿瘤的进展过程。CCL18的表达量与喉癌的原发部位、肿瘤分级、临床分期、淋巴结转移及复发等因素相关,低表达CCL18组的喉癌患者5年生存期更长。因此CCL18可以作为喉癌的一个预后标志物[17]。肝细胞生长因子(hepatocyte growth factor,HGF)是间充质细胞因子,作为有效的促分裂原和促运动剂在肿瘤进展中起作用。王艳婷等[18]的研究指出,晚期和恶性程度高的LSCC患者血清HGF浓度显著高于早期和恶性程度低的患者。高HGF组喉癌患者5年期生存率显著低于低HGF组患者。HGF/c-Met信号传导途径可能是HGF调节肿瘤发生的重要途径。而巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)、糖原合成激酶-3(glycogen synthase kinase-3,GSK-3β)可能通过促进EMT过程影响了喉癌细胞的增殖和转移,可以用来判断喉癌的恶性程度及预后[19]。
4 非编码RNA
对于人类基因组来说,大约98%的基因是非编码的,非编码RNA可以在基因调控的各个方面都发挥着功能作用,如表观遗传调控、染色体失活、基因组印记、核质转运、转录和mRNA剪接等。可以作为喉癌生物标志物的非编码RNA主要是指微小RNA(microRNA,miRNA)和长链非编码RNA(long no-coding RNA,lncRNA)。喉鳞状细胞癌与非编码RNA的相关研究是当下喉癌生物标志物的研究热点。
miRNA是一种单链非编码小分子RNA,长度约为19~25个核苷酸,在肿瘤细胞的发生、侵袭和转移过程中发挥重要的调节作用。miRNA表达失调在各种肿瘤的发生、发展过程中起着重要的作用,可能成为理想的肿瘤治疗靶点。Fang等[20]研究者通过对96例喉癌及癌旁组织的研究发现,LSCC中miR-29c-3p表达下调与肿瘤范围、恶性程度及淋巴结转移等因素相关。并且miR-29c-3p低表达组的喉癌患者预后较差。miR-29c可抑制肿瘤细胞的生长和转移,并在G1期阻滞肿瘤细胞增殖[21]。Gao等[22]学者发现,miR-145-5p过表达或FSCN1敲低可以抑制EMT过程并诱导细胞周期阻滞和凋亡,从而抑制LSCC的生长、侵袭和转移。Wang等[23]使用RTPCR等方法检测了52例LSCC患者和49例声带息肉患者的血清标本,发现临床分期较晚和淋巴结转移的LSCC患者血清miR-21水平较高。一项国外的微阵列分析和qRT-PCR分析显示[24],miR-221在喉癌患者血清样本中上调,而手术后血清样本miR-221处于正常水平。因此miR-21可以用于喉癌的诊断及病情监测。一些文献也阐述了miRNA调控基因或者信号通路的可能机制。Zhang等[25]使用miRNA芯片分析了LSCC组织中的miRNA表达,发现喉癌组织中miR-143-3p较正常组织明显下调。miR-143-3p可能通过靶向k-Ras/Raf/MEK/ERK信号通路来抑制肿瘤细胞生长和转移。Zhao等[26]发现miR-196b在体外通过直接抑制SOCS2的表达,促进LSCC细胞的增殖和侵袭,抑制细胞凋亡。此外,miR-196b是LSCC患者总体生存的独立预后因素。Lucas等[27]的研究指出喉癌组与健康对照组相比,术前LSCC患者血清中miR-31、miR-141、miR-149a、miR-182、LET-7a、miR-4853p、miR-122、miR-33表达水平升高,而miR-145、miR-223、miR-133a表达水平明显下降。其中miR-31、LET-7a和miR-33作为新的、无创的LC诊断的生物标志物价值最高。miRNA与喉癌关系的最新研究情况,见表2。
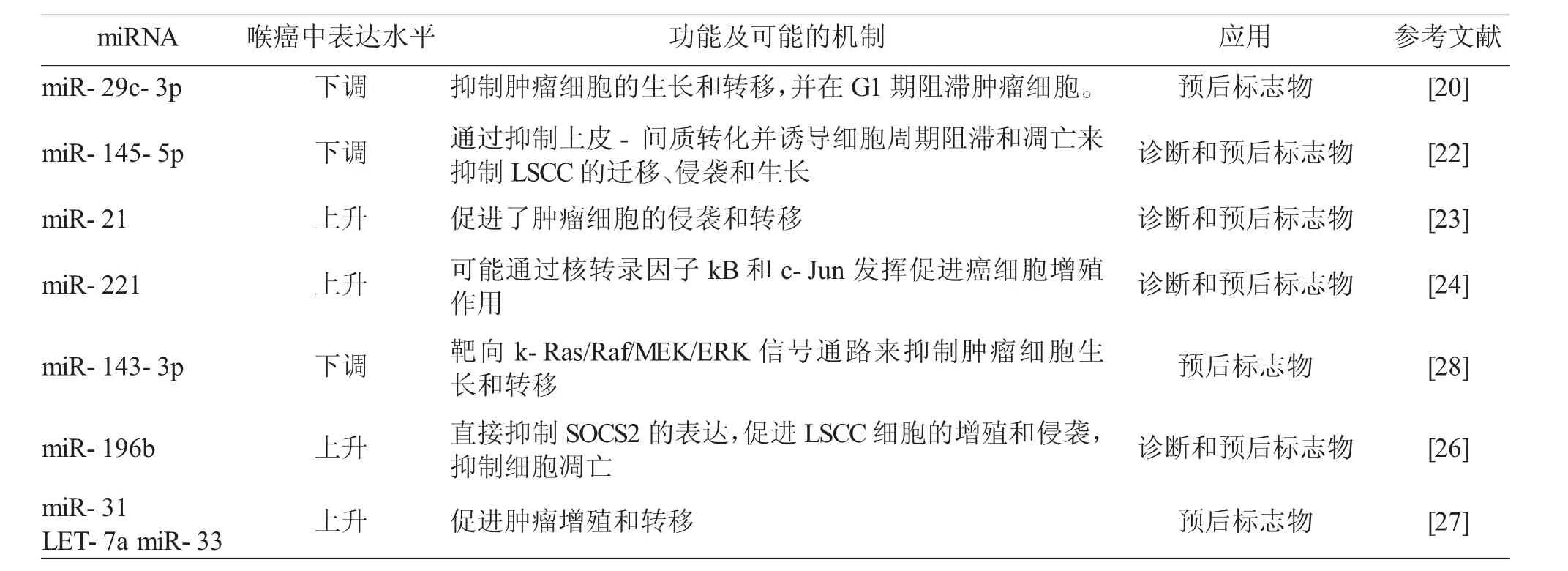
表2 miRNA与喉癌关系的最新研究
lncRNA是指长度超过200个核苷酸的一类特殊RNA,没有编码蛋白质的功能,但是却参与调控肿瘤发生和发展的多个进程。Tang等[29]用qRT PCR等技术验证了lncRNA DGCR5可以通过下调miR-506增加Wnt信号通路活性。汕头大学医学院第一附属医院的一项研究提示SNHG1在癌组织中的表达明显高于癌旁组织,SNHG1敲除可通过抑制EMT来抑制HEp-2细胞的侵袭和迁移[30]。不具有编码蛋白质功能的lncRNA需要通过一些调节轴来实现其功能。Xu等[31]研究者认为PCAT19基因的下调,可能通过调节miR 182/PDK4轴在体内抑制了喉癌细胞的生长。Zhang等[32]研究者发现了新的调节轴CCAT1-miR218-ZFX(其中CCAT1为lncRNA)在喉癌的增殖和转移过程中起到非常重要的作用。LncRNA可以通过影响靶基因的甲基化状态,从而影响基因表达。Wu等[33]的研究证实H19通过抑制miR-148a-3p增加DNA甲基化,从而促进了LSCC的进展。在河南省人民医院进行的一项研究[34],证明了lncRNA SOX2-OT的过表达在体外实验中促进了LSCC细胞的增殖、迁移、侵袭,抑制了细胞凋亡。SOX2-OT主要通过促进抑癌基因PTEN启动子甲基化,从而下调其表达来实现这一功能的。以上这六种lncRNA都在喉癌组织中高表达,同样也存在低表达的lncRNA。Xie等[35]研究者发现相比于癌旁组织,喉癌组织中LinRNA Dleu2含量明显降低,通过转染技术上调lncRNA Dleu2明显抑制了喉癌细胞的增殖、迁移和侵袭。有研究者发现lncRNA RP11-169D4.1可以作为喉癌的抑癌基因和治疗靶点,它是通过调控CDH1来抑制EMT的进程,进而抑制肿瘤细胞的侵袭和转移[36],与喉癌相关的lncRNA的最新研究情况,见表3。
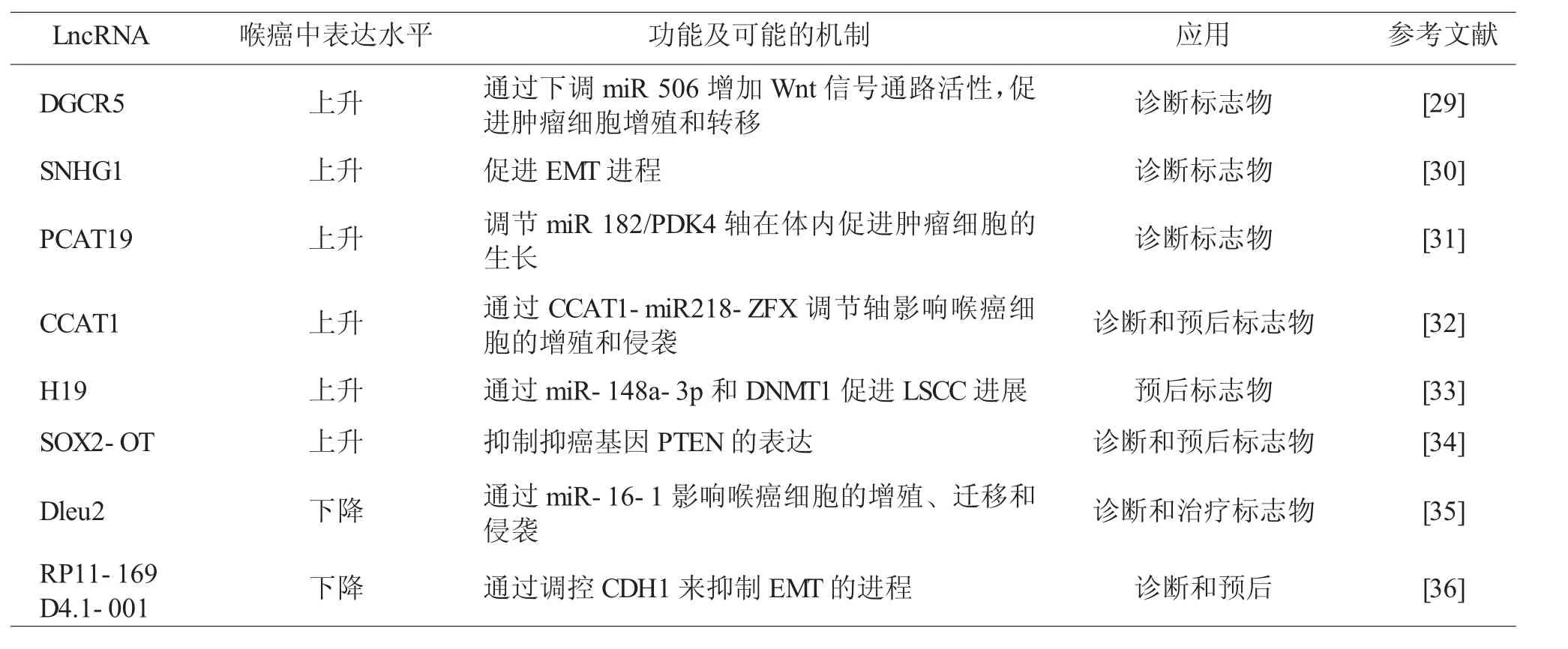
表3 与喉癌相关的lncRNA的最新研究
5 外泌体
外泌体是当前喉癌标志物的研究热点之一。外泌体是细胞外囊泡的最小子集,存在于细胞外空间和液体中,如血液、尿液和唾液。肿瘤来源的外泌体通过细胞间通讯和信号转导参与肿瘤发展的各个阶段。临床分期较晚和总生存期较短的头颈部鳞状细胞癌患者血浆外泌体水平升高,提示血浆外泌体可能用于监测头颈部肿瘤进展[37]。贾园静等[38]研究者通过对喉癌和下咽癌患者血清外泌体进行分析,发现喉癌组及下咽癌组的外泌体浓度与正常人相比显著增加,是十分有潜力的肿瘤标志物。
小结
LSCC中被研究的肿瘤标志物种类越来越多,这些都将有助于喉癌的早期诊断、早期治疗、判断预后及疾病监测。在基因层面的研究将有助于LSCC患者的靶向治疗。近年来喉癌标志物的研究热点是miRNA和lncRNA,研究者们发现,这些以前被忽视的RNA与喉癌的发生、侵袭和转移都存在着密切的联系。尽管这几年相关研究进展迅速,但是并没有发现喉鳞状细胞癌高度特异的非编码RNA。对临床上喉癌的诊断和治疗帮助不大,miRNA和lncRNA的检测具有高度稳定的优点,可以在血清,血浆,唾液等体液检测中得到快速的结果,并可以在治疗前后反复检测。因此,期望着这方面的研究可以找出特异性的喉癌诊断和预后标志物,从而为提高喉癌患者的生存率提供帮助。

