青霉素V钾片微生物限度检查方法适用性研究
李绪伦,任学毅
(重庆市食品药品检验检测研究院,重庆 401121)
青霉素V钾片可用于对青霉素敏感菌株所产生的轻、中度感染如扁桃体炎、咽喉炎、支气管炎、肺炎等疾病的治疗[1-2]。本研究拟按《中国药典》2020年版(四部)非无菌产品微生物限度检查:微生物计数法、控制菌检查法进行适用性试验[3-4],建立青霉素V钾片的微生物限度检查方法,供同行在工作中参考。
1 材料与仪器
青霉素V钾片[重庆科瑞制药(集团)有限公司,批号429001,规格0.236 g];胰酪大豆胨液体培养基(批号190516)、胰酪大豆胨琼脂培养基(批号190504)、沙氏葡萄糖琼脂培养基(批号1904102)、麦康凯液体培养基(批号1903162)、麦康凯琼脂培养基(批号190510)均由北京三药科技开发公司提供;电子天平[梅特勒托利多仪器(上海)有限公司];生化培养箱(重庆四达实验仪器公司);高压蒸汽灭菌器(日本HIRAYAMA仪器制造公司)。
2 方法和结果
2.1 需氧菌、霉菌和酵母菌总数计数
2.1.1 菌液制备 取经35 ℃培养24 h的金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌液体培养物分别用0.9%无菌氯化钠溶液稀释成适宜浓度的菌悬液;取经25 ℃培养24 h的白色念珠菌液体培养物用0.9%无菌氯化钠溶液稀释成适宜浓度的菌悬液,作活菌计数备用。取经25 ℃培养6 d的黑曲霉菌斜面培养物,加入含0.05%(体积比)聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱。吸出悬液(用管口带有薄无菌棉花或纱布能过滤菌丝的无菌毛细吸管)到无菌试管内,用0.9%无菌氯化钠溶液配成适宜浓度的孢子悬液,备用。
2.1.2 需氧菌总数计数 试验组:方法一,称取样品10 g,加入pH 7.0无菌氯化钠-蛋白胨缓冲液到100 mL,混匀,静置30 min,吸取上清液作为1∶10的供试液[3]。吸取1 mL到50 mL pH 7.0无菌氯化钠-蛋白胨缓冲液中,进行薄膜过滤,再用0.1%蛋白胨缓冲液600 mL分6次冲洗(每次100 mL),在末次冲洗液中加入1 mL含菌量≤100 cfu的试验菌,将薄膜贴在胰酪大豆胨琼脂平板上,按规定温度进行培养,然后记录结果。方法二,吸取1 mL供试液到50 mL pH 7.0无菌氯化钠-蛋白胨缓冲液中,进行薄膜过滤,再用0.1%蛋白胨缓冲液800 mL分8次进行冲洗(每次100 mL),在末次冲洗液中加入 1 mL 含菌量≤100 cfu的试验菌,将薄膜贴在胰酪大豆胨琼脂平板上(每200 mL含400万单位青霉素酶),按规定温度进行培养,然后记录结果。方法三,吸取1 mL供试液到50 mL pH 7.0无菌氯化钠-蛋白胨缓冲液中,进行薄膜过滤,再用0.1%蛋白胨缓冲液800 mL分8次进行冲洗(每次100 mL),在末次冲洗液中加入 1 mL 含菌量≤100 cfu的试验菌,将薄膜贴在胰酪大豆胨琼脂平板(每200 mL含1 000万单位青霉素酶),按规定温度进行培养,然后记录结果。
菌液组:用稀释液代替供试液,与试验组的操作相同(培养基不含青霉素酶),按规定温度进行培养,然后记录结果。
供试液对照组:用稀释液代替菌液,与试验组的操作相同,按规定温度进行培养,然后记录结果。
稀释剂对照组:用稀释液代替供试液,与试验组的操作相同,按规定温度进行培养,然后记录结果。
阴性对照组:用稀释液代替供试液、菌液,与供试液对照组的操作相同,按规定温度进行培养,然后记录结果。另做空白对照。
菌株回收率(0.5~2.0)=(试验组菌数-供试液对照组菌数)/菌液组菌数。见表1。
2.1.3 霉菌和酵母菌总数计数 试验组:方法一,称取样品10 g,加入pH 7.0无菌氯化钠-蛋白胨缓冲液到 100 mL 制成1∶10的供试液,加入适宜浓度的菌悬液使每1 mL供试液含菌量≤100 cfu,混匀,再吸取1 mL到平皿中,依法检查,观察记录结果。方法二,称取样品2 g,加入pH 7.0无菌氯化钠-蛋白胨缓冲液到100 mL制成浓度为1∶50的供试液,加入适宜浓度的菌悬液使每 1 mL 供试液含菌量≤100 cfu,混匀,再吸取1 mL到平皿中,立即倒入沙氏葡萄糖琼脂培养基,待凝固后,按规定温度进行培养,观察记录结果。
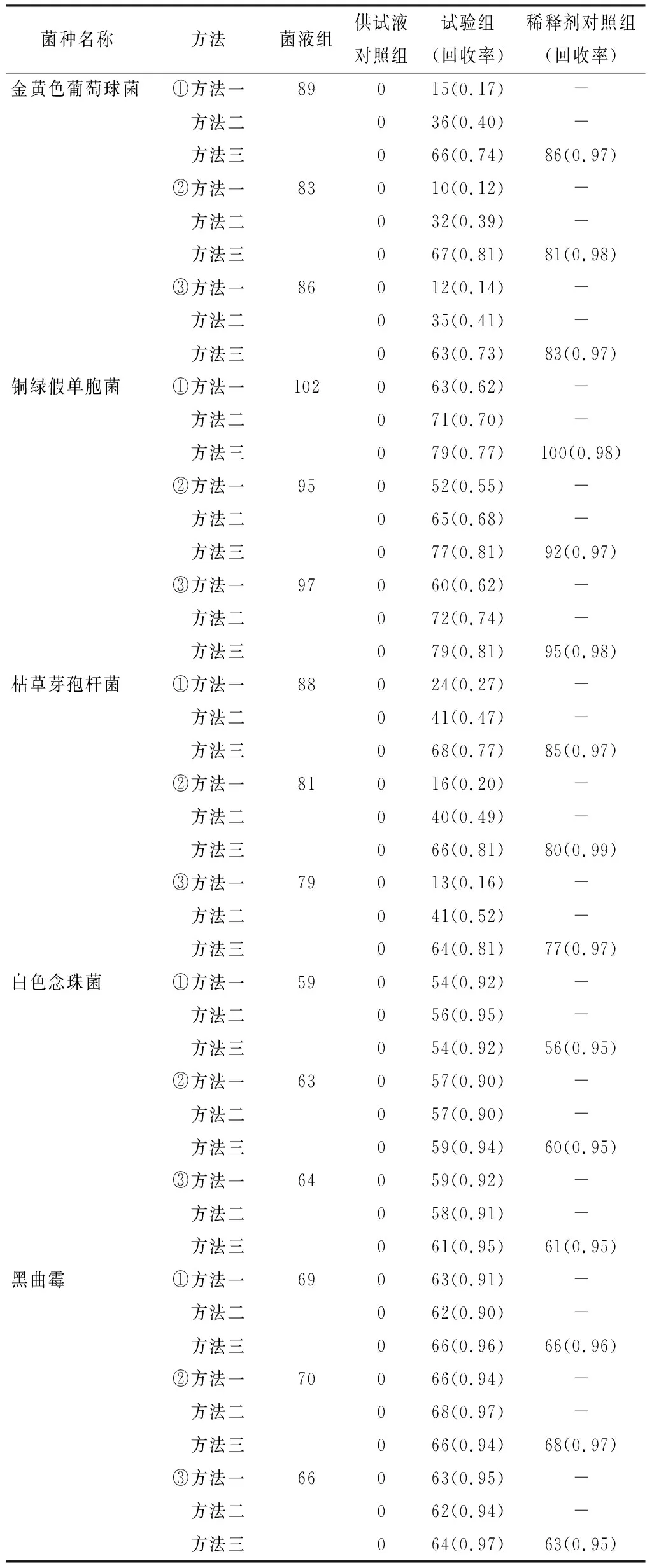
表1 需氧菌总数计数试验结果
菌液组:用稀释液作供试液,与试验组进行相同操作,按规定温度进行培养,观察结果。
供试液对照组:以稀释液代替菌液同实验组操作,按规定温度进行培养,观察记录结果。
阴性对照组:用稀释液代替供试液、菌液,与试验组进行相同操作,按规定温度进行培养,观察记录结果。另做空白对照。
菌株回收率(0.5~2.0)=(试验组菌数-供试液对照组菌数)/菌液组菌数。见表2。
2.1.4 方法适用性试验结果 本品按《中国药典》2020年版(四部)通则[4]的需氧菌、霉菌和酵母菌数总数计数方法进行适用性试验,3次平行试验结果显示,本品对金黄色葡萄球菌、铜绿假单胞菌、枯草杆菌均有抑菌作用,依法配制成供试液进行薄膜过滤后,用0.1%蛋白胨缓冲液800 mL分8次进行冲洗(每次100 mL),再将膜贴于胰酪大豆胨琼脂平板(每200 mL含1 000万单位青霉素酶)进行计数检查的方法,可以较好去除本品的抑菌性[5]。本品对白色念珠菌、黑曲霉无明显抑菌作用。
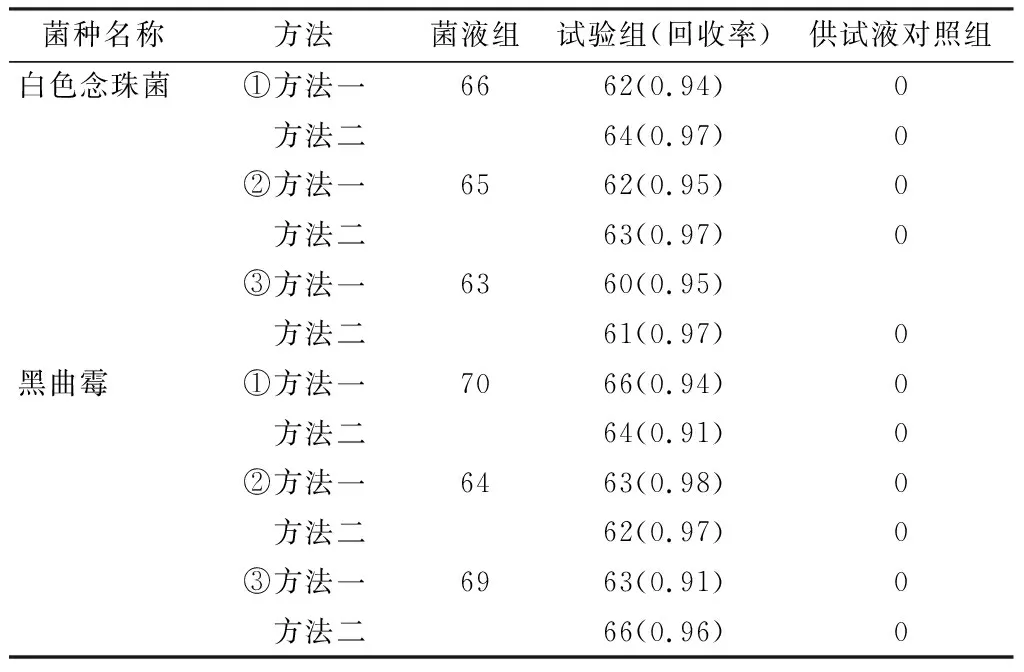
表2 霉菌和酵母菌总数计数试验结果
2.2 大肠埃希菌检查
取经35 ℃培养24 h的大肠埃希菌[CMCC(B)44102]胰酪大豆胨液体培养基培养物用0.9%无菌氯化钠溶液稀释至每毫升含≤100 cfu的菌悬液备用。称取样品10 g,加入pH 7.0无菌氯化钠-蛋白胨缓冲液到100 mL,混匀,静置,吸取上清液作为1∶10供试液备用。
试验组:方法一,吸取1∶10供试液10 mL到100 mL pH 7.0无菌氯化钠-蛋白胨缓冲液,薄膜过滤,用0.1%蛋白胨缓冲液500 mL分5次进行冲洗(每次100 mL),在末次冲洗液中加入1 mL含菌量≤100 cfu大肠埃希菌菌悬液,将膜放入100 mL胰酪大豆胨液体培养基中,依法检查,观察结果。方法二,吸取1:10供试液10 mL到100 mL pH 7.0无菌氯化钠-蛋白胨缓冲液,薄膜过滤,用0.1%蛋白胨缓冲液800 mL分8次进行冲洗(每次 100 mL),在末次冲洗液中加入1 mL含菌量≤100 cfu大肠埃希菌菌悬液,将膜放入100 mL胰酪大豆胨液体培养基中,依法检查,观察结果。
样品组:以稀释液代替菌液,同试验组进行相同操作,观察结果。
阳性对照:以稀释液代替供试液,同试验组进行相同操作,观察结果。
阴性对照:以稀释液代替供试液、菌液,同试验组进行相同操作,观察结果。
结果见表3。本品按《中国药典》2020年版(四部)通则[4]进行大肠埃希菌检查方法适用性试验,结果显示,本品对大肠埃希菌均有较强抑菌作用,采用吸取 1∶10 供试液10 mL到100 mL pH 7.0无菌氯化钠-蛋白胨缓冲液中,进行薄膜过滤后,用0.1%蛋白胨缓冲液 500 mL 分5次冲洗(每次100 mL),再将膜放入100 mL胰酪大豆胨液体培养基中检查的方法,可以较好地去除本品对大肠埃希菌的抑菌性。
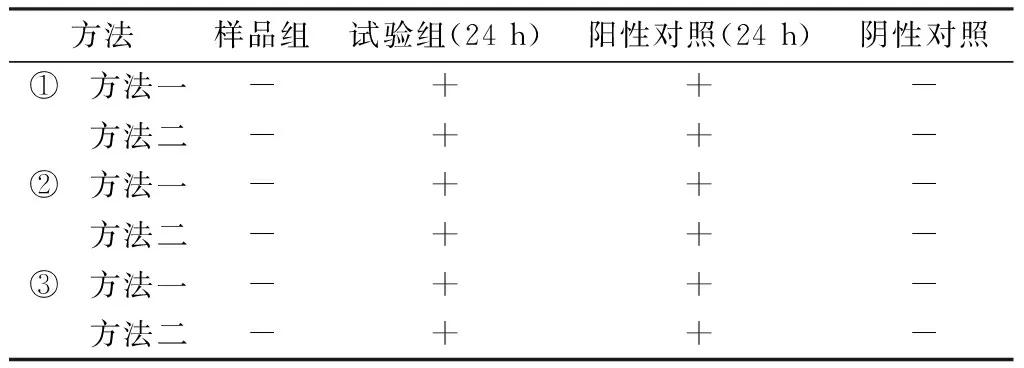
表3 大肠埃希菌验证试验结果
2.3 结论
青霉素V钾片按《中国药典》2020年版(四部)通则[4]进行的微生物限度检查方法适用性试验,试验结果显示可采用如下方法进行检查[6]:称取本品10 g,加入pH 7.0无菌氯化钠-蛋白胨缓冲液到100 mL,摇匀,静置30 min,吸取上清液作为1∶10的供试液。取1∶10的供试液1 mL到50 mL pH 7.0无菌氯化钠-蛋白胨缓冲液中,进行薄膜过滤后,再用0.1%的蛋白胨缓冲液 800 mL 分8次冲洗(每次100 mL),将薄膜贴在胰酪大豆胨琼脂平板上(每200 mL含1000万单位青霉素酶),依法进行需氧菌总数计数;吸取1∶10的供试液1 mL,依法进行霉菌和酵母菌总数计数;吸取1∶10供试液 10 mL 到100 mL pH 7.0无菌氯化钠-蛋白胨缓冲液中,进行薄膜过滤,再用0.1%蛋白胨缓冲液500 mL分5次冲洗(每次100 mL),将薄膜放入100 mL胰酪大豆胨液体培养基,依法进行大肠埃希菌检查。样品检查结果应符合《中国药典》2020年版(四部)规定[4]。
3 讨论
本试验采用薄膜过滤法,是为了减少供试液基质或辅料在过滤过程中堵塞滤膜,导致过滤不畅、过滤时间延长或抽坏滤膜,从而使冲洗液不能进行有效过滤。这是因为供试液存在一个沉降系数的问题,而沉降系数又与菌的形态、大小、种类等有关,因此不同菌种采用低速离心后所得到的回收率差异较大,严重影响了检验的结果[7-9]。同时在进行低速离心试验时,样品里的不溶性物质对样品中所含的微生物还具有一定的携带作用[3],尤其当制剂中含有不溶性辅料时,其携带作用更强。因此,本品在试验过程处理中不可采用离心沉淀法,建议试验过程中采用静置吸取其上清液[8]进行薄膜过滤。
由于青霉素V钾片属于β-内酰胺类抗生素,对细菌具有较强抗菌活性,但对真菌无抗菌活性,青霉素酶可以在一定程度消除其抗菌活性,故可采用薄膜过滤法与中和法联用进行检查。同时对于β-内酰胺类抗生素均可采用β-内酰胺酶消除其抗菌活性的检查方法再加上薄膜过滤能有效的消除青霉素类药物的抗菌活性。控制菌检查采用薄膜过滤法,应根据《中国药典》2020年(四部)[4]要求在方法中明确冲洗后滤膜接种至胰蛋白胨大豆肉汤(TSB)培养基的体积[7,10]。由于各个厂家产品处方工艺存在一定差异,导致其抑菌程度不尽相同,可能加酶的浓度和冲洗的量及次数也不尽相同,但大致的方向是可以借鉴的。该法可为不同厂家生产的同类药品的微生物限度检查方法验证提供参考[6]。

