ChIL-2-ChIL-4融合基因重组质粒遗传稳定性研究
郑龙龙 ,张 黎 ,郝思源,郝飞飞,白 瑞,霍乃蕊,郑明学,谭 凡
(山西农业大学动物医学学院,太谷 030801)
白细胞介素(Interleukin,IL)作为细胞因子的一员,是家禽机体固有免疫调节和特异性免疫启动的关键信号。生物活性的IL-2和IL-4蛋白可通过增强目前常见的各类型商品化疫苗免疫反应的过程,诱导产生更加快速、高效、持久的中和抗体,作为一种新的免疫增强剂在疫苗研究领域受到广泛研究与应用。
2018年,本课题组成员贡鑫等[1]成功构建了ChIL-2和ChIL-4的融合基因表达载体 pCI-ChIL-2-ChIL-4-EGFP,作为鸡球虫病三价四株早熟弱毒活疫苗的免疫佐剂。该载体表达分泌的ChIL-4-ChIL-2融合蛋白可增强鸡球虫病活疫苗的免疫保护力,降低活疫苗的副作用。
生物制品从微量的试验阶段进入商业化批量生产阶段,最终进入复杂的田间应用阶段,须验证种质库资源是否能够保持安全、稳定、质量可控的状态[2]。因此,本文通过研究DH5α/pUC57 pCIChIL-2-ChIL-4-EGFP重组菌的形态、生化特性、质粒丢失率、质粒超螺旋比、目的基因稳定性等指标,对后续大规模的生产研究及产品质量控制的建立提供试验数据支撑,对潜在的田间应用具有指导性意义。
1 材料与方法
1.1 材料与仪器
DH5α/pUC57 重组菌和 pCI-ChIL-2-ChIL-4-EGFP重组质粒由山西农业大学兽医病理实验室构建保存。EcoRI (TaKaRa,AGZ0312A)、SalI (Ta-KaRa,AGY1010A)、无内毒素质粒DNA小量抽提试剂盒[生工生物工程(上海)股份有限公司,D629KA5985]、全波长酶标仪(Thermo Fisher Scientific, MultiskanTMFC )、 PCR仪(Bio-Rad,S1000TM)、内毒素检测仪(安度斯生物有限公司,S-0704)。
1.2 试验方法
1.2.1 重组菌株传代
DH5α/pUC57 重组菌使用接种环划线接种于无菌37℃ 溶菌肉汤(lysogeny broth,LB )平板,避光倒置培养12 h,选取单个菌落混合10.0 mL含Amp+(Ampicillin)的LB液体培养基,作为原始菌(0代);抽取重组菌菌液0.5 mL混合于50.0 mL无菌LB Amp+液体培养基,37℃避光220 r/min振荡培养12 h,连续传30 代。
1.2.2 重组菌株遗传稳定性鉴定
取5×n(n=0~6)代重组菌,通过革兰氏染色和特定糖发酵试验鉴定重组菌的形态和生化特性。
1.2.3 重组菌纯粹性检验
根据《中国兽药典》纯粹性检验方法[3],无菌固体LB/GP斜面培养基试管涂布0.2 mL菌液,无菌条件下分别置于37℃和25℃避光培养。
1.2.4 重组菌分子生物学鉴定
由生工生物工程(上海)股份有限公司根据DH5α工程菌16S rDNA序列合成引物,F:5′-AGAGTTTGATCCTGGCTCAG-3′,R :5′-TACGGTTACCTTGTTACGACTT-3′[4]。使用DNA提取试剂盒提取总DNA进行PCR扩增,扩增目标大小为1.2 kb的宿主菌序列,阳性产物进行基因测序。利用NCBI网站的BLAST在线工具进行序列比对,同源性大于95% 时判定为大肠杆菌属[5]。
取5×n(n=0~6)代的重组菌菌液2.0 mL提取重组质粒,按酶切试剂说明书配置酶切体系,37℃水浴 15 min,酶切产物在120 V电压下经1.5% 琼脂糖凝胶电泳20 min后进行检测。通过Image Lab 4.1软件计算重组质粒的超螺旋体质粒及各类质粒构型的图像像素点的比值,得出超螺旋体质粒在总质粒量的百分比;并对质粒目的片段进行测序,测序结果与ChIL-2和ChIL-4基因比对。
1.2.5 重组质粒丢失率检测
参考吴昊[6]完善的检测DH5α/pUC57 重组菌质粒丢失率的方式,随机选择100个长势良好的单个菌落,接种于含Amp+的无菌LB 固体培养皿上,37℃条件下无菌培养12 h。统计无污染的目的菌落数量,按以下公式计算质粒丢失率:
质粒丢失率=(100-平板上菌落数)/100×100%。
1.2.6 重组质粒细胞转染与表达效果测定
生物安全柜内吹打猪睾丸细胞(swine testis,ST)制成细胞悬液,每孔细胞培养板(24 孔)接种1.0×105个细胞,37℃、5% CO2进行培养, 贴壁率达到80%~90% 时进行细胞转染,分为空白组、空载组、试验组。弃掉培养液,用无血清DMEM(Dulbecco’s modified Eagle medium)培养液洗2 次,V(重组质粒)∶V(HilyMax转染试剂)=1∶3 缓缓混匀,室温静置15 min,混合物均匀加入细胞孔中。加入质粒后 37℃孵育4 h,替换无抗生素的含5%的胎牛血清DMEM培养基培养48 h,倒置荧光显微镜下观察阳性转染细胞的绿色荧光信号(观察时间<30 min)。以Image J软件分析视野中绿色荧光的累积光密度值作为融合蛋白表达量的指标,绿色荧光信号的百分比平均值作为ST细胞的转染率。
1.2.7 重组质粒表达产物生物活性测定
无菌分离10日龄无特定病原体(specific pathogen free,SPF)雏鸡脾脏淋巴细胞,每孔1.0×107个细胞分装入6孔板,然后每孔加入1.0 mg/mL ConA 40.0 µL培养48 h。离心收集细胞,用RPIM(Roswell Park Memorial Institute)1640培养基重悬细胞后,96孔板每孔加入2.5×105个细胞,空白组不加细胞;试验组加入含质粒的ST细胞上清液50.0 µL;细胞对照组加入50.0 µL 空载体转染细胞上清液;空白组加50.0 µL RPMI 1640+50 µL DMEM培养基。上述细胞在5% CO2、37℃培养36 h后,每孔加入四甲基偶氨唑盐 (methyl thiazolyl tetrazolium,MTT)10.0 µL混匀,常温避光静置孵育4 h,震荡后混匀用全波长酶标仪测定波长490 nm处的光密度(optical density,OD)。MTT结果以刺激指数(lymphocyte stimulation index,SI)表示,SI的计算公式为 :SI=(试验组OD490nm-空白组OD490nm)/(细胞对照组OD490nm-空白组OD490nm)。
2 结果与分析
2.1 纯粹性
DH5α/pUC57重组菌5×n(n=0~6)代接种硫乙醇酸盐培养基小管与流体葡萄糖蛋白胨培养基小管,未见杂菌污染;菌落边缘光滑,有特殊的光泽,呈颜色一致的灰白色半透明状,培养基中未出现其他形态的菌落。
2.2 革兰氏染色
革兰氏染色DH5α/pUC57重组菌,5×n(n=0~6)代均为革兰氏阴性(Gram negative bacillus,G-)短杆菌,形态无明显差异,详见图1。

图1 原代和30 代重组菌革兰氏染色Fig. 1 Original and 30 generation recombinant bacteria gram staining
2.3 特定糖发酵
DH5α/pUC57重组菌5×n(n=0~6)代均接种乳糖生化管,培养基颜色为均一的紫色;接种葡萄糖生化管与甘露醇生化管,培养基颜色为均一的黄色;各组生化管内均没有观察到气体产生,生化特性一致。具体情况见图2。

图2 重组菌糖发酵试验Fig. 2 Sugar fermentation test of recombinant bacteria
2.4 质粒丢失率
挑取100个5×n(n=0~6)代DH5α/pUC57重组菌的单个菌落,接种于含Amp+的LB 固体培养皿上,37℃条件下无菌培养12 h均形成单菌落,经计算质粒丢失率均为0。
2.5 分子生物学鉴定
2.5.1 DH5α工程菌16S rDNA 鉴定
以5×n(n=0~6)代总DNA为模板,根据DH5α工程菌16S rDNA序列合成引物,5×n(n=0~6)代均扩增出1.2 kb大小相似的片段(图3)。使用5 000 bp DNA Marker作为参照,由图3可知,5×n(n=1~6)代与原代扩增得到的条带大小一致,说明目的片段在传代过程中未丢失。
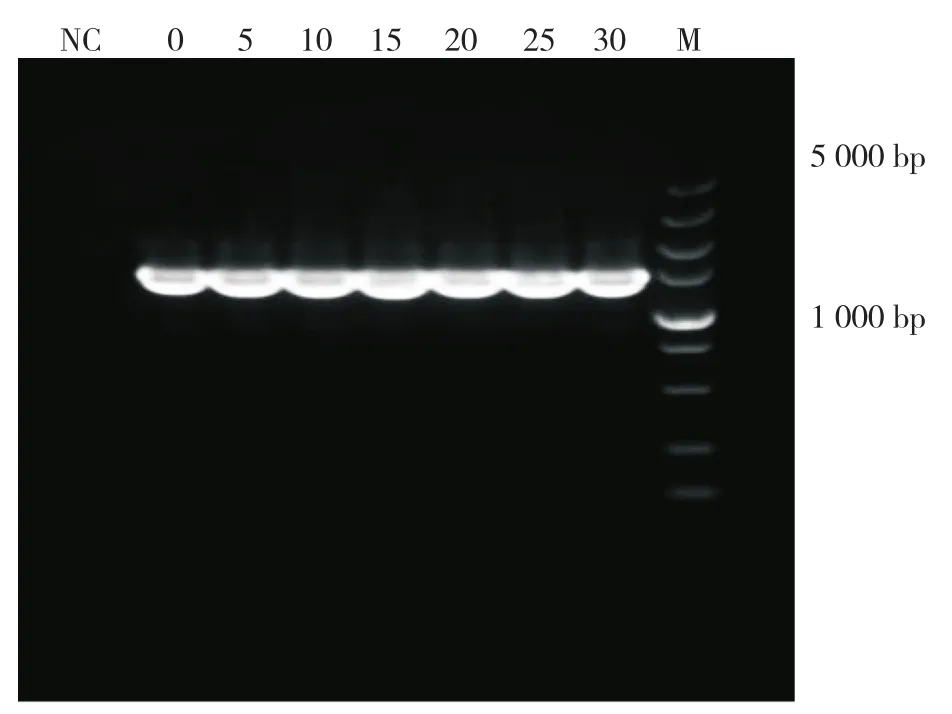
图3 DH5α工程菌16S rDNA PCR鉴定Fig. 3 16S rDNA PCR identification of DH5α
2.5.2 质粒双酶切及测序
DH5α/pUC57重组菌5×n(n=0~6)代的重组质粒经性能稳定的限制性内切酶EcoRI和SalI双酶切鉴定,882 bp和4.7 kb附近出现固定的条带(图4),且质粒超螺旋比均大于90%。

图4 重组质粒双酶切鉴定Fig. 4 Double enzyme digestion identification of recombinant plasmid
2.5.3 DH5α 16S rDNA 和ChIL-2-ChIL-4基因测序结果
对DH5α/pUC57重组菌5×n(n=0~6)代16S rDNA PCR产物进行测序,结果采用NCBI网站中的BLAST在线工具与大肠杆菌进行同源性分析,结果显示,各代次重组菌与大肠杆菌同源性均大于95%,详见表1。5×n(n=0~6)代重组质粒中的目的片段与ChIL-2-ChIL-4基因序列100% 匹配。

表1 DH5α 16S rDNA 测序结果Tab. 1 DH5α 16S rDNA sequencing results
2.6 细胞转染与表达效果
2.6.1 细胞转染效果
各代次重组质粒转染ST细胞48 h时,细胞转染率无显著差异(P>0.05),详见图5。
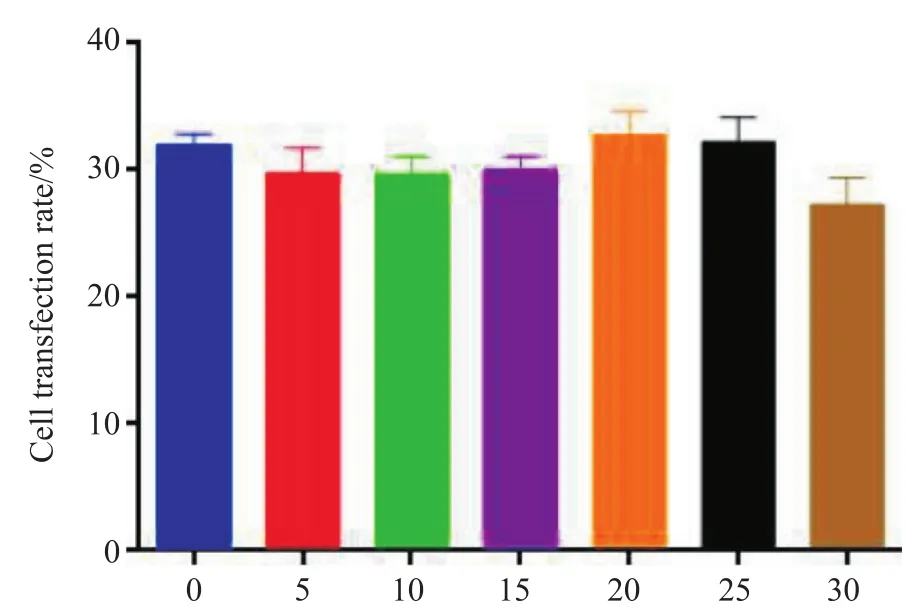
图5 各代次重组质粒细胞转染率Fig. 5 Transfection rate of each generation of recombinant plasmid
2.6.2 转染细胞的融合蛋白表达效果
重组质粒在ST细胞内的ChIL-2-ChIL-4 蛋白表达量,在各代次之间无显著性的差异(P>0.05),详见图6。

图6 各代次蛋白相对表达量Fig. 6 Protein relative expression of each generation
2.7 表达分泌产物活性
各代次重组质粒在ST细胞中分泌表达的ChIL-2-ChIL-4 融合蛋白均能极显著地(P<0.001)促进鸡脾淋巴细胞增殖,且其促进雏鸡脾脏淋巴细胞细胞增殖的能力无显著差异(P>0.05),详见图7。
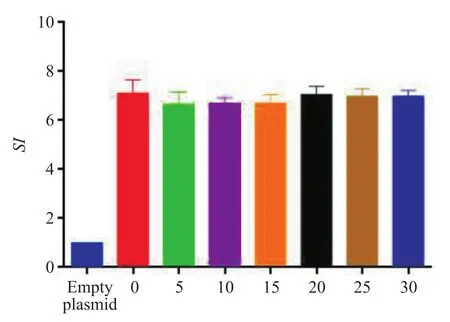
图7 各代次蛋白刺激指数Fig. 7 SI of each generation of protein
3 讨论
重组质粒的遗传稳定性是实验室高效表达生物活性物质商业化的主要阻力和限制性因素[7-10]。能否有条件形成工业化生产能力,提供足量可靠的表达产物是确定其应用规模的重要指标。重组质粒的存在对菌株的生长常造成一定的压力,导致其生长特性可能发生变化。研究证实,培养体系加入一定的筛选压力(如抗生素)可以显著提高重组质粒的稳定性,避免杂菌的生长[11-14]。
DH5α重组菌连续快速迭代的过程中,质粒时常分裂延迟,造成重组菌丢失目的质粒。因此,验证重组菌携带的质粒的稳定性是成功培养高质量重组工程菌的关键。本研究结果与Zhou等[15]试验结果一致,0~30代重组菌菌落形态均匀一致,符合DH5α大肠杆菌的典型菌落特征,且染色镜检未发现杂菌污染。16S rDNA序列的同源性大于97%的细菌可认为是同一种属[16-17]。本研究中的重组菌其16S rDNA序列同源性为98%~99%,说明重组质粒对宿主菌的生长无显著的影响。质粒丢失率为0,说明未出现分裂不稳定性现象。研究表明,重组菌连续传代30代仍能够保证极高的菌株纯粹性、不发生质粒丢失的现象,稳定的目的片段遗传稳定性,且质粒超螺旋比均大于90%,目的片段与ChIL-2-ChIL-4基因序列100%匹配。
白介素类疫苗佐剂商品化的过程需要保证重组质粒的持久的遗传稳定性,这对于基因佐剂的临床应用及科学研究具有重要意义。本研究表明,携带ChIL-2-ChIL-4融合基因片段的DH5α/pUC57重组菌37℃传代 30 次,重组质粒可保持较高的遗传稳定性,能够在大规模生产过程中保持细胞因子产物的均一性,具有作为鸡球虫活疫苗免疫佐剂的商品化临床应用潜力。

