casper斑马鱼体色观察及过表达mitfa对其体色发育的影响
张广婧,王 梅,刘利生,张永勤,彭亮跃,刘文彬,肖亚梅,刘锦辉
(省部共建淡水鱼类发育生物学国家重点实验室,湖南师范大学生命科学学院,长沙 410081)
鱼类主要通过几种色素细胞将色素保留在细胞内从而形成特定的图案和体色[1-3]。鱼类的不同体色主要取决于鳞片和皮肤含有的色素细胞及其不同的数量分布,鱼鳍和鳞片都是皮肤的衍生物,所以鱼类的体色观察常以鱼鳍和鳞片为材料[4]。在鱼类中色素细胞有黑色素细胞、黄色素细胞、红色素细胞、虹彩细胞、白色素细胞和蓝色素细胞六种[5-6]。2017年,林金杏等[7]研究报道了野生型斑马鱼体表有黑色素细胞、黄色素细胞和虹彩细胞三种类型色素细胞,但鳍和鳞片在色素细胞组成和分布上存在着差异,鳞片中色素细胞的种类和形态特征较鳍中色素细胞更丰富。目前,对于硬骨鱼类体色的报道鲜少,尤其是斑马鱼其他品系。nacre斑马鱼品系[8]由mitfa基因突变而来,而roy orbin斑马鱼品系[9]则是因为编码线粒体内膜蛋白的mpv17基因内含子缺陷所导致的。casper突变体是一种nacre与roy orbin杂交选育得到的双基因突变斑马鱼品系(mitfaw2/w2;roya9/a9)[10-11]。casper斑马鱼的特点是全身透明无黑色素细胞,是较为优选的鱼类试验材料,但对于其体色的研究资料尚未完善。
处在真皮层的黑色素细胞在特定的细胞器——黑素体中将酪氨酸通过酪氨酸酶的作用氧化成多巴,随后发生异构化和脱羧等作用,生成为5,6-二羟基吲哚(5,6-dihydroxyindole,DHI),再经过一系列复杂的氧化反应最终产生吲哚聚合体,即黑色素[10]。小眼畸形相关转录因子(microphtalmiaassociated transcription factor,MITF)的基因在斑马鱼中存在mitfa和mitfb两个亚型,mitfa是检测具有多种分化潜能的神经嵴细胞转变成为黑色素细胞时的标记基因之一,并且在黑色素细胞分化、迁移的过程中发挥着决定性的作用[13-14]。已有研究表明:Wnt基因主要与黑色素细胞的分化有关,参与早期神经嵴细胞分化成黑色素细胞;Wnt 通路主要是通过上游基因系列反应,使β-catenin在细胞内积累,稍后通过与LEF(lymphoid enhancing factor)结合,启动LEF与MITF转录因子的结合位点,进而激活MITF的表达,促进黑色素细胞的分化或黑色素的生成[15]。mitfa基因一方面受MC1R/ASIP/a-MSH、Wnt/β-Catenin及c-Kit/SCF信号通路的调节,另一方面通过bHLHZip结构域与酪氨酸基因家族启动子的E-box以及M-box (CAT-GTG)结合后激活相关基因的表达,进而影响黑色素的生成[16-17]。而且MITF还能影响周期素依赖性激酶2(cyclin-dependent kinase 2,cdk2)、T-box 转录因子2(T-box transcription factor 2,tbx2)和周期素依赖性激酶抑制因子p21等来调控黑色素细胞的生长发育[4]。2005年,姚纪花等[18]的研究中干扰了mitfa基因,导致体表黑色素细胞减少。除此之外,较多的研究表明mitfa的突变都会导致黑色素细胞发生变化。但对于mitfa基因的过量表达并未有相关报道。因此,本研究通过在casper透明斑马鱼中过表达mitfa基因,同时观察比较分析野生型斑马鱼、casper斑马鱼以及过表达mitfa的casper斑马鱼之间在体色发生的不同时期和不同组织中色素细胞的差异变化,探讨mitfa基因的表达与斑马鱼体色变异的关系,从而为鱼类体色变异的分子机制研究和观赏鱼类品种体色遗传选育改良提供基础。
1 材料与方法
1.1 试验材料
试验所用野生型AB斑马鱼(Danio rerio)和casper斑马鱼均来自中科院水生所国家斑马鱼资源中心。
1.2 野生型斑马鱼和casper斑马鱼鱼鳍、鳞片的取样与色素细胞的观察
将野生型斑马鱼和casper斑马鱼用MS-222麻醉后,使用经75%酒精消毒后的手术剪刀于体视显微镜下分别完整剪取臀鳍和背鳍,并用消毒过的镊子轻轻夹取鳍条基部附近的鳞片。因斑马鱼鳍条与鳞片较薄且透明,在经过生理盐水清洗干净后,可置于载玻片上制成临时玻片,使用体视显微镜观察玻片并对色素细胞的形态和分布进行记录。
1.3 casper斑马鱼胚胎的获取与其早期发育过程体色的观察
取性成熟的casper斑马鱼,将雌鱼和雄鱼分别置于催产盒中,并用隔板隔开,避光置于28.5℃下过夜。第二天早上给予光照刺激并撤去隔板,待产卵后,收集得到胚胎。将胚胎清洗后在体视显微镜下观察其在不同胚胎发育过程中以及幼苗出膜后体色的变化。
1.4 mitfa基因的过表达
首先使用HiPure Total RNA Midi Kit RNA提取试剂盒(Magen公司,R4124)进行斑马鱼胚胎RNA的提取,再用反转录试剂盒(TAKARA公司,RR047A)进行反转录得到斑马鱼cDNA。根据NCBI基因库中上传的斑马鱼mitfa基因序列(NM_130923)筛选得到其MITF的蛋白编码区(coding sequence,CDS)比较过表达所选择的质粒载体与基因序列,筛选得到Hind III与NheI双酶切位点。使用引物设计原则在CDS区上下游两端设计带有人工添加酶切位点的引物。以反转录得到的斑马鱼cDNA为模板,加入设计的引物,进行PCR扩增,得到目的片段。将其与p-Tol2-EGFP质粒载体进行连接得到重组质粒p-Tol2-mitfa过表达重组质粒。在显微注射仪上将所构建的过表达质粒显微注射casper斑马鱼胚胎,显微注射的质粒的质量浓度控制在100~200 ng/μL之间,并且注射p-Tol2-EGFP质粒载体作为对照,之后在荧光显微镜下观察质粒的表达情况。
2 结果与分析
2.1 casper斑马鱼体色的色素细胞观察
野生型斑马鱼的鱼鳍分为具有条纹的鱼鳍和无条纹的鱼鳍两种,例如,臀鳍和尾鳍具有条纹,而背鳍、胸鳍、腹鳍没有条纹。本文分别选择了具有条纹的臀鳍和无条纹的背鳍的野生型(wild type,WT)斑马鱼与casper斑马鱼进行对比观察(图1)。在显微镜下观察到casper斑马鱼的臀鳍处由黄色和橙黄色的黄色素细胞疏密分布形成黄色条纹(图2a),背鳍上则均匀地分布着大量黄色素细胞(图2b),而casper斑马鱼背部鳞片中,仅可见部分黄色素细胞,而无黑色素细胞(图2c)。此外,观察到野生型斑马鱼与casper斑马鱼在体色上存在显著的差异,但无论是野生型斑马鱼还是casper斑马鱼,黄色素细胞在背鳍上呈颗粒状,在背部鳞片上呈现出树突状。

图1 野生型斑马鱼和casper斑马鱼臀鳍、背鳍、背部鳞片观察点Fig. 1 Observation points of wild-type zebrafish and casper zebrafish anal fin, dorsal fin, and back scales
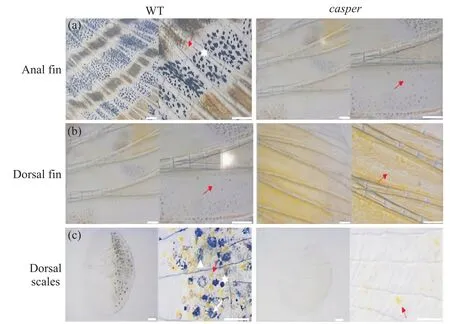
图2 野生型斑马鱼和casper斑马鱼臀鳍、背鳍、背部鳞片色素细胞观察Fig. 2 Observation of pigment cells in anal, dorsal and dorsal scales of wild-type zebrafish and casper zebrafish
2.2 casper斑马鱼早期体色发育的观察
比较野生型斑马鱼与casper斑马鱼(图3),发现两者在发育过程中形态结构无显著差别,在体色发育过程中明显观察到野生型斑马鱼有黑色素细胞的分布以及产生的系列变化(图3红箭头所指),而在casper斑马鱼中其体色大多数是由黄色和橙黄色的黄色素细胞疏密分布形成黄色条纹,并未观察到黑色素细胞的存在。
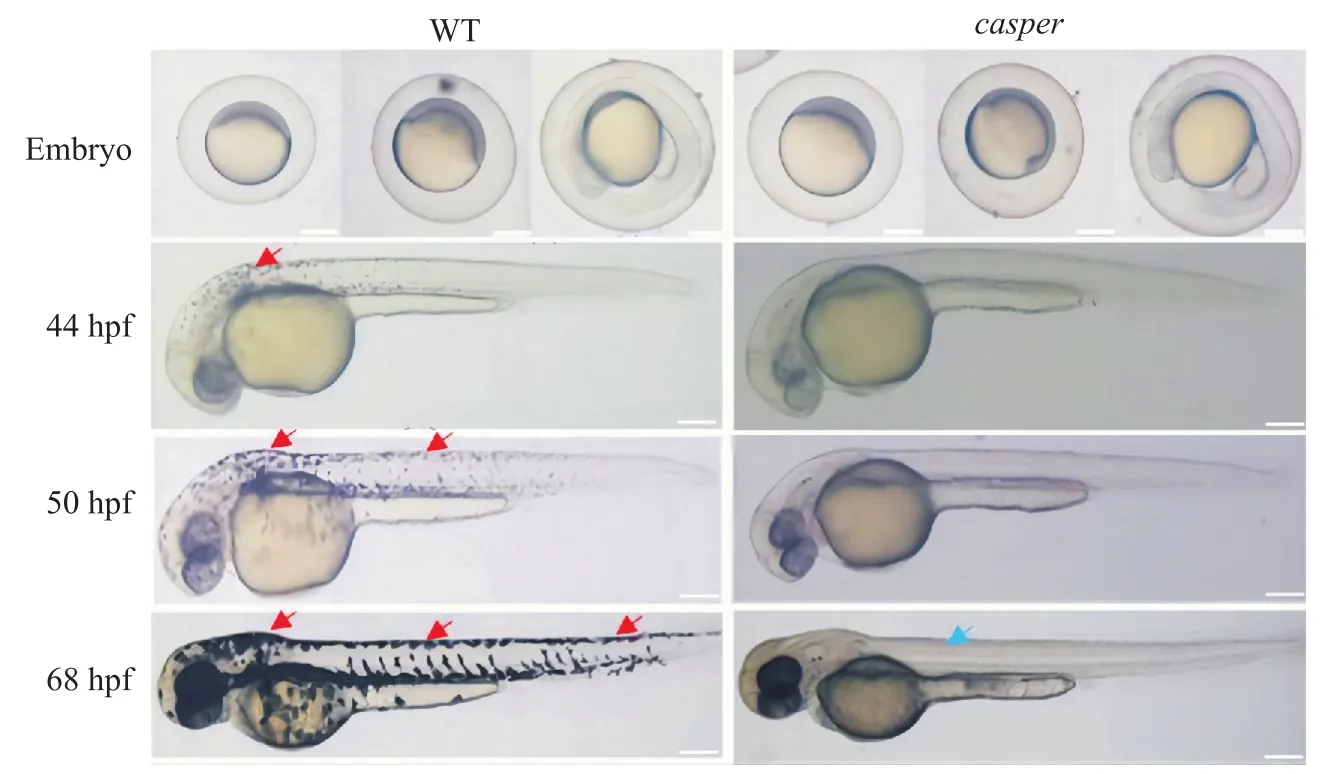
图3 野生型斑马鱼与casper斑马鱼早期体色发育观察Fig. 3 Observation of early body color development of wild-type zebrafish and casper zebrafish
2.3 过表达mitfa的casper斑马鱼早期体色发育观察
首先,获得斑马鱼的总cDNA。比较过表达所选择的质粒载体与基因序列,在CDS区上下游两端设计带有人工添加酶切位点(Hind III与NheI双酶切位点)的引物,通过PCR扩增得到mitfa基因(带有双酶切位点)目的片段(大约1.3 kb)。将其与p-Tol2-EGFP质粒载体进行连接得到p-Tol2-mitfa过表达重组质粒(图4a)。使用显微注射的方式将p-Tol2-mitfa过表达重组质粒注射进casper斑马鱼一细胞期的胚胎,进行三次重复试验。每次注射对照组(注射p-Tol2-EGFP质粒载体)和试验组(注射p-Tol2-mitfa过表达重组质粒)所用胚胎都在200枚左右,胚胎存活率达到95%左右,重组质粒成功进入胚胎且过表达的效率在70%左右(表1),最终得到过表达mitfa的casper斑马鱼。将注射p-Tol2-EGFP质粒载体的casper斑马鱼一细胞期胚胎作为对照,发现两者在发育时期形态特征并未有差异(图4b),但体色方面与对照组不同的是,过表达mitfa的casper斑马鱼孵化后2天(2 days post-hatching,2 dph)在头背部、腹部与躯干部(红箭头所指)有树突状和颗粒状的黑色素细胞重新形成,并且在50 dph时黑色素细胞一直存在(图4c)。
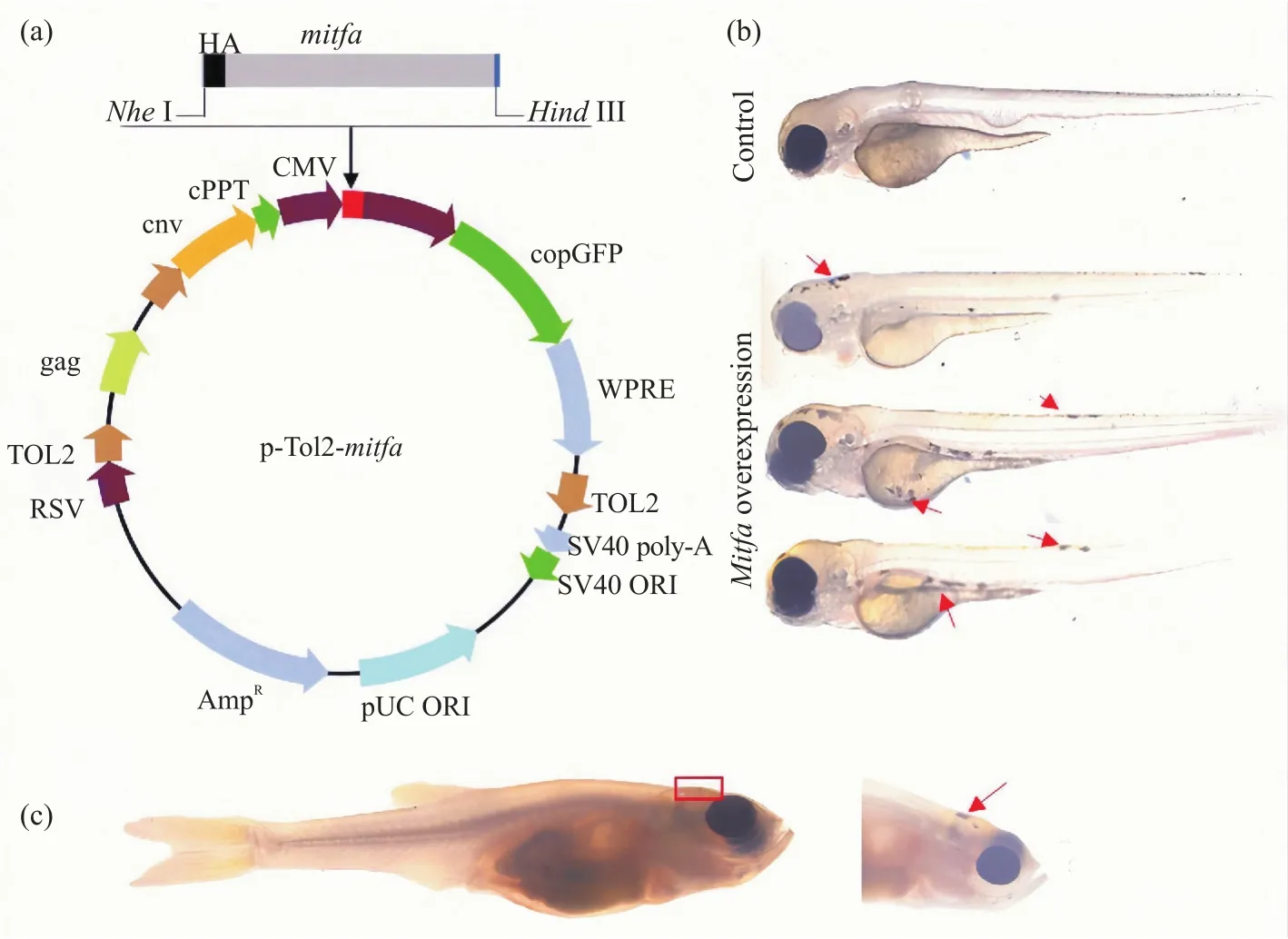
图4 casper斑马鱼mitfa过表达Fig. 4 mitfa overexpression of casper zebrafish

表1 胚胎注射情况统计Tab. 1 Embryo injection statistics
3 讨论
鱼类具有丰富多彩的体色,这在躲避敌害、觅食、求偶交配等种群繁衍中发挥着重要作用,并且蕴藏着十分可观的生态学和经济学效益[2-3]。色素细胞是鱼类形成五彩斑斓的色素斑图与体色的基础,不同的色素细胞种类、数量和分布通过影响特定波长光的吸收和反射,从而产生特定的体色[16]。黑色素细胞在鱼类生理性体色变化中起主要作用,所以目前对于黑色素细胞的研究最为广泛[19-20]。斑马鱼作为试验模式动物,被广泛应用于各种生物学科研究。在前期文献报道中,野生型斑马鱼眼部和头背部黑色素细胞呈树突状、颗粒状、团状和弥散状[7]。本研究以斑马鱼的体色特点作为对照,发现野生型斑马鱼与casper斑马鱼在胚胎和幼苗的形态结构上并未有太大的差异,而在组织细胞层面和早期体色发育过程中存在着显著差异。在casper斑马鱼中发现其体色大多数为黄色和橙黄色细胞,并无黑色素细胞。casper斑马鱼的臀鳍处是由黄色和橙黄色的黄色素细胞疏密分布形成黄色条纹,背鳍上则均匀地分布着大量颗粒状黄色素细胞,而背部鳞片中,仅可见部分黄色素细胞,并且黄色素细胞均呈现出树突状分布。casper斑马鱼不仅是鱼类体色发育研究重要材料,而且因成体透明,在显微镜下可直接示踪观察细胞。透明斑马鱼casper突变体的构建,极大地推动了成年斑马鱼移植模型可视化的发展。在casper斑马鱼体内植入RAS-黑色素瘤细胞,5 d后即可观察到肿瘤的移植、扩增和远距离转移[17]。这为脊椎动物的干细胞移植和癌症体内研究提供了材料平台,在神经科学、干细胞移植和肿瘤研究中有极大的应用。
mitf基因在斑马鱼中存在mitfa和mitfb两个亚型,mitfa与黑色素细胞形成密切相关,而mitfb只与眼视网膜色素上皮的发育有关[13-14]。mitfa的表达受到Ednrb、Wnt及Kit/SCF信号通路的调控,其翻译得到的MITF通过自身的碱性螺旋-环-螺旋-亮氨酸拉链结构域可以与酪氨酸基因家族启动子结合,从而激活相关基因如酪氨酸酶、多巴素异构酶、酪氨酸酶相关蛋白-1等基因的表达,进而影响黑色素的生成[17]。本研究通过在casper斑马鱼中过表达mitfa基因,发现黑色素细胞在斑马鱼幼鱼时期就有表达,并且在50 hfp后黑色素细胞还一直存在。黑色素细胞的形成受一系列信号通路和基因的严格调控,其中,MC1R/α-MSH 信号通路、PI3K/Akt 信号通路、MAPK 信号通路、WNT /β-catenin 信号通路、NO 信号通路为最常见的5条信号通路[21-22]。mitfa基因作为这5条通路共有的靶向基,其过量表达具体参与哪条通路进而影响黑色素细胞的出现需进一步探索。前期研究发现,斑马鱼黑色素细胞与黄色素细胞来自于同一前体干细胞,且mitfa基因还参与虹彩细胞的发育过程。但本研究发现原本黑色素细胞缺失的casper斑马鱼在头背部以及腹部有树突状与颗粒状黑色素细胞的产生,且黄色素细胞和虹彩细胞没有变化[23]。mitfa基因参与黄色素细胞和虹彩细胞的调控需要进一步的研究。本研究得到的过表达mitfa的casper斑马鱼为深入开展鱼类体色分子调控机制研究提供了材料平台。mitfa作为黑色素相关的关键基因,其研究对黑色素细胞本身和黑色素形成基因调控网络的影响以及观赏鱼类新品种的选育、鱼类资源的开发利用和保护均具有十分重大的意义。

