甲型流感H3抗原在毕赤酵母系统中的优化表达与纯化
陈 溥,李安娜,汤岩松,龙浩雨,刘坤山,周 勉
(华东理工大学生物反应器工程国家重点实验室,上海 200237)
流感是世界范围内可以同时感染人和动物的传染性疾病。流感病毒非常活跃,多次在流感季节“袭击”全球,逐渐成为全球疾病防控的重点病毒之一。甲型流感病毒为最常见的流感病毒,并且最容易发生变异。甲型流感病毒的一些亚型如我们熟知的“禽流感”,病毒基因变异后能够感染人类,感染后的症状主要表现为高热、咳嗽、流涕、肌痛等,多数伴有严重的肺炎。严重者心、肾等多种脏器衰竭导致死亡,病死率较高。目前,我国每年仍会季节性地受到甲型流感的肆虐,严重危害畜牧业发展和人类健康。甲型流感对人类致病性高,曾多次引起世界性大流行。甲型流感病毒根据血凝素(hemaglutinin,HA)和神经氨酸酶(neuraminidase,NA)抗原性不同,又分为许多亚型,HA可分为17个亚型(H1~H17),NA有10个亚型(N1~N10)。1918年以来,HA的2个亚型(H1和H3)一直在人群中流行,导致高发病率和高死亡率[1-2]。
甲型流感H3N2是导致人类感染死亡的最主要的毒株之一,而目前防治流感最有效而安全的方式为接种疫苗[3]。传统制备流感疫苗的方法是在鸡胚中培养病毒,灭活纯化后即得到经典的流感灭活疫苗,其主要抗原成分为流感病毒HA[4]。然而,该方法生产周期长,需要巨大的工作量,同时难以对抗甲型流感抗原的易突变性。因此,开展新型流感疫苗及其关键技术的研发仍然是流感研究的热点。流感病毒基因工程疫苗是近年兴起的一门新技术,是将流感病毒基因片段克隆入合适的表达载体,在体外表达病毒抗原后经纯化制备而成的疫苗,常用的表达系统有大肠杆菌、酵母、哺乳动物细胞或杆状病毒等。特别是在流感大流行期间,借助成熟的分子生物技术和生物发酵技术,即可在短时间内研制并生产出大量的流感疫苗以满足大规模接种之需。目前,基于不同靶抗原的流感基因工程亚单位疫苗的有效性已经在多项研究中得以证实。
HA蛋白是流感病毒重要表面抗原,以HA为靶抗原的流感病毒基因工程疫苗是目前研究最多的基因工程疫苗。早在二十世纪七十年代,研究人员就证实流感病毒表面抗原HA能在试验动物中诱导产生有效的特异性抗体。有研究人员使用中国仓鼠卵巢(Chinese hamster ovary cell,CHO)细胞表达重组H7抗原,证实H7抗原能够在小鼠中诱导高滴度的中和抗体,赋予小鼠抵抗活病毒攻击的能力[5]。目前,利用大肠杆菌、酵母、哺乳动物细胞以及植物细胞表达系统表达HA(或HA1、HA2亚基)亚单位疫苗均有报道。例如,Flublok是由Protein Sciences公司所开发的一种三价季节性流感疫苗,是利用杆状病毒昆虫细胞表达系统分别表达H1N1、H3N2和B型3株病毒的HA,经纯化后混合制备而成[6]。Flublok已经相继在3 000多名志愿者人群中开展了4项临床研究,结果显示其在各年龄组人群中都具有良好的安全性,可诱导良好的免疫应答。Flublok于2013年1月获得美国FDA批准用于流感的预防,是第一个获得批准上市的重组亚单位疫苗[7]。植物来源的流感病毒样颗粒(virus-like particle,VLP)也是近年来的研究热点。D’Aoust等[8-9]将流感病毒HA基因通过农杆菌渗入法转化本塞姆烟草后,在植物叶片中成功提取到了一种新型的含HA的VLP。动物试验显示,小鼠在给予1剂0.1 µg的VLP肌肉注射后即可产生相当高水平的免疫应答,2剂0.5 µg的VLP免疫后可保护小鼠免受来自相同亚型但不同分支的流感病毒致死量攻击。至今,包括2009新甲型H1N1流感病毒在内的多种病毒的植物表达VLP均已成功制备,并在动物试验中显示了巨大潜能[10]。相关临床研究表明VLP疫苗在人体的安全性、耐受性以及诱导的免疫应答水平均较好[11-12]。
巴斯德毕赤酵母(Pichia pastoris)细胞表达系统是一种可以利用甲醇作为唯一碳源进行生长的营养型酵母,具有所需培养基成分简单便宜、分子操作简单方便、生长较快等优势。自二十世纪八十年代以来,毕赤酵母表达系统逐渐被广泛用于外源蛋白的表达生产。到目前为止,毕赤酵母已成为仅次于大肠杆菌的第二大表达系统,被广泛用于外源蛋白的表达以及结构解析等方面。据RTC公司统计,至今毕赤酵母中成功表达出的蛋白多达5 000多个,且有1 500多个学术机构和工业实验室将毕赤酵母表达系统用于科研和工业化生产,70多个毕赤酵母表达的商业化产品成功上市(http://www.pichia.com/)。毕赤酵母表达系统属于真核表达系统,具有翻译后修饰能力,因而可以快速制备具有糖基化结构的HA抗原,并且适合于在发酵罐中进行大规模生产,所以它是能应对流感暴发的理想表达系统[13]。根据最新文献,已有研究团队成功使用毕赤酵母系统来进行H1抗原的表达,研制了亚单位疫苗,并在小鼠中进行了免疫[14]。但是目前H3抗原的重组表达和疫苗研制还没有研究团队尝试过。
密码子优化是重组蛋白表达过程中常用的策略。在任一物种中,密码子的使用频率往往和编码对应反密码子的tRNA基因拷贝数、tRNA的表达量成正相关[15]。表达量较高的基因中多使用常见密码子,这也被认为是自然选择的结果,可以让高度表达的基因更有效和精确地被翻译。近年来不断有研究显示,密码子偏好除了调控mRNA的翻译速率,也通过共翻译折叠影响着蛋白质的结构与功能[16-17]。密码子频率与蛋白质二级结构混乱度的负相关性也在粗糙脉孢菌、酵母、果蝇、小鼠等基因组中被发现,二级结构混乱度较高的区域总是倾向于使用稀有密码子。这可能是一种降低翻译速率给予更多时间可供折叠的机制,而对于这些区域过度的密码子优化则有可能影响其正常的结构与蛋白质功能[18]。
因此,本研究首先参照毕赤酵母基因组对甲型流感病毒H3抗原进行科学的密码子优化设计,目标是提高其在毕赤酵母系统中的蛋白质表达并维持正确的结构功能[19-20];随后,使用甲醇诱导型高效启动子PAOX1分泌表达优化后的H3基因,构建高拷贝的毕赤酵母重组菌株;最后,通过金属离子亲和层析技术,对H3抗原进行纯化分离,为下一步动物体内免疫打下基础。
1 材料与方法
1.1 材料
菌株:本研究所用酵母菌株均在GS115基础上构建,大肠杆菌感受态细胞为DH5α菌株。质粒:本研究克隆H3基因使用pPICZα质粒,带有AOX1启动子、alpha因子分泌序列、组氨酸(6×his)标签和博来霉素(Zeocin)抗性。试剂:质粒抽提试剂盒购自生工生物工程(上海);H3和引物序列合成由苏州金唯智生物科技有限公司完成;针对6×his标签的一抗和二抗购自上海碧云天生物技术有限公司;纯化用钴柱购自ThermoFisher公司;无缝克隆试剂盒购自诺唯赞公司;其他化学品试剂购自华东理工大学材料平台。
1.2 H3基因密码子优化及序列合成
从NCBI网站获得甲型流感病毒[A/New York/392/2004(H3N2)]H3抗原基因的原始序列(NC_007366),利用IUPRED在线工具(https://iupred2a.elte.hu/)对蛋白质进行二级结构混乱度分析。根据Codon Usage Database (http://www.kazusa.or.jp/codon/)获得毕赤酵母基因组高表达基因中各密码子的使用频率ω,计算同义密码子的相对使用频率。基因的密码子适应指数(codon adaptation index,CAI)曲线根据各密码子的相对使用频率数据绘制,滑动框采用15个密码子。密码子优化后序列交由苏州金唯智生物科技有限公司合成。
1.3 引物设计
根据引物设计原则利用SnapGene软件设计引物,并将其交给苏州金唯智生物科技有限公司合成,引物序列见表1。

表1 引物设计Tab. 1 Primer design
1.4 重组质粒的构建
将基因片段使用无缝克隆插入pPICZα质粒的alpha因子分泌序列之后,末端保留His和Myc标签。构建好的质粒使用大肠杆菌扩增,测序验证基因序列的正确性。
1.5 电击转化毕赤酵母及多拷贝的菌株筛选
构建好的质粒经BlnI酶切线性化后与新鲜制备的毕赤酵母感受态细胞混合,转移到预冷的电击杯进行电击转化。转化结束后加入1 mL冰冻的1 mol/L山梨醇溶液和1 mL酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose medium,YPD)复苏2~3 h,离心,涂带有高质量浓度Zeocin抗生素(0.7 mg/mL)的平板。
2~3 d后挑选出Zeocin抗性平板长出的单菌落,YPD培养-洗菌-缓冲复合甲醇培养基(buffered methanol-complex medium,BMMY)培养诱导H3表达,取上清进行组氨酸标签的Western blot验证,筛选目的基因表达量最高的转化株。
1.6 聚丙烯酰胺凝胶电泳(SDS-PAGE)和蛋白质印迹法(Western blot)
将发酵液离心,取上清进行SDS-PAGE电泳,上样量为20 µL。浓缩胶使用电压80 V,分离胶使用电压100 V。电泳恒压100 V转膜1.5 h,进行Western blot。一抗使用6×his单克隆抗体,二抗使用辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗小鼠IgG抗体。
1.7 H3抗原的表达与纯化
酵母菌株使用YPD培养基培养,当菌株悬液在600 nm波长处的光密度值为2~6时,将菌株用无菌水洗涤3次后转移到BMMY(含1%甲醇)培养基诱导表达。每24 h补充1次甲醇,诱导72 h后离心收集上清。培养温度为30℃。
纯化H3抗原时,首先通过10 kD孔径超滤膜包将发酵液上清浓缩10倍。在浓缩后的上清中加入等量的平衡缓冲液并调pH至7.4,加入钴柱中与介质充分结合。分别使用含5 mmol/L和150 mmol/L咪唑的缓冲液进行洗涤和洗脱。将含目标蛋白H3的数管洗脱液合并,使用30 kD超滤管超滤去除杂带、浓缩目标蛋白。将以上操作得到的样品进行蛋白电泳检测,经考马斯亮蓝染色和Western blot对表达和纯化的效果进行表征。
1.8 红细胞凝集试验
血凝试验于96孔V型微量反应板上进行。每孔分别加入50 μL不同浓度的H3蛋白样品,阴性对照加入磷酸缓冲液(phosphote buffered saline,PBS),再依次加入1%鸡红细胞悬液50 μL,混匀后弃去50 μL。振板1 min后静置,45~50 min后观察结果。
2 结果与分析
2.1 密码子优化
首先,我们从NCBI网站下载了H3抗原的原始基因序列,分析了其在毕赤酵母基因组中的CAI曲线(图1,蓝色曲线)和蛋白质的二级结构混乱度曲线(图2),设计密码子优化方案。总体原则是适当降低二级结构混乱度较高区域的密码子优化程度,减少密码子优化对蛋白质结构与功能的影响。二级结构混乱度小于0.5的区域替换为相对使用频率最高的同义密码子,二级结构混乱度大于0.5的区域替换为相对使用频率次高的同义密码子,得到优化后序列。将优化前后的碱基序列绘制 CAI 曲线进行比对,可以明显看到CAI值的整体提高(图1,红色曲线)。

图1 H3基因的CAI曲线Fig. l CAI curve of H3 gene
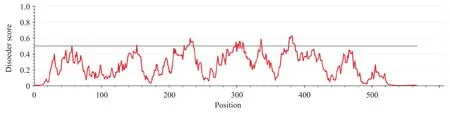
图2 H3蛋白质二级结构紊乱度曲线Fig. 2 Protein secondary structural disorder curve of H3
2.2 表达载体的构建
我们将合成的H3基因片段亚克隆入pPICZα载体得到质粒pPICZα-H3(图3)。
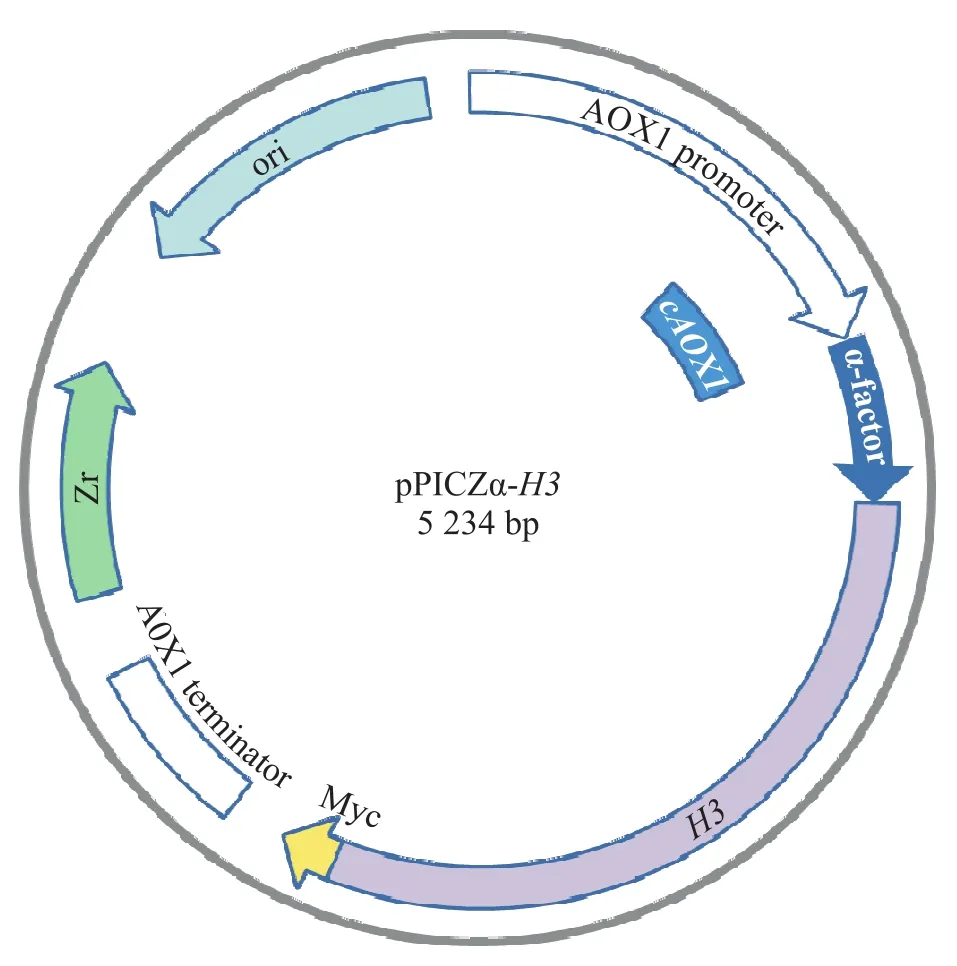
图3 pPICZα-H3质粒图谱Fig. 3 Plasmid map of pPICZα-H3
测序和酶切电泳结果表明重组质粒构建成功。如图4所示,其中编号为2-4和1-4的菌株对应的泳道与理论上目的条带的大小一致。将该质粒在AOX1启动子内部线性化后电转入毕赤酵母GS115菌株,筛选高表达转基因菌株。
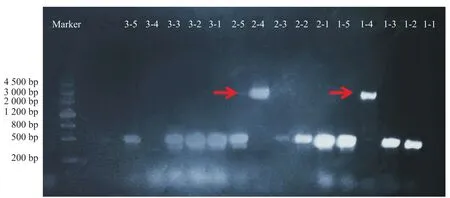
图4 质粒构建的验证结果图Fig. 4 Verification of plasmid construction
2.3 H3抗原的表达与纯化
重组质粒电转化入毕赤酵母中后,通过增加Zeocin抗性质量浓度的方式筛选目标蛋白表达量最高的重组菌株。选取1.0~1.5 mg/mL Zeocin抗性平板上长出的重组菌落,经培养和甲醇诱导表达后,通过考马斯亮蓝染色和Western blot检测目标蛋白,挑选表达量最高的菌株进行后续纯化。如图5所示,菌株1-3和菌株2-5具备相对较高的H3表达水平,因此选择菌株1-3进行后续的表达纯化步骤。
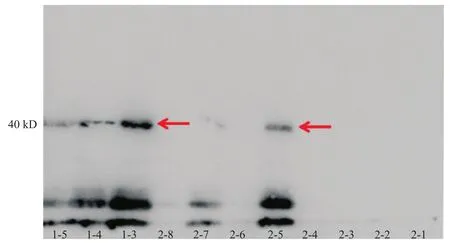
图5 Western blot筛选H3高表达菌株Fig. 5 Screening for highly efficient H3 expressing strains by Western blot analysis
随后,我们进行摇瓶培养和诱导重组菌,摸索了最优的培养条件(时间与浓度),获得了含目标蛋白的上清,通过超滤浓缩、亲和层析纯化H3蛋白。使用考马斯亮蓝染色和Western blot检测了纯化结果。从洗脱组分来看,纯化后蛋白中存在全长的H3蛋白,但也存在一定程度的降解组分(图6和图7,Lane 10)。经尝试,通过控制超滤孔径并多次超滤的方式可以有效地除去大多数降解条带,保留较高纯度的H3全长条带(图6和图7,Lanes 11~14)。
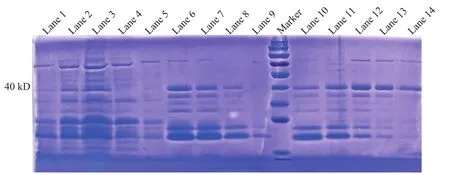
图6 H3蛋白纯化考马斯亮蓝染色结果图Fig. 6 H3 protein purification analyzed by coomassie brilliant blue staining

图7 H3蛋白纯化 Western blot结果图Fig. 7 H3 protein purification by Western blot analysis
2.4 H3抗原的红细胞凝集活性检测
流感病毒表面的HA蛋白可与红细胞表面唾液酸位点结合,导致红细胞凝集,这也是血凝素名字的由来。因此,接下来我们检测了通过重组表达与纯化得到的H3抗原是否具有红细胞凝集活性。红细胞凝集试验显示,0.07~0.35 mg/mL的H3重组蛋白不具备血凝活性。当H3抗原位于流感病毒表面时,病毒颗粒作为承载核心起到相对富集的作用,而纯化分离得到的H3抗原则分散溶解在溶液中,可能影响其血凝活性。因此,我们尝试用结合H3抗原的镍柱填料模拟病毒颗粒,并以空载镍柱填料作为对照测试血凝活性。结果显示,与PBS阴性对照相比,空镍柱填料展示出一定程度的血凝活性,可能由填料本身的非特异性结合造成,而H3结合的镍柱填料表现出相对更强的血凝活性。
3 讨论
本研究选取常见流感病毒株的HA基因,在密码子使用偏好分析和蛋白质混乱度分析的基础上对其进行了密码子优化,随后采用优化序列进行了克隆表达及酵母转基因菌株构建。在确认H3抗原在毕赤酵母系统中成功表达后,我们尝试了蛋白纯化分离技术。本研究采用新型的密码子优化方法对H3基因进行优化,除了考虑密码子使用频率优势,还考虑到蛋白的二级结构混乱度,希望避免过度优化导致蛋白失去原有的结构和功能的现象。从目前的纯化结果来看,H3蛋白可以通过亲和层析进行分离,表达过程中的降解条带亦可以通过超滤有效去除。纯化获得的H3抗原溶液本身不表现出血凝活性,但是与镍柱填料结合富集后表现出一定程度的血凝活性。
毕赤酵母表达系统能高效分泌蛋白,并且适合在发酵罐中高密度生长,大规模发酵[21-22]。有研究与我们的结果类似,显示在毕赤酵母中重组表达获得的H7抗原在溶液状态也不表现出血凝活性,但是仍然具备在小鼠中诱导产生特异性抗体的功能[23]。另有研究显示,毕赤酵母系统中1 L培养基可以纯化出200 mg H5的HA胞外结构域蛋白,用该蛋白免疫鸡可以保护其不受H5N1禽流感病毒的感染[24]。因此,本课题的后续研究有潜力实现H3抗原的大规模表达生产,助力疫苗研发。

