2型糖尿病合并腹泻患者肠道菌群与肝肾指标的相关性
熊 馨,李敏瑞,任玉艳,杜宇辉,贺建峰*
(昆明理工大学 a. 信息工程与自动化学院;b. 医学院,昆明 650500)
糖尿病(diabetes mellitus,DM)是一种由于胰岛素分泌缺陷或胰岛素作用障碍所致的血糖异常升高为主要特征的慢性代谢性疾病[1],同时也是目前严重威胁人类健康和生命安全的非传染性疾病之一[2]。2型糖尿病(type 2 diabetes mellitus,T2DM)占糖尿病患者90%以上,且其合并症众多。目前对于T2DM合并症的研究有以下几个方面:1)药物治疗对于T2DM合并症的影响的分析,如陈晨等[3]研究发现,达格列净可改善T2DM合并代谢综合征(metabolic syndrome,MS)患者的糖脂代谢指标;2)T2DM合并症的相关性因素分析,如陈玉华等[4]研究发现,T2DM合并骨质疏松(osteoporosis,OP)受身体质量指数(body mass index,BMI)、总胆固醇(total cholesterol,CHOL)、降钙素(calcitonin,CT)、骨钙素(osteocalcin,OC)、25(OH)D3、抗胰岛素抗体(insulin autoantibody,IAA)等因素影响;3)肠道菌群与T2DM合并症的相关性分析等,如张荣芳等[5]研究发现,T2DM合并急性胰腺炎(acute pancreatitis,AP)大鼠肠道菌群结构发生改变,其中,大肠杆菌和双歧杆菌的丰度与AP的严重程度相关。
T2DM胃肠道病变是威胁糖尿病患者健康的重要并发症,占糖尿病患者的1/2左右[6-7]。腹泻是T2DM患者常见的临床症状之一[8-9]。患者出现腹泻之后严重影响了其生活质量和对血糖水平的控制,并可能引起其他并发症。有研究发现与单纯的T2DM患者相比,T2DM合并腹泻患者血糖水平更高,存在脂肪吸收不良、胃肠动力明显紊乱的问题,但两者的菌群失调情况没有显著性差异[10-11]。已有研究表明,肠道菌群组成与T2DM密切相关[12-18]。也有研究表明,糖尿病患者在治疗过程中用药对肠道菌群组成会造成影响[19-20],且长期服用药物会加重肝肾负担。有研究发现,肠道菌群失调与肝肾功能具有相关性[21-22]。糖尿病患者本身由于代谢异常也会影响肝肾代谢,因此,糖尿病患者在定期的临床试验检查中必须对血糖和肝肾功能进行检测,以判断患者在治疗过程中血糖水平的稳定性以及肝肾功能是否发生异常。本文研究T2DM合并腹泻患者与T2DM患者肠道菌群和肝肾生化指标是否存在差异,并进一步探讨两类人群的肠道菌群与肝肾功能的关系。
1 材料与方法
1.1 试验数据源
本文的数据来自于2015—2017年云南省第一人民医院内分泌科住院的T2DM患者。按照WHO1999年糖尿病诊断标准,根据病史、临床表现和实验室检查结果,将T2DM患者划分为单纯的T2DM(26例,P组)和T2DM合并腹泻(26例,D组)两个组别。所有受试者均签署了知情同意书,且该试验得到了昆明理工大学伦理道德委员会的批准。所有研究对象均进行肝功能和肾功能检查,且提供粪便样本,以获得肠道微生物。研究对象在采样前1个月内未使用抗生素、益生菌或益生元等制剂及乳果糖。本文对52个样本的肠道菌群α多样性和β多样性,以及血糖水平和肝肾生化指标数据进行分析。
1.2 肝肾生化指标测定
取52名患者的清晨空腹静脉血5 mL,待血浆凝固后以3 500 r/min的转速离心15 min,吸取血清,将分离得到的血清于-20℃保存。使用美国Beckman全自动大型生化分析仪(DXC800,LX20)测量谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、总胆红素(total bilirubin,TBIL)、直接胆红素(direct bilirubin,DBIL)、间接胆红素(indirect bilirubin,IBIL)、CHOL、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL_C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL_C)、血尿素氮(blood urea nitrogen,BUN)、血肌酐(creatinine,Cr)、血尿酸(blood uric acid,UA)的血清水平。
1.3 肠道微生物DNA的提取和扩增
采集患者新鲜粪便样本,在实验室称取约250 mg,分装于EP管中,在-80℃冷冻保存。使用Qiagen的QIAamp Stool Mini kit试剂盒提取样本中的细菌DNA,取提取产物1 μL进行琼脂糖凝胶电泳,分析DNA的完整性。之后,使用16S V4区域引物(515F/806R)进行PCR反应,扩增出V4~V5区域的16S rRNA基因。最后,将文库在Illumina HiSeq 2000平台上进行测序,生成了大小为1 796 bp的序列。
1.4 统计分析
本文的统计分析包含三个部分。首先,对于两组患者的肝肾生化指标数据以及血糖检测数据的差异采用单因素方差(one-way ANOVA)分析。其次,研究两组患者的临床生化指标与肠道微生物α多样性指标的相关性,总共使用了三个α多样性指数,分别为被观察到的物种数(observed_species)、香农指数(shannon)、基于丰度的覆盖估计值(abundance-based coverage estimator,ACE)。α多样性反映了物种丰富度和均匀度以及菌群多样性。为分析肝肾生化指标对肠道微生物α多样性的影响,使用了一元一次线性回归模型:
y=a+bx+e。
其中y为因变量,代表肠道微生物α多样性;x为自变量,代表临床生化指标。a为常数项,即回归直线在y轴上的截距;b为回归系数,即回归直线的斜率;e为随机误差。
接下来,我们研究两组患者肠道菌群结构在β多样性测度上的差异。β多样性反映了在生态距离上菌群组成的变化。β多样性数据源为通过操作分类单位(operational taxonomic unit,OTU)的丰度信息表和OTU之间的系统发生关系计算得到的加权UniFrac和未加权UniFrac距离。使用PERMANOVA程序(R中Vegan包的adonis函数)进行置换多元方差分析,再根据未加权UniFrac距离进行主坐标分析(principal coordinate analysis,PCoA),得到主坐标分析图。最后,用Spearman秩相关测试分析两组患者肝肾生化指标与肠道微生物的相关性。
2 结果与分析
2.1 T2DM合并腹泻和T2DM患者的临床特征
如表1所示,研究对象的血糖检测指标和肝肾生化指标包括以下几个方面。糖尿病确诊指标:糖化血红蛋白(glycated hemoglobin a1c,HbA1c),血糖(blood glucose,GLU),糖化血清蛋白(glycosylated serum protein,GSP);肝功能指标:AST,ALT,TBIL,DBIL,IBIL;肝功能生化指标中反映肝脏合成蛋白质功能的指标:CHOL,TG,HDL_C,LDL_C;肾功能指标:BUN,Cr,UA。
在表1中,两组患者的HbA1c、GLU、GSP水平普遍高于正常范围(4%~6%,3.9~6.0 mmol/L,122~236 µmol/L),同时T2DM患者的检测值均高于T2DM合并腹泻患者,但二者没有显著性差异。在肝细胞损伤试验和排泄功能试验中,两组患者的AST、ALT、TBIL、DBIL、IBIL都没有超出正常范围,但是T2DM合并腹泻患者的AST水平明显升高。在肝脏标记物中,两组患者的TG水平存在显著性差异(P=0.006),且T2DM患者的TG水平明显超出正常范围,除此之外两组患者的HDL_C含量明显偏低。在肾功能检测值中,两组患者的BUN水平存在显著性差异(P=0.003)。
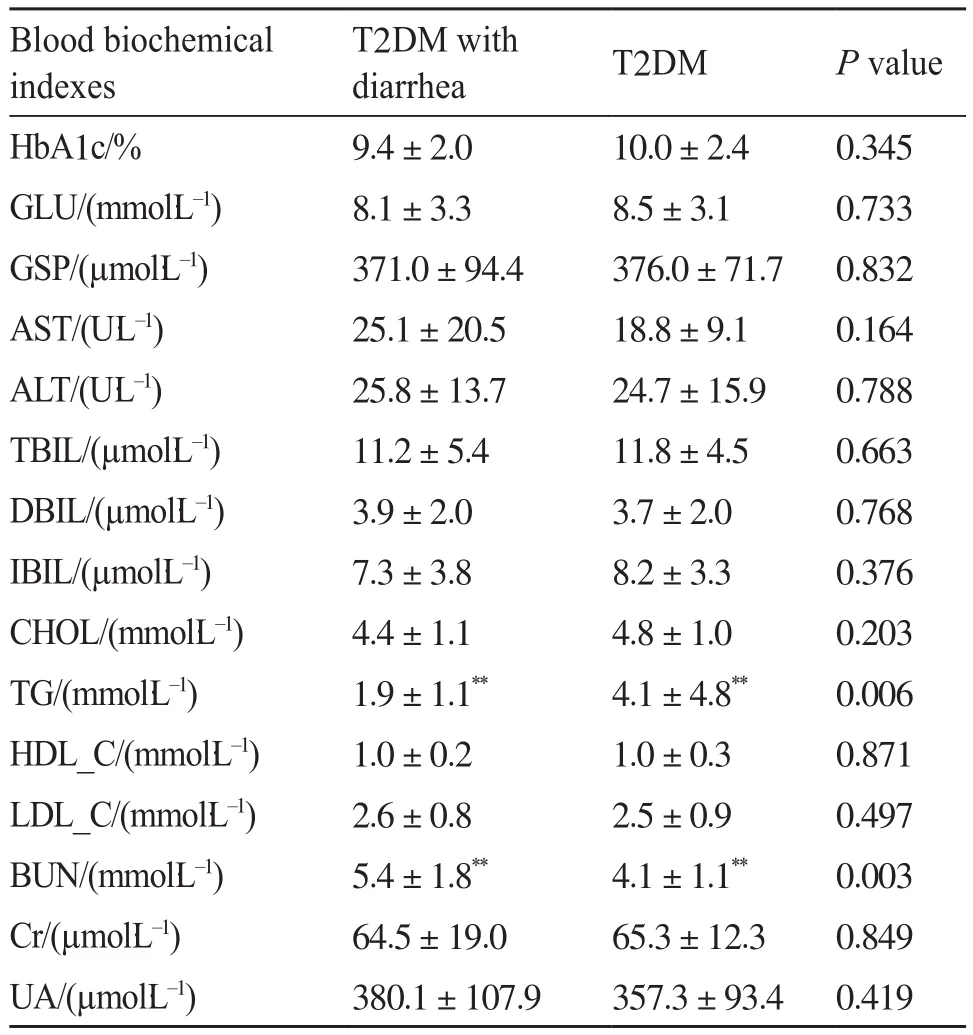
表1 糖尿病患者的临床数据Tab. 1 Clinical data of diabetic patients
2.2 肝肾临床特征和肠道微生物α多样性之间的关联
表2和表3总结了T2DM合并腹泻和T2DM患者临床生化指标与α多样性的关联结果[13,23]。在进行线性回归分析之前,先进行了相关性分析,当差异具有显著性(P<0.05)时,才认为两个变量之间存在相关关系,最后进行回归分析。在T2DM合并腹泻组中,HbA1c水平作为糖尿病控制情况的标准,与observed_species和ACE指数负相关(P=0.038,r=-0.409;P=0.010,r=-0.496)。如图1a所示,HbA1c增加与物种丰富度下降有关(P=0.038);如图1b所示,HbA1c增加也与菌群丰度下降有关(P=0.010)。TBIL、DBIL、IBIL水平与shannon指数负向相关(P=0.007,r=-0.514;P=0.038,r=-0.409;P=0.008,r=-0.510);Cr水平与observed_species正向相关(P=0.012)(表2)。在T2DM组中,HbA1c、GLU、GSP水平反应糖尿病患者体内的血糖水平,与ACE和observed_species指数有关(P=0.034,r=0.416 ;P=0.046,r=0.394 ;P=0.027,r=0.433),且都为正向相关关系(表3)。所以,T2DM合并腹泻患者的肠道菌群α多样性与血糖指标中的HbA1c以及肝功能指标中的TBIL、DBIL、IBIL呈负相关,与肾功能指标中的Cr呈正相关;而T2DM患者的肠道菌群的α多样性与血糖中的3个指标HbA1c、GLU、GSP均呈正相关,与肝肾指标不具有相关性。
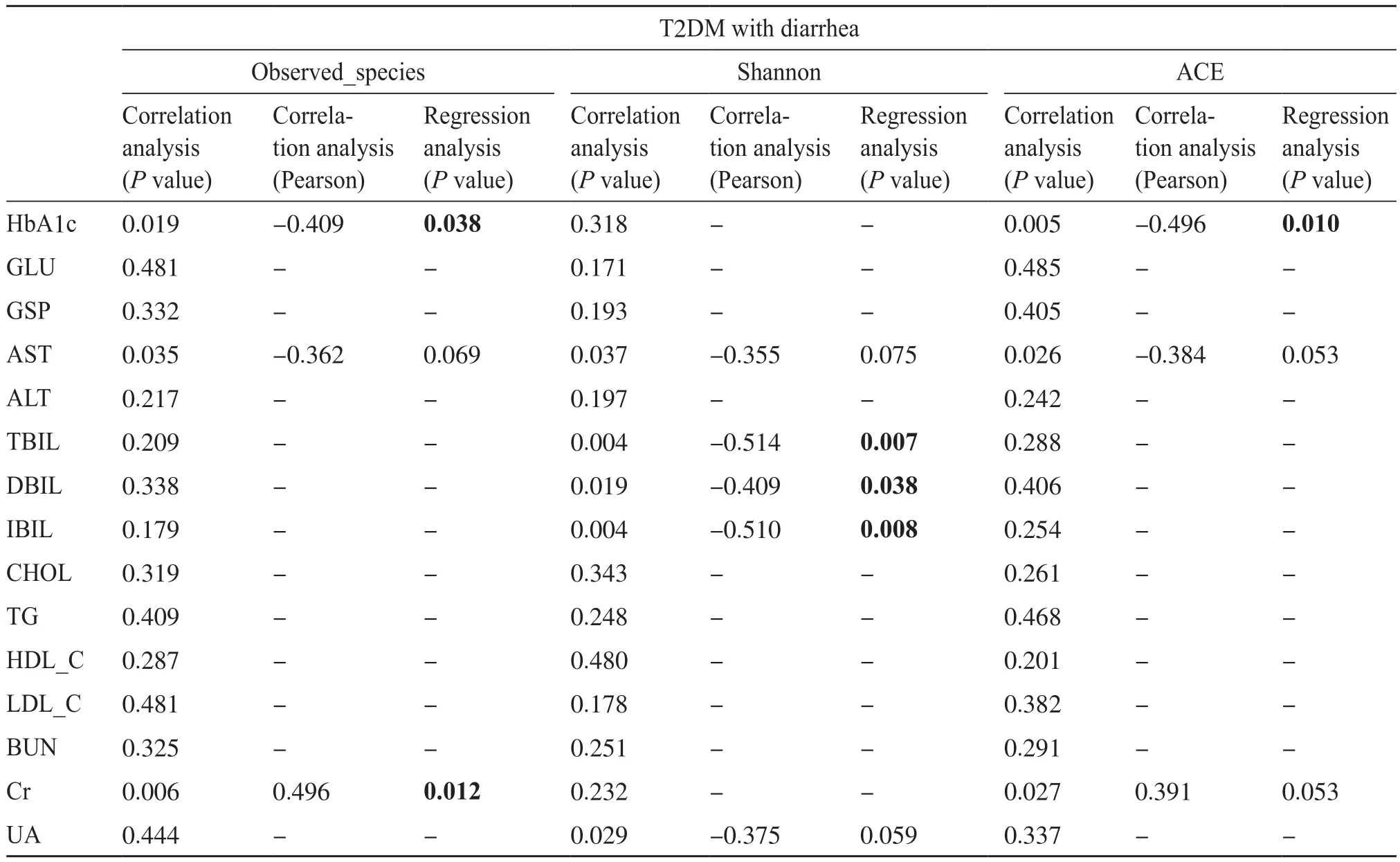
表2 T2DM合并腹泻患者肝肾临床特征与α多样性指标之间的关联Tab. 2 The relationship between the clinical characteristics of liver and kidney and alpha diversity indexs in patients with type 2 diabetes with diarrhea
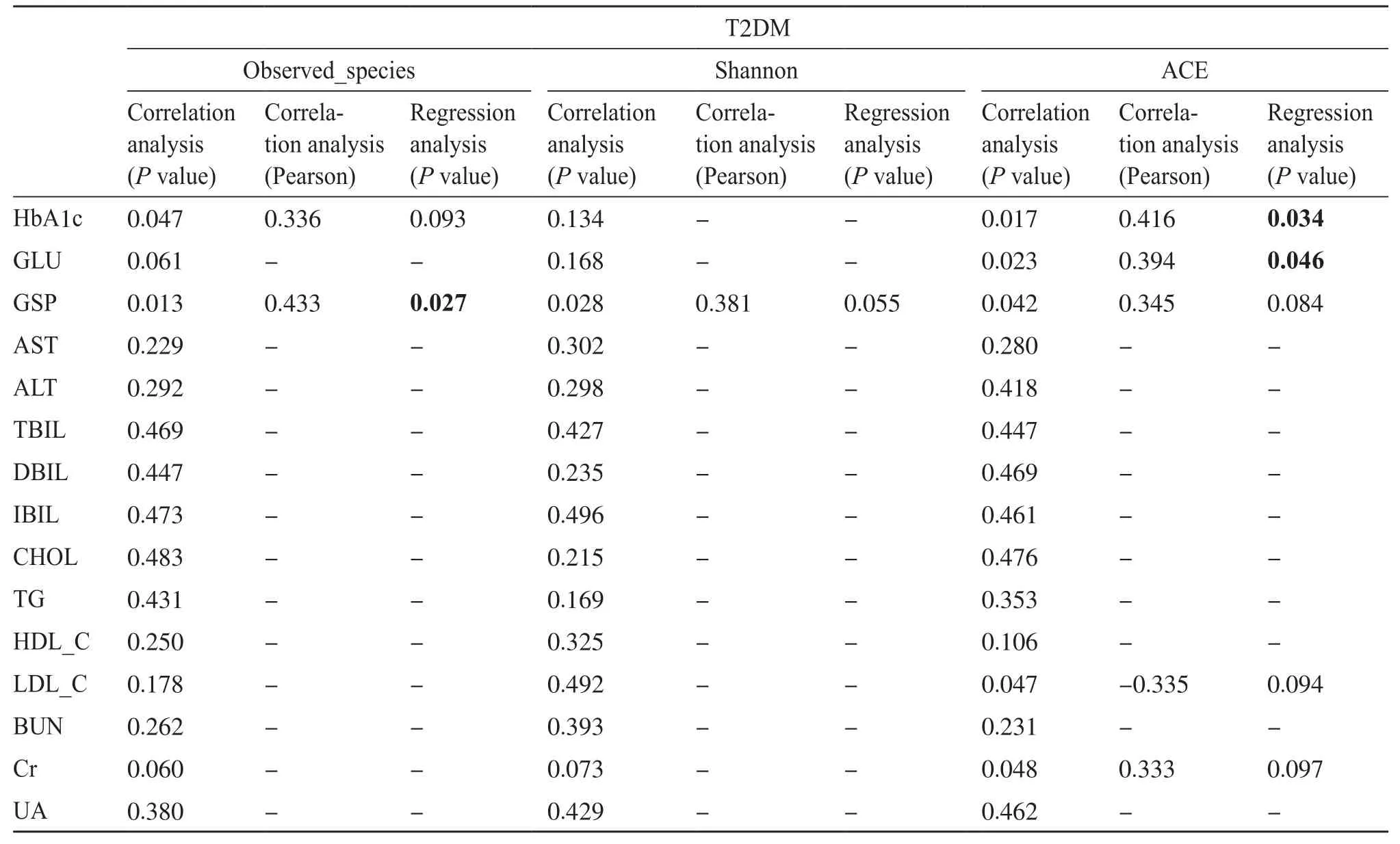
表3 T2DM患者肝肾临床特征与α多样性指标之间的关联Tab. 3 The relationship between the clinical characteristics of liver and kidney and alpha diversity indexs in patients with type 2 diabetes
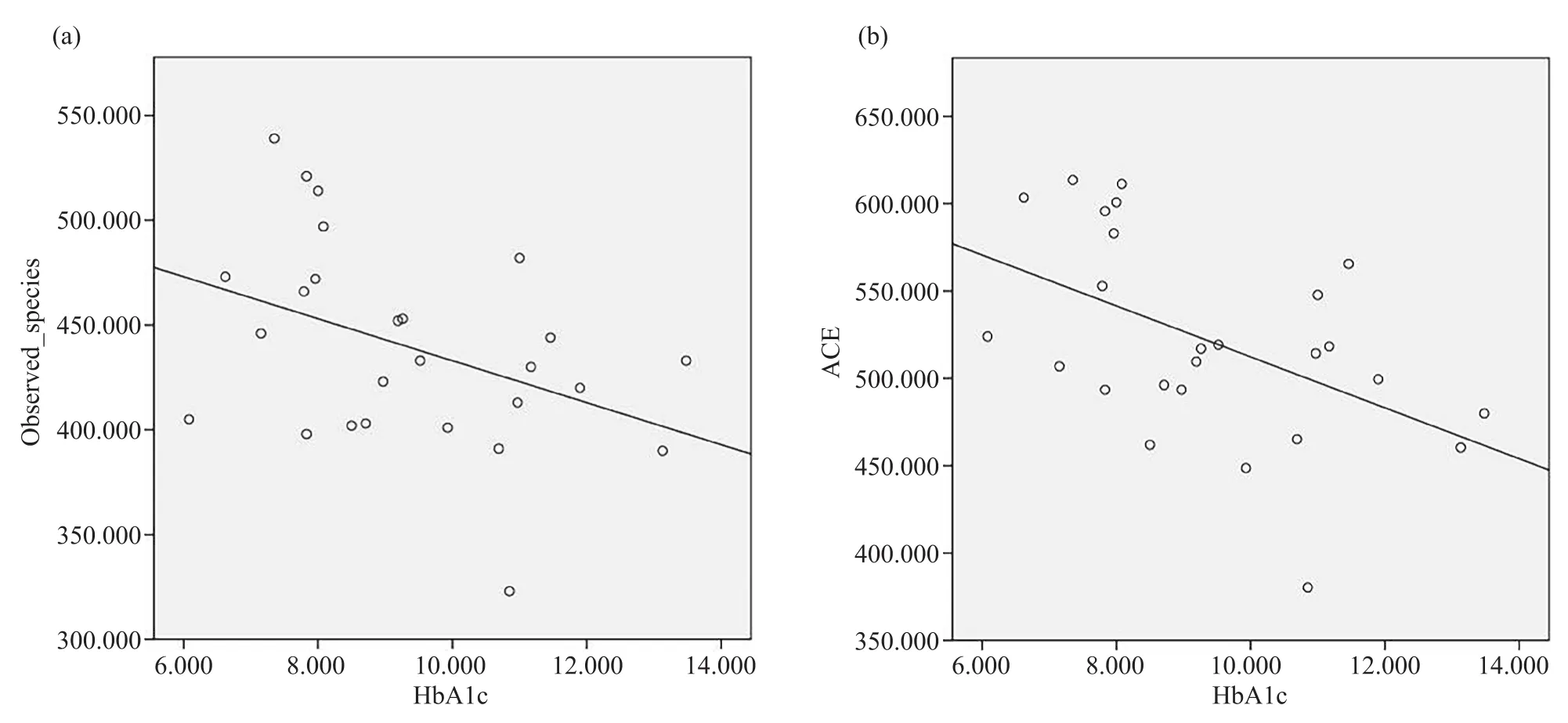
图1 HbA1c与observed_species、ACE指数具有显著相关性Fig. 1 HbA1c is significantly associated with observed_species and ACE index
2.3 T2DM合并腹泻和T2DM患者肠道菌群β多样性结构差异
通过16S rRNA测序得到1 796条OTU序列,在物种注释之后OTU主要分为28个门(Phylum),55个纲(Class),108个目(Order),185个科(Family),408个属(Genus),284个种(Species)。由于分类水平较低的种水平所表示的物种在高变区可能非常相近,能够区分它们的特异性片段可能不在扩增区域内,因此大部分OTU序列注释不到种水平,导致种的数目较少。同样的原因,受到测序长度的限制,也导致了部分OTU序列在属水平的物种注释缺失,因此本文主要在门水平和科水平进行了后续分析。物种注释后,在各个分类级别中按照细菌总读数占总量大于1%的情况,鉴定了含量最丰富的细菌,包括7个主要的门,16个主要的纲,18个主要的目,以及15个主要的科。在门级别中,最丰富的细菌为厚壁菌门(Firmicutes,43.7%)、变形菌门(Proteobacteria,17.8%)、拟杆菌门(Bacteroidetes,15.2%)、放线菌门(Actinobacteria,10.4%)。在纲级别中,最丰富的细菌为梭菌纲(Clostridia,34.7%)、拟杆菌纲(Bacteroidia,13.9%)。在目级别中,最丰富的细菌为梭菌目(Clostridiales,34.7%)、拟杆菌目(Bacteroidales,13.9%)。在科级别中,最丰富的细菌为瘤胃菌科(Ruminococcaceae,16.1%)、毛螺菌科(Lachnospiraceae,10.6%)。
图2a和图2b分别展示了在门水平上T2DM合并腹泻和T2DM患者肠道中主要细菌的相对分布情况,其中厚壁菌门、变形菌门、拟杆菌门是两类人群肠道中含量较大、分布较广的细菌。图2c和图2d分别展示了在科水平上,两类人群肠道中主要细菌的相对分布情况。其中,拟杆菌科(Bacteroidaceae)、毛螺菌科、普雷沃氏菌科(Prevotellaceae)、瘤胃菌科是两类人群肠道微生物中含量最多的细菌,并且T2DM合并腹泻患者在前三种细菌的含量上比T2DM患者明显降低,但瘤胃菌科和其他细菌的丰度明显增加,韦荣氏菌科(Veillonellaceae)、紫单胞菌科(Porphyromonadaceae)丰度也明显比T2DM患者更高。
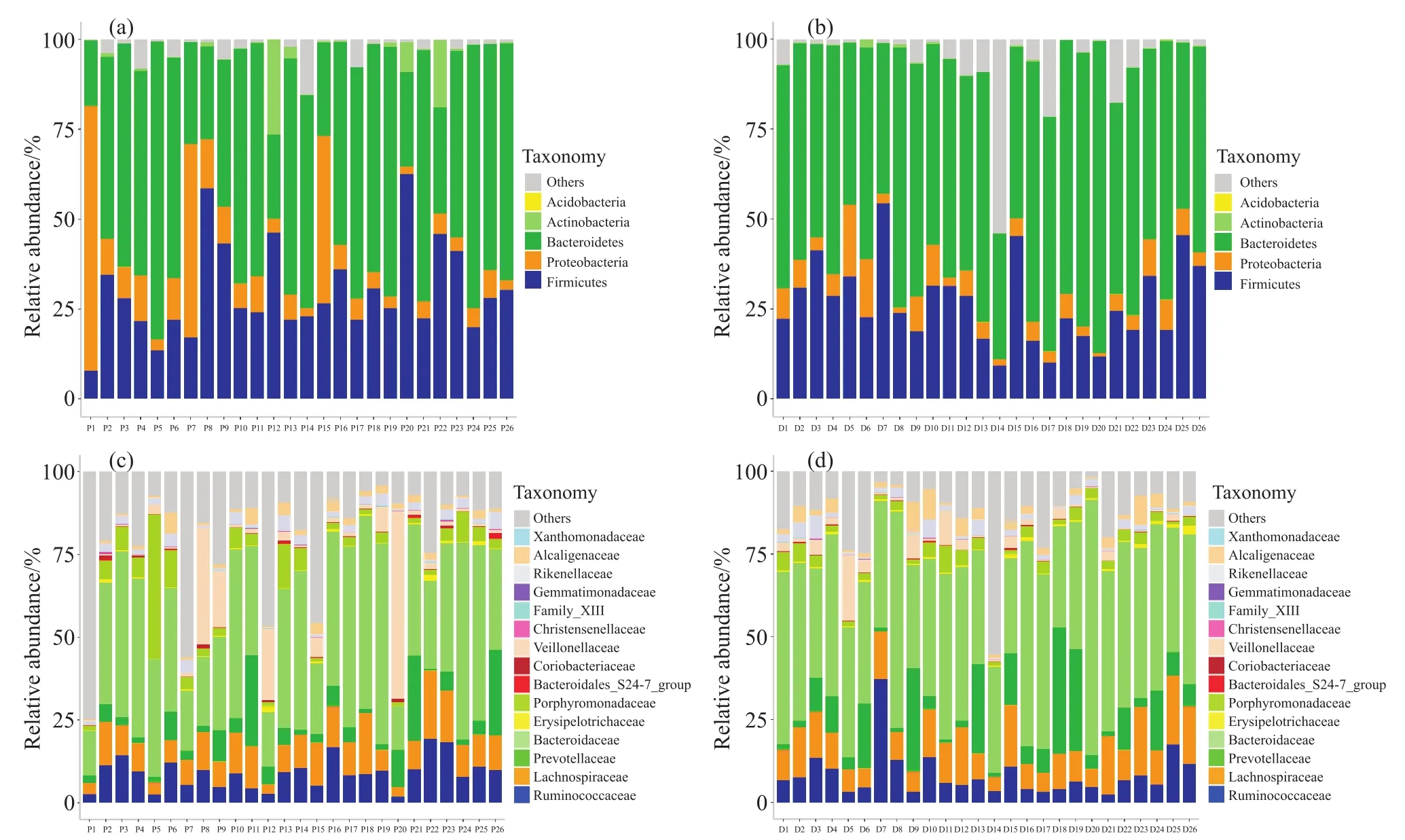
图2 两类人群分别在门级别和科级别中主要细菌的相对丰度分布Fig. 2 The relative abundance distribution of the main bacteria in Phylum and Family levels of the two populations
基于肠道微生物β多样性距离测度分析两类人群的菌群结构差异。选择基于系统发育树的加权UniFrac和未加权UniFrac距离度量,并使用R程序中Vegan包进行PERMANOVA检验群落结构差异,计算得到自由度(degree of freedom,Df)、平方和(sums of squares)、均方差(mean squares)、F检验值(F. Model)、方差贡献(R2)、显著性P值。如表4所示,使用置换检验进行显著性统计时,两类人群的肠道菌群组成结构在未加权UniFrac度量和加权UniFrac度量上都存在显著性差异(P=0.001,P=0.006),具有统计学意义。基于未加权UniFrac距离进行主坐标分析,在计算PCoA时,首先对负特征根进行评估,即末尾的几个轴,发现负特征根的绝对值较小,因此未对负特征值进行校正。再由断棍模型评估各轴的特征值之后,选择前两轴进行映射作图。如图3所示,T2DM合并腹泻(P组)、T2DM(D组)组间存在明显差距,更充分说明PERMANOVA分析结果的可靠性。但从图上也可看出两组人群中有部分样本存在聚集现象,说明这部分样本人群的肠道菌群组成结构具有相似性。
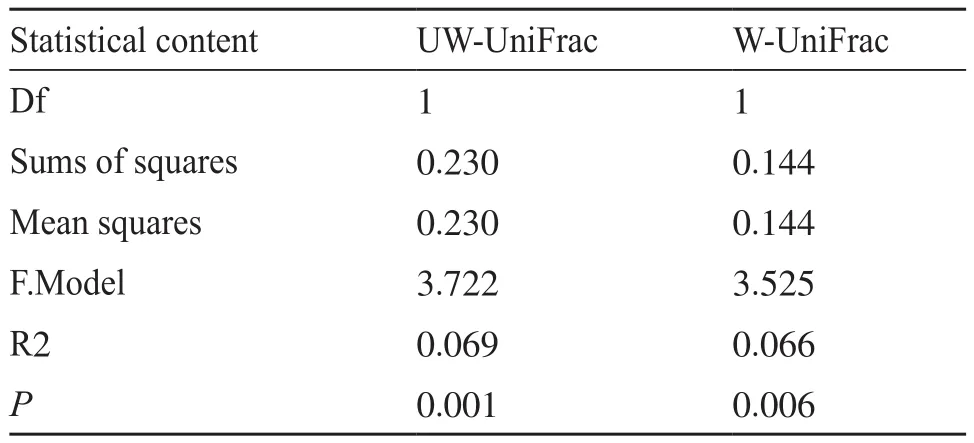
表4 基于β多样性距离测度的群落结构差异检验PERMANOVA分析Tab. 4 PERMANOVA analysis of community structure difference test based on β diversity distance measure
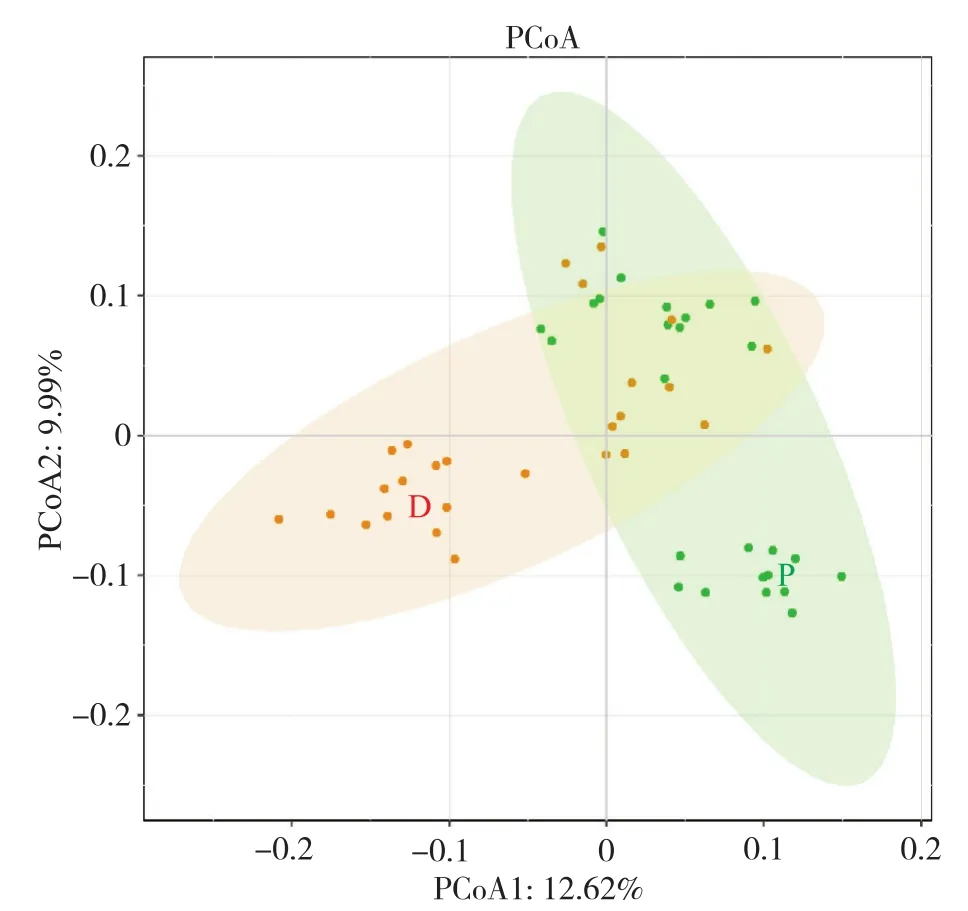
图3 两类人群基于UW-UniFrac距离的主坐标分析图Fig. 3 Principal coordinate analysis diagram based on UWUniFrac distance for 2 groups of people
2.4 肝肾临床特征与肠道菌群的相关性分析
T2DM合并腹泻患者肠道菌群与肝肾生化指标的相关性分析如图4a所示。瘤胃菌科与血糖检测指标和肝肾生化指标都具有显著相关性(P≤0.05),其中与HbA1c、GLU、GSP、TBIL、DBIL、IBIL、TG、Cr呈显著正相关(r=0.54),与HDL_C呈显著负相关(r=-0.60);毛螺菌科与HbA1c、TBIL、DBIL、HDL_C、Cr呈显著正相关(r=0.55,P≤0.05),与ALT、CHOL、TG呈显著负相关(r=-0.54,P≤0.05);拟杆菌科与HbA1c呈显著正相关(r=0.58,P≤0.05),与GLU、AST呈显著负相关(r=-0.52,P≤0.05);产碱杆菌科(Alcaligenaceae)与GLU呈显著正相关(r=0.55,P≤0.05),与CHOL呈显著负相关(r=-0.56,P≤0.05);普雷沃氏菌科与GLU呈显著正相关(r=0.56,P≤0.05)。
T2DM患者肠道菌群与肝肾生化指标的相关性分析如图4b所示。其中,瘤胃菌科和毛螺菌科在统计学意义上与血糖检测指标和肝肾生化指标具有显著相关性。毛螺菌科与HbA1c、GSP、TBIL、DBIL、IBIL、HDL_C、LDL_C、Cr呈显著正相关(r=0.55,P≤0.05),与AST、ALT、CHOL、TG、UA呈显著负相关(r=-0.56,P≤0.05);瘤胃菌科与HbA1c、GLU、GSP、ALT、DBIL、Cr呈显著正相关(r=0.56,P≤0.05),与HDL_C呈显著负相关(r=-0.59,P≤0.05);普雷沃氏菌科与GLU、BUN呈显著正相关(r=0.59,r=0.63,P≤0.05);产碱杆菌科与CHOL、HDL_C呈显著负相关(r=-0.55,r=-0.59,P≤0.05);Bacteroidales_S24-7_group与TBIL、DBIL呈显著负相关(r=-0.54,r=-0.58,P≤0.05);拟杆菌科与HbA1c、BUN呈显著正相 关(r=0.57,r=0.58,P≤0.05),与UA呈显著负相关(r=-0.55,P≤0.05)。
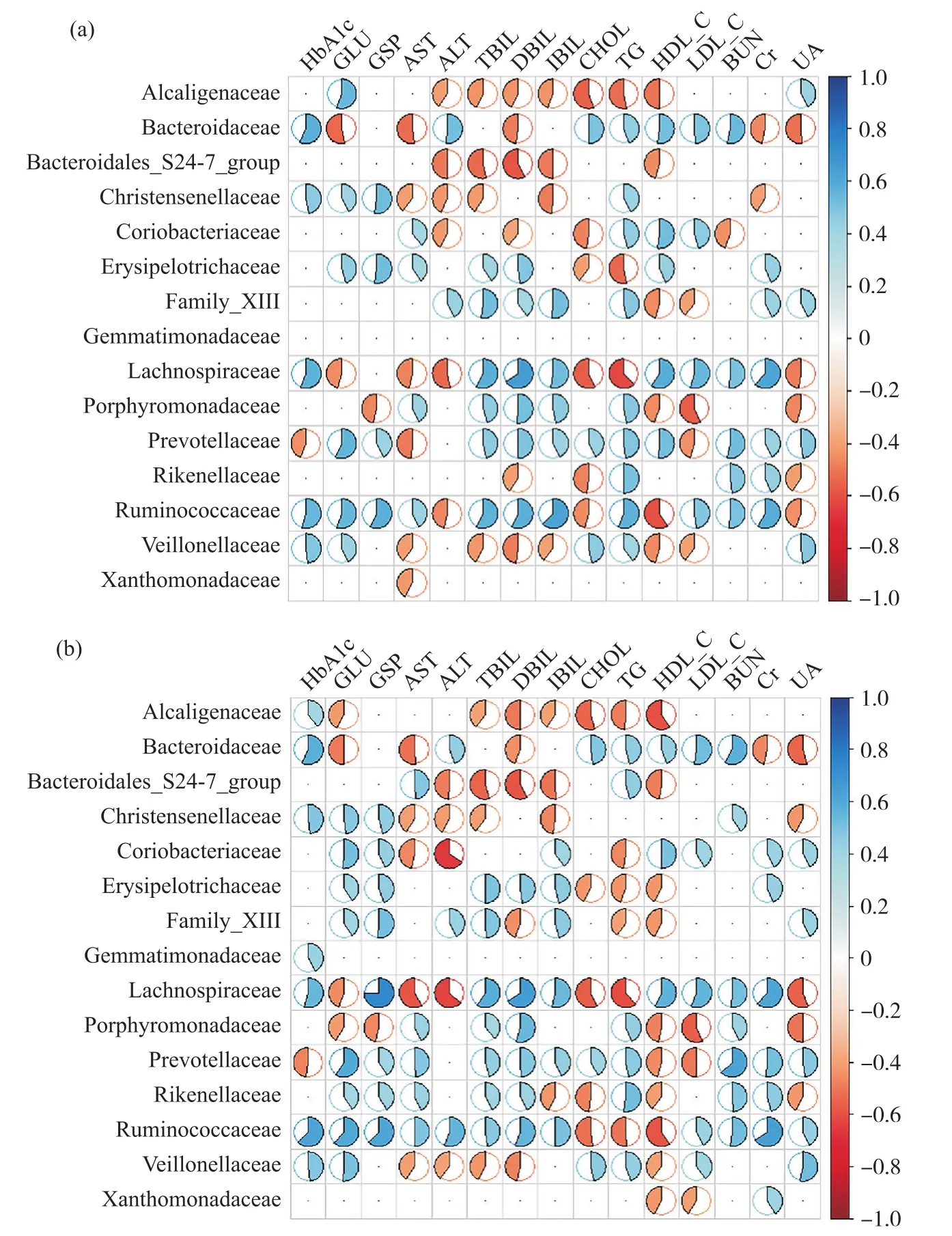
图4 两类人群在科水平上肠道菌群与肝肾生化指标相关性分析Fig. 4 Correlation analysis of gut microbiota and liver and kidney biochemical indexes in two groups of people in Family grade
所以,两组人群肠道菌群含量最多的四种细菌,即拟杆菌、毛螺菌、普雷沃氏菌和瘤胃菌与血糖指标均呈正相关;两组的瘤胃菌和毛螺菌与肝指标中的TBIL、DBIL、IBIL均呈正相关,与肾指标中的Cr正相关;且两组的毛螺菌与TG负相关,T2DM合并腹泻组的瘤胃菌与TG正相关;T2DM合并腹泻组的这四种主要细菌与BUN均无关,但是T2DM组的拟杆菌和普雷沃氏菌与BUN均呈正相关。
3 讨论
本研究首先对两组人群的血糖检测指标和肝肾生化指标进行了单因素方差分析,结果表明两组人群的血糖水平无显著性差异,这与梅坚[10]和范增顺[11]的研究结果不一致;两组的TG和BUN存在显著性差异,其中腹泻组的TG低于T2DM组,而BUN高于T2DM组,这是因为腹泻患者脂肪吸收不良以及肾血流量减少,进而导致TG降低,BUN升高。之后对肝肾生化指标与肠道微生物α多样性进行关联分析,结果显示T2DM合并腹泻患者在TBIL、DBIL、IBIL水平上与群落多样性呈负相关,在Cr水平上与菌群丰度呈显著正相关。血清胆红素(TBIL、DBIL、IBIL)是判断肝细胞损伤程度的重要指标,肝细胞受损会引起直接胆红素和总胆红素偏高[24]。在此次研究中T2DM合并腹泻患者和T2DM患者的TBIL、DBIL、IBIL含量都明显偏高,但只有T2DM合并腹泻患者的血清胆红素水平与肠道微生物α多样性显著相关。除此之外,T2DM合并腹泻患者的HbA1c水平与肠道菌群丰富度和多样性下降有关,而T2DM患者的HbA1c、GLU、GSP水平与肠道菌群的丰富度和多样性呈显著正相关。这说明两组患者的血糖水平与肠道微生物多样性具有相关性。
对两组人群的肠道菌群结构进行差异分析,发现二者的菌群结构在统计学意义上差异显著(P=0.001,P=0.006),其主坐标分析图如图3所示。在门水平上,厚壁菌、变形菌、拟杆菌是两类人群肠道中含量较高的细菌,这与徐峰等[16]研究一致。在科水平上,T2DM合并腹泻患者在拟杆菌、毛螺菌、普雷沃氏菌的含量上比T2DM患者明显降低,但瘤胃菌和其他细菌含量明显增高。除此之外,两类人群的肠道菌群与血糖水平和肝肾生化指标的相关性如图4a和图4b所示。两组人群的四种细菌与肝指标中的TBIL、DBIL、IBIL呈正相关,与肾指标中的Cr正相关。其中腹泻组的毛螺菌与TG负相关,瘤胃菌与TG正相关,说明腹泻患者脂肪吸收不良,与肠道菌群的变化有关;腹泻组的四种主要细菌与BUN均无关,但是T2DM组的拟杆菌和普雷沃氏菌与BUN均呈正相关,这说明腹泻虽然导致患者的BUN升高,但是与四种主要菌群的变化无关。
糖尿病腹泻的发病机制有多种,包括胃肠自主神经病变、肠道菌群失调、胰腺外分泌不足、胆汁酸吸收障碍、胃肠激素分泌异常、肛门括约肌功能障碍等。有研究认为菌群失调不是导致糖尿病腹泻的直接原因,而高血糖、自主神经病变是相关因素[10-11]。而我们的研究表明,两类人群肠道菌群结构差异显著,其中T2DM腹泻患者的拟杆菌、毛螺菌、普雷沃氏菌含量降低,而瘤胃菌含量升高。已有研究发现拟杆菌、普雷沃氏菌可诱导促炎基因的表达,增加炎症反应[25-27],而瘤胃菌产生的短链脂肪酸能减少致炎因子的产生,同时刺激抗炎因子的增加[28]。近年相关研究认为,炎症因子在糖尿病大血管病变中起到重要的作用[29]。高血脂、高血糖均会增加血管内皮细胞的通透性,引起血管内皮功能损伤,使得相关炎症因子(如CRP、IL-6、TNF-α)水平紊乱,从而加剧血管内皮功能损伤,导致肾小管滤过功能受损[30]。糖尿病肝病的临床症状较少且表现不典型,故常被忽视。但近年,糖尿病患者肝损伤的发生率越来越高,终末期肝病的死亡率也逐渐增加,糖尿病肝病引起了人们的重视[31]。范世宏[32]的研究表明,T2DM合并非酒精性脂肪肝患者的TG显著高于对照组,炎症因子水平TNF-α、IL-6、IL-10也显著高于对照组,但是与单纯T2DM组无显著差异。因此,糖尿病腹泻患者肠道菌群的变化是否能说明其炎症因子水平较低,进而表明其肝肾损伤水平较低还需进一步研究。此外,糖尿病患者胃排空时间显著延长,其中TG是胃排空延长的危险因素[33]。而我们的研究也表明,T2DM合并腹泻组的TG显著低于T2DM组,其中毛螺菌与TG呈负相关,瘤胃菌与TG呈正相关。因此,在后续的治疗中可通过服用益生菌、粪便移植等方法调节肠道菌群结构,增加短链脂肪酸产生菌(如瘤胃菌等),抑制产生内毒素的细菌,如变形菌门的细菌等。
本研究的局限性是临床病例有限,入组研究的样本数量不够大。此外,患者自身的生活习惯、其他病症等都会对数据产生一定的影响。比如,梅坚[10]和范增顺[11]的研究中T2DM合并腹泻患者的血糖比T2DM患者高,但是本文的研究表明两者的血糖并没有显著差异。因此,在后续的研究中将扩大样本量,进一步验证本文的结论。
综上所述,T2DM合并腹泻患者与T2DM患者的肝肾指标的TG和BUN存在显著性差异,T2DM合并腹泻患者的TG更低,BUN更高;两者在肠道菌群结构上存在显著性差异,其中T2DM合并腹泻患者的拟杆菌、毛螺菌、普雷沃氏菌含量降低,而瘤胃菌含量升高;T2DM合并腹泻患者血清胆红素的升高与肠道菌群的物种多样性的降低相关;两组的毛螺菌和瘤胃菌与血糖指标和血清胆红素均呈正相关,其中T2DM合并腹泻患者的TG的降低与毛螺菌和瘤胃菌相关,而BUN的升高与四种主要菌群无关。研究表明,T2DM合并腹泻患者的肝肾指标和肠道菌群结构与T2DM患者均存在差异,且肝肾指标与肠道菌群存在相关性,两类患者可通过改善肠道内瘤胃菌的含量调整肠道菌群的平衡,从而为治疗T2DM合并腹泻患者提供新思路。

