拟康宁木霉对甲基橙废水的酶促降解研究
王海琪,林 斌,潘硕滨,林锦美∗
(集美大学 a. 海洋食品与生物工程学院;b. 港口与环境工程学院,厦门 361021)
甲基橙(methyl orange)因具有显色剂性质且含有偶氮基而可作为偶氮染料。偶氮染料是现在染料市场中品种数量上最多的一种染料,因其合成简单、成本低廉、染色性能突出等优点,被广泛应用于纺织业、造纸厂工业生产中多种天然和合成纤维的染色和印花。偶氮染料通常含有复杂的芳香环结构,具有化学稳定性高、生物可降解性低等特点。多数染料及其代谢中间产物具有突变性、致癌性和其他毒性[1-3]。目前,投放市场的染料全世界多达30 000多种,每年排放到环境中的染料就高达600 000多吨[1-2]。甲基橙作为染料废水中较难降解的一种偶氮类化合物[3],需要一种经济高效的染料废水处理技术为其解决工业污染问题提供有力支持。相比于物理法和化学法,生物法具有吸附容量大、选择性强、效率高、消耗少、费用低等优点[4-5]。基于此,本研究选取拟康宁木霉菌种(Trichoderma koningii),通过驯化,先考察氮源、碳源、pH等因素对该菌种生长情况和甲基橙脱色率的影响;然后在该菌种生长的最佳培养条件下提取胞内酶后,通过研究初始甲基橙浓度、pH、反应温度、酶液投加量对甲基橙酶促降解的单因素和正交试验,得出拟康宁木霉胞内酶去除甲基橙废水的最优条件,初步揭示了拟康宁木霉降解甲基橙废水的较优酶促降解条件和机理。
1 材料与方法
1.1 试验材料
1.1.1 菌种与培养基
本研究所用拟康宁木霉菌种由本实验室提供,所用培养基为培养真菌常用的土豆培养基(土豆200.0 g/L,葡萄糖25.4 g/L,琼脂25.4 g/L,磷酸二氢钾2.1 g/L,硫酸镁 2.1 g/L)[4]。将拟康宁木霉菌种接种在灭菌后的培养基上,在24℃生化培养箱中培养4 d。
梯度驯化:在已接种的固体培养基中依次加入一系列不同质量浓度的甲基橙放入培养皿中,在24℃培养箱中进行菌种的培养驯化。将每一批从质量浓度最高的培养基中选出驯化好的菌种接种入下一批更大质量浓度的培养基中,将最终的优势菌种接种于甲基橙质量浓度为100 mg/L的固体培养基中保藏备用[7]。
1.1.2 模拟废水
甲基橙模拟废水的配制:称取1 g的甲基橙于1 L的烧杯中,用超纯水溶解后倒入1 L容量瓶中定容,配制成1 000 mg/L的样品溶液备用。
1.1.3 仪器与试剂
主要仪器:可见分光光度计(WFJ7200)、超声波细胞粉碎机(YXQ-LS-30SI)、智能生化培养箱(PHX)、恒温振荡器(SHA-C)、高速冷冻离心机(Avanti J-26XP)。
主要试剂:葡萄糖(分析纯)、磷酸二氢钾(分析纯)、硫酸镁(分析纯)、琼脂粉、氢氧化钠(分析纯)、硝酸(分析纯)、甲基橙、磷酸二氢钠(分析纯)、十二水合磷酸氢二钠(分析纯)。
1.2 试验方法
1.2.1 甲基橙标准曲线的绘制
分光光度法测定色度:取质量浓度为50 mg/L的甲基橙溶液于紫外-可见分光光度计上,在250~600 nm范围内进行扫描,甲基橙的最大吸收波长为463 nm。
取上述配制的甲基橙溶液分别制成0、1.00、2.00、3.00、4.00、5.00、6.00 mg/L的甲基橙溶液,待溶液充分混匀后测定吸光度。绘制标准曲线见图1。

图1 甲基橙的标准曲线Fig. 1 The standard curve of methyl orange
在甲基橙的最大吸收波长463 nm下测定每批处理前、后溶液的吸光度值A0、A。
标准曲线的计算公式如下:
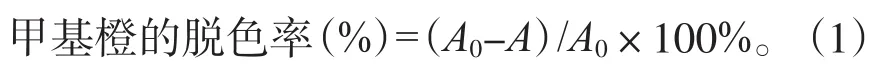
式(1)中,A为吸附染料后溶液的吸光度,A0为吸附染料前溶液的吸光度。
1.2.2 模拟废水样的预处理及测定
将震荡后的水样通过0.45 μm滤膜过滤,水样的吸光度测定步骤同1.2.1所述。
1.2.3 拟康宁木霉酶的提取[8]
胞内酶提取:菌株8 000 r/min离心15 min,收集菌体。将收集到的菌体用pH 7.0的0.05 mol/L 磷酸盐缓冲溶液(Na2HPO4-NaH2PO4)洗涤3次,离心收集菌体。以1.0 g 湿菌体添加3 mL磷酸盐缓冲液的比例,将菌体悬浮于缓冲溶液中,置于冰浴中用超声波细胞粉碎机的中粗探头处理10 次,每次1 min,功率为300 W,破碎时间为5 s,间隔5 s。最后离心除去细胞碎片,得到胞内酶液。
1.2.4 拟康宁木霉生长前期处理甲基橙废水可行性试验
菌种培养条件的探索:在含有甲基橙的液体培养基150 mL中接种驯化完毕的拟康宁木霉菌,在30℃、140 r/min的恒温振荡器内培养,培养过程中测定吸光度并计算脱色率[9-10]。
1.2.5 拟康宁木霉酶处理甲基橙废水单因素试验
分别从甲基橙浓度、pH、温度、酶投加量4个因素探讨对拟康宁木霉酶促降解的影响[11-12]。
1.2.6 拟康宁木霉酶促降解正交试验
为了寻求最佳配比关系,本次正交试验采用L9(33)的标准表,即三因素、三水平,共需完成9次试验。9组试验分别于最佳甲基橙质量浓度的条件下反应4 h后,测其吸光度并计算脱色率[13-14]。
1.2.7 拟康宁木霉菌酶促降解最适试验
在正交试验的基础上,选取最佳的酶液投加量、水浴温度、pH、甲基橙初始质量浓度进行反应,每隔一段时间检测吸光度并计算去除率,观察染料处理情况。
2 结果与分析
2.1 氮源(甲基橙)对拟康宁木霉培养过程脱色与生长量的影响
培养基中甲基橙质量浓度分别为10、30、50、70、100、150 mg/L,接种后培养72 h,取出测定吸光度与菌种重量,并计算甲基橙脱色率。由图2可知:当甲基橙初始质量浓度为10~30 mg/L时,拟康宁木霉菌对甲基橙废水的脱色效果逐渐增加;30 mg/L时甲基橙脱色率达到最大,脱色率可达74.53%,同时菌重也达到最大;30 mg/L后脱色效果逐渐下降。
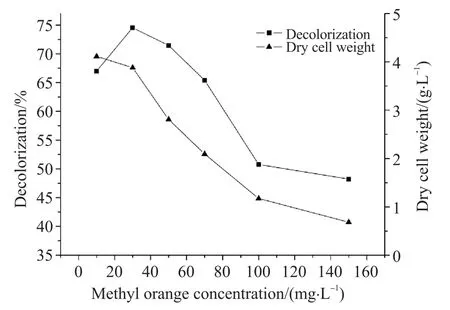
图2 氮源对拟康宁木霉生长前期脱色率与生长量的影响Fig. 2 Effects of nitrogen source on decolorization rate and growth amount of Trichoderma koningii in early growth period
拟康宁木霉在低质量浓度甲基橙的情况下,可以将甲基橙作为自身氮源转化利用,对甲基橙的脱色效果较佳;但过高质量浓度的甲基橙对细菌的生长存在较大的阻碍作用,当甲基橙的质量浓度达到100 mg/L以后,菌量的减少量放缓,拟康宁木霉生长受到限制。故取甲基橙质量浓度为30 mg/L作为较佳的氮源。
2.2 碳源(葡萄糖)对拟康宁木霉培养过程脱色与生长量的影响
制备含甲基橙质量浓度为30 mg/L的培养基6份,分别加入葡萄糖使其质量浓度为10、15、20、25、30、40 g/L,同2.1处理后计算脱色率。由图3可知,脱色率随葡萄糖质量浓度的增大呈S型,当质量浓度增大至25 g/L后趋于稳定,菌体干重随着葡萄糖质量浓度的增大而上升。据推测,随着培养基中葡萄糖的质量浓度增加引起拟康宁木霉酶的碳氮比变化,酶的产生受到抑制,导致脱色率降低。故设定葡萄糖质量浓度为25 g/L作为最佳碳源浓度[15]。
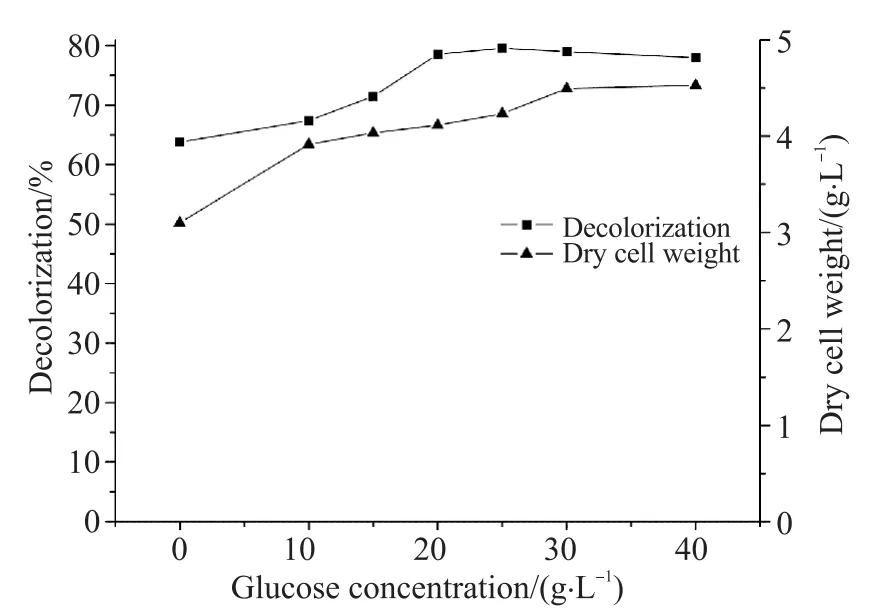
图3 碳源对拟康宁木霉生长前期脱色及生长量的影响Fig. 3 Effects of carbon sources on decolorization and growth of Trichoderma koningii in early growth period
2.3 pH对拟康宁木霉培养过程脱色与生长量的影响[16]
分别配制pH为5.0、5.5、6.0、6.5、7.0、8.0、8.5含甲基橙浓度为30 mg/L的培养基7份,接种驯化后的拟康宁木霉,同2.1处理并计算甲基橙脱色率。由图4可知:随着pH增加,染料脱色效果显著提高,菌量也逐渐增加;当pH为6.5时,脱色率达到最大,菌量趋于平缓;当pH大于6.5时,甲基橙脱色率逐渐下降,到pH为8.5时达到最低,菌量也随之下降。故选取拟康宁木霉生长pH为6.0~6.5。
图4 pH对拟康宁木霉生长前期脱色率与生长量的影响Fig. 4 The influence of pH on decolorization rate and growth amount of Trichoderma koningii in early growth period
2.4 甲基橙质量浓度对拟康宁木霉酶促降解效果的影响
配制甲基橙质量浓度分别为20、40、60、80、100、120 mg/L的磷酸盐缓冲溶液,预热10 min后取3.0 mL 加入0. 3 mL粗酶液,在温度30℃水浴中反应4 h,终止酶反应后测定甲基橙吸光度,并计算脱色率。由图5可知,随着甲基橙浓度的升高,拟康宁木霉胞内酶的酶促降解效果降低。这可能是因为甲基橙质量浓度增加,拟康宁木霉胞内酶受到抑制,酶促降解受到影响,甲基橙去除率逐渐下降。在低浓度情况下甲基橙的去除效率相对较高,故选取30 mg/L作为甲基橙反应的质量浓度。
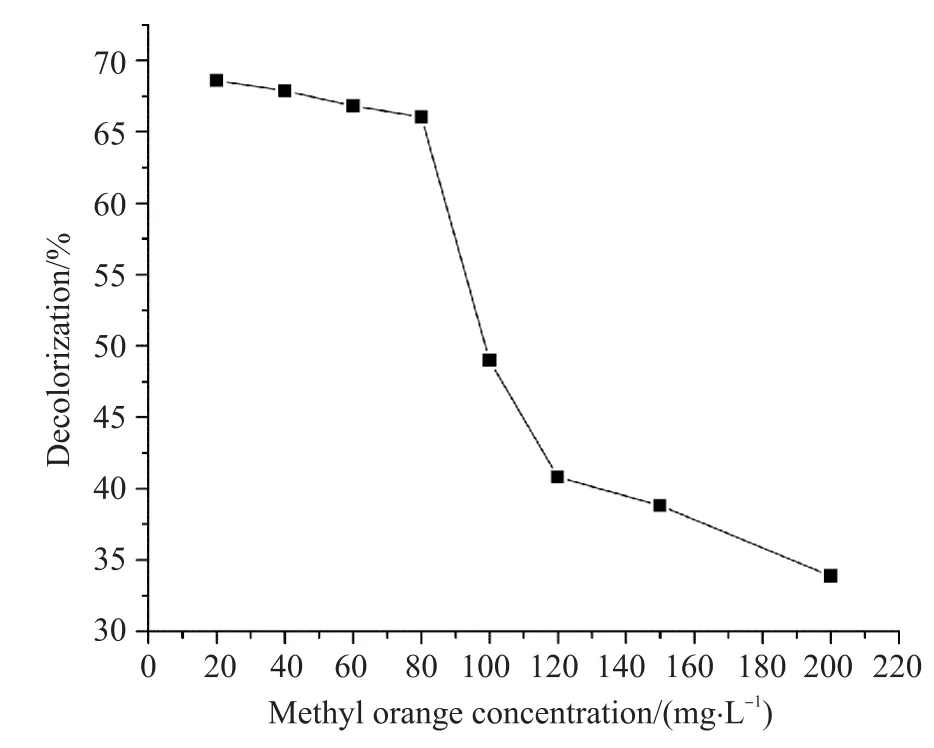
图5 甲基橙浓度对拟康宁木霉酶促降解效果的影响Fig. 5 Effects of methyl orange concentration on enzymatic degradation of Trichoderma koningii
2.5 pH对拟康宁木霉酶促降解效果的影响
配制含甲基橙质量浓度为30 mg/L的磷酸盐缓冲溶液,使其pH分别为5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5,同2.4处理并计算甲基橙脱色率。由图6可知:随着时间的推移,pH较低时,甲基橙的脱色率不高;pH在5.0~7.0时,酶促降解效果逐渐增加,pH为7.0时,脱色率最大;当pH大于7.0时,去除率逐渐下降,当pH为8.5时,脱色率达到最低。过高、过低的pH都会影响酶的稳定性,进而使酶遭到不可逆性的破坏。故选取拟康宁木霉胞内酶在偏中性的条件下反应[17]。
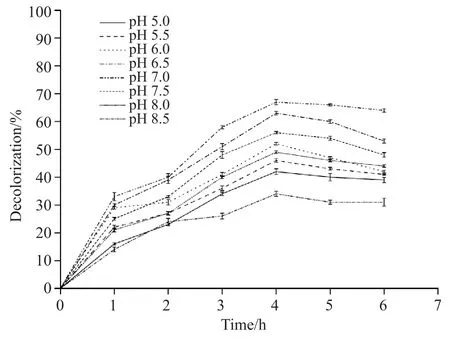
图6 pH对拟康宁木霉酶促降解效果的影响Fig. 6 Effects of pH on enzymatic degradation of Trichoderma koningii
2.6 温度对拟康宁木霉酶促降解效果的影响
配制pH为7.0的含甲基橙质量浓度为30 mg/L的磷酸盐缓冲溶液,取3.0 mL加入0.3 mL粗酶液,分别在温度为20、25、30、35、40、45℃的水浴中反应,同2.4处理并计算脱色率。如图7可见:当反应温度小于30℃时,随着时间的推移和温度的增加,染料脱色效果显著提高,反应温度大于35℃后,脱色率急剧下降;温度在25~35℃时,脱色率较高,在25℃时达到最大。以上结论说明,拟康宁木霉的酶促降解必须在适宜的温度范围内才能拥有较高的酶活力,温度过高会导致酶失活,温度过低容易使酶的活性受到抑制,影响甲基橙的去除效果,而该酶能在25~35℃范围内保持较高的脱色率,说明该酶能在较宽的温度范围内保持较高的活性。
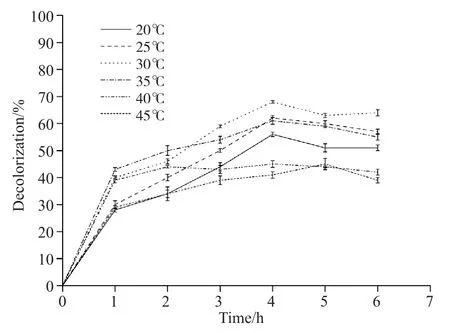
图7 温度对拟康宁木霉酶促降解的影响Fig. 7 The effects of temperature on enzymatic degradation of Trichoderma koningii
2.7 酶液投加量对拟康宁木霉酶促降解效果的影响
预热2.6中含甲基橙质量浓度为30 mg/L的磷酸盐缓冲液3.0 mL,分别加入0.1、0.2、0.3、0.4、0.5、0.6 mL粗酶液,并在25℃水浴中反应,同2.4处理并计算脱色率。如图8所示,随着时间的推移,甲基橙的脱色率逐渐提高。当酶液投加量增多时,甲基橙的脱色率趋于稳定,甚至出现下滑。根据米曼公式,酶促反应速率和酶浓度成正比,适当增加酶液投加量可以提高拟康宁木霉对甲基橙的去除效果,但酶液投加过多会使拟康宁木霉的降解酶趋于饱和,因营养物质的限制,各降解酶之间的竞争加大,使得脱色率无法提升,甚至有所降低。
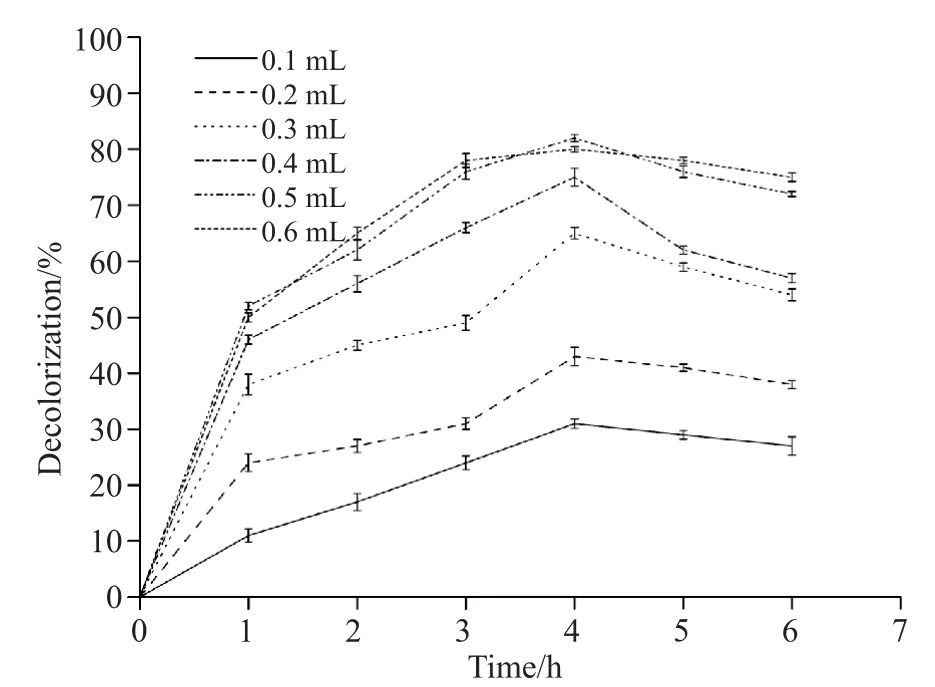
图8 酶液投加量对拟康宁木霉酶促降解的影响Fig. 8 The effects of the dosage of enzyme solution on enzymatic degradation of Trichoderma koningii
2.8 拟康宁木霉酶促降解正交试验
根据单因素试验结果,确定了酶液投加量、温度、pH为正交试验的因素,设定了3个水平进行酶促反应,以脱色率为指标进行考察。
由表2可知,将影响酶促降解效果的因素按从大到小排列,酶液投加量>反应温度>pH。由极差分析可知最优条件:酶液投加量为0.6 mL,反应温度为25℃,pH为 7.0。
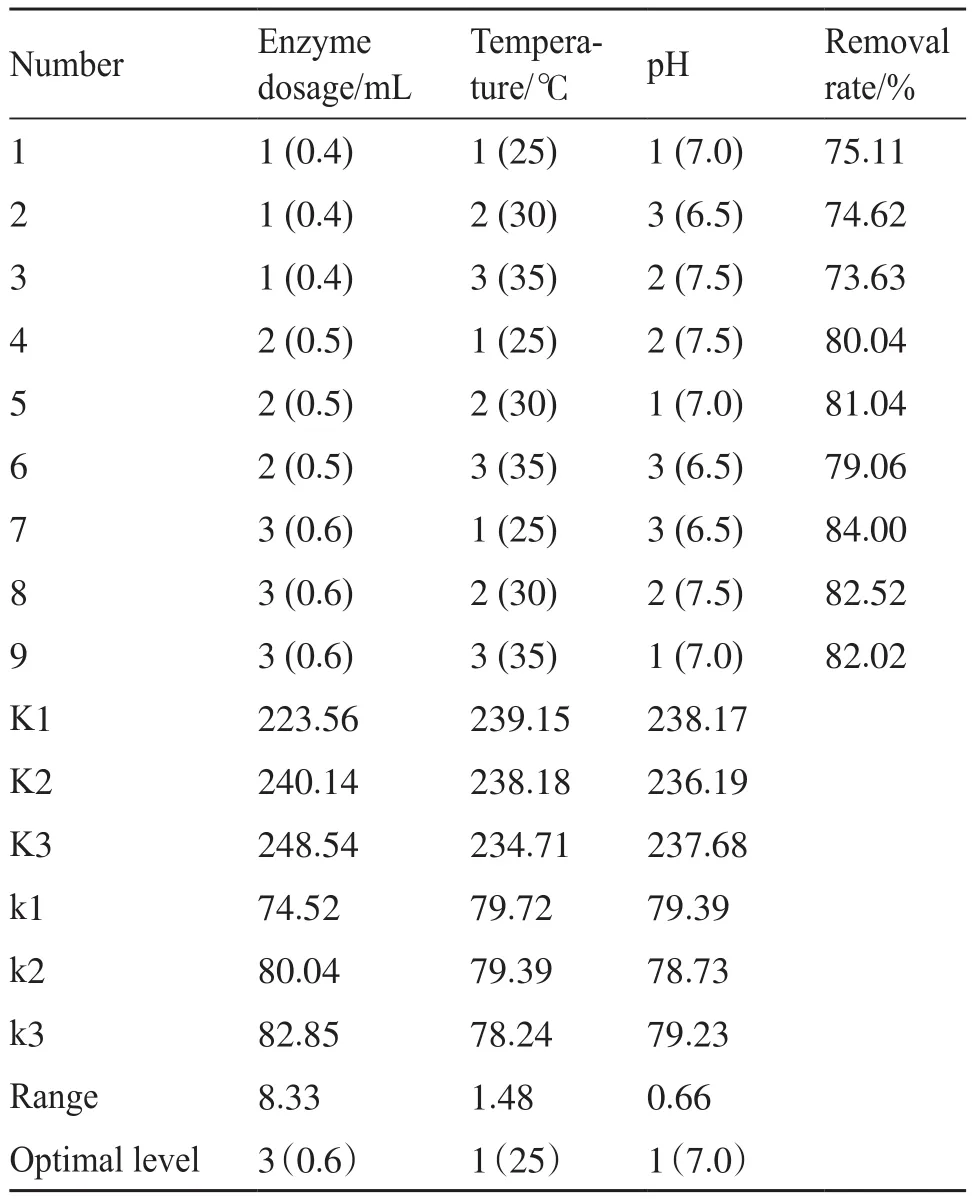
表2 拟康宁木霉酶促降解正交试验表Tab. 2 Orthogonal experimental table for enzymatic degradation of Trichoderma pseudokoningii
2.9 拟康宁木霉酶促降解最适反应条件
在酶液投加量为0.6 mL,水浴温度为25℃,pH为7.0,甲基橙初始浓度为30 mg/L的情况下反应,每隔一段时间检测吸光度并计算甲基橙脱色率,观察染料处理情况。由图9可知,在最适条件下拟康宁木霉对甲基橙的酶促降解效果明显,甲基橙的脱色率最高可达到85.48%。
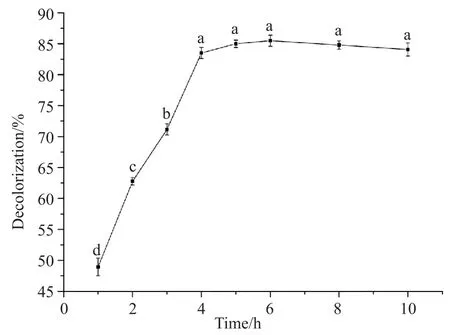
图9 最适条件下甲基橙酶促降解试验Fig. 9 Enzymatic degradation of methyl orange under optimal conditions
2.10 拟康宁木霉酶处理甲基橙模拟废水机理初步探索
真菌是通过自由基过程实现对污染物的化学转化的,自由基反应具有高度非特异性。化学物的降解过程是准一级动力学方程。利用McKinney模式,在好氧反应过程中,基质的代谢过程是被基质的量所控制的,并且基质的代谢速度遵循一级反应动力学[18-20]。
对于一级动力学反应:
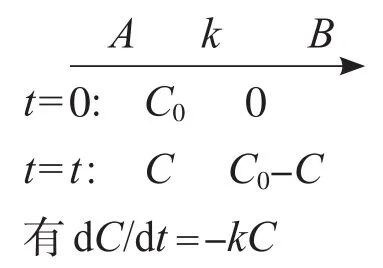
两边积分有:lnC0/C=kt+b(k为反应常数,C、C0分别表示t、t0时刻基质浓度)。
以ln(C0/Ci)对t作图,得到一直线,由此来验证拟康宁木霉菌降解甲基橙废水反应为一级动力学反应(图10)。
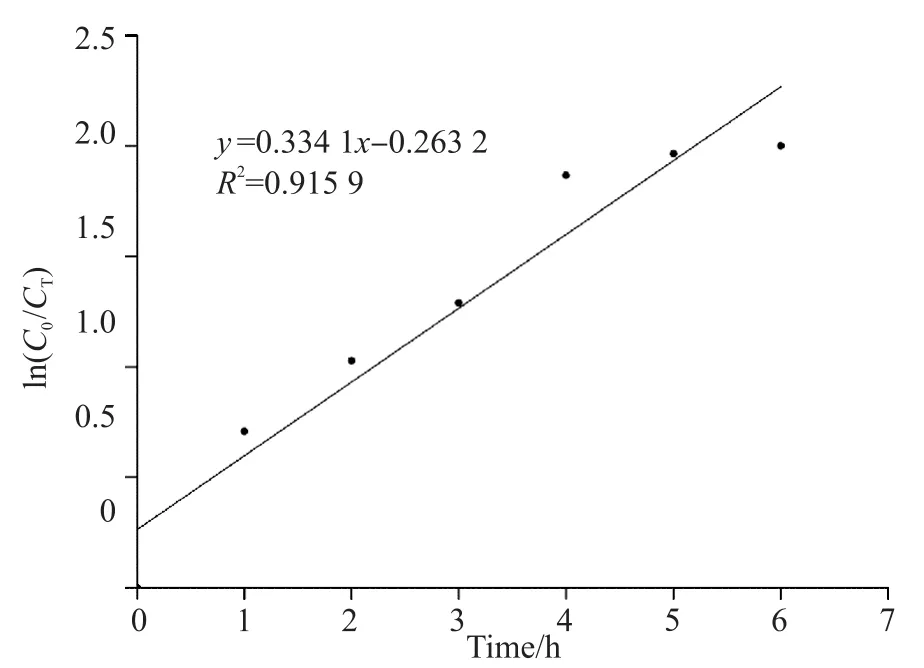
图10 拟康宁木霉菌降解甲基橙模拟废水动力学模型Fig. 10 Kinetic model of simulated wastewater degradation by Trichoderma koningii
根据最佳条件下试验所得结果,以ln(C/C0)对t回归,得
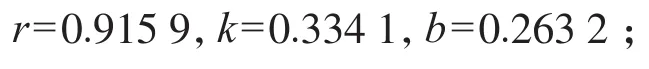

根据式(2),可以估计拟康宁木霉菌将甲基橙完全降解所需要的时间,以及降解到某一时刻甲基橙的质量浓度。拟康宁木霉菌处理甲基橙模拟废水的动力学研究结果与数据表明,拟康宁木霉菌处理甲基橙废水属于一级反应动力学。
3 讨论
本文在较佳培养条件下培养出拟康宁木霉,提取其胞内酶,通过研究初始甲基橙浓度、pH、反应温度、酶液投加量对甲基橙酶促降解的单因素和正交试验,得出拟康宁木霉胞内酶去除甲基橙废水的最优条件:酶液投加量为0.6 mL,反应温度为25℃,pH为 7.0。在最优条件下进行的最适试验中甲基橙去除率可以达到85.48%,属于一级反应动力学,相对于目前国内外报道的各种微生物应用于染料降解的脱色效率,本文的脱色效果较明显,为染料废水的酶促降解条件提供了参考。国外已有利用其他木霉降解亚甲基蓝等染料的研究,但利用拟康宁木霉对偶氮染料脱色方面的研究较少,因此本研究有一定创新性。文中酶促降解的模拟废水相对于实际生活的废水存在成分简单、污染物质过于单一等情况,下一步可通过改变驯化与培养条件使其扩展到吸附或降解其他污染物质,并对该菌的胞内酶降解其他偶氮染料的条件和机理进行试验,扩大其广谱性。最终把研究结果推广应用于实际,还需利用傅氏转换红外线光谱分析仪(Fourier transform infrared spectroscopy,FT-IR)、液相色谱质谱联用仪(liquid chromatography mass spectrometry,LC-MS)等技术分析该菌株胞内酶使甲基橙偶氮键断裂产生的芳香胺类降解产物如4-氨基甲基偶氮苯、2,4-二氨基甲苯等[21-23],进一步推测甲基橙的酶促降解途径,为从试验研究到工业化应用该菌种提供可靠的试验依据和相应的技术参考,实现该菌种处理相关染料废水的规模化应用。

