基于液相色谱-质谱联用技术探讨愈癫汤对精神分裂症大鼠神经递质含量的影响
白 冰,柴剑波,王万宇,赵永厚
(1. 黑龙江神志医院博士后科研工作站,黑龙江 哈尔滨 150036;2. 复旦大学中西医结合博士后流动站,上海 200433;3. 浙江省立同德医院,浙江 杭州 311100;4. 黑龙江神志医院,黑龙江 哈尔滨 150036;5. 黑龙江省精神心理卫生研究中心,黑龙江 哈尔滨 150036;6. 黑龙江中医药大学,黑龙江 哈尔滨 150040)
精神分裂症是一种重性精神疾病,病情迁延难愈,近年其发病率呈上升趋势。中医神志病学理论认为精神分裂症的基本病机为痰瘀互结、上扰脑神,治宜化痰消瘀。本课题组前期研究证实,愈癫汤可通过抑制精神分裂症大鼠额前脑组织一氧化氮(NO)活性,降低一氧化氮合酶(nNOS)比值、MDA含量及谷氨酸(Glu)表达,从而抑制Glu神经毒性[1-2]。本研究应用液相色谱-质谱联用(LC-MS/MS)技术,进一步观察了愈癫汤对精神分裂症模型大鼠不同脑区神经递质及其代谢产物的调节作用,从分子水平为愈癫汤治疗精神分裂症提供基础实验依据。
1 实验材料与方法
1.1实验动物 清洁级雌性SD孕鼠,购自青岛市实验动物和动物实验中心,动物合格证号:SCXK(鲁)2014-0001。大鼠饲养于SFP级实验动物房,昼夜节律12 h/12 h(7:00—19:00),温度(24±2)℃、湿度55%~60%恒定,自由进食水。
1.2实验药物 甲基氧化偶氮甲醇醋酸盐(MAM),配制成5 mg/mL的注射液。利培酮片(西安杨森,国药准字H20050160),配制成0.05 mg/mL的悬浊液。愈癫汤组方:清半夏15 g、制天南星15 g、牵牛子10 g、三棱15 g、莪术15 g、槟榔15 g、大黄10 g、茵陈蒿15 g。药材浸泡1 h,加药材重量3~5倍的水,煎煮2次,合并滤液,过滤,即得中药汤剂。预冻12 h(-80 ℃),升华干燥(-30 ℃,48 h),解析干燥(30 ℃,24 h),即得冻干粉。出粉率约为23.3%(样品出粉率= 冻干粉重量/生药总重量×100%)。
1.3实验试剂 多巴胺(DA)、3,4-二羟基苯乙酸(DOPAC)、高香草酸(HVA)、Glu、γ-氨基丁酸(GABA)、天冬氨酸(ASP)、内标L-2-氯-苯丙氨酸(Cl-Phe)(Sigma-Aldrich);甲醇、乙腈和甲酸(色谱纯,Thermo Fisher);超纯水(Milli-Q纯水机,Millipore)。
1.4标准溶液的配制 单标溶液DA、HVA用乙腈做溶剂配制母液(1 mg/mL),DOPAC用50%乙腈-水配制母液(0.5 mg/mL),Glu、GABA用纯水配制母液(1 mg/mL),ASP用纯水配制母液(0.25 mg/mL)。3倍比例稀释混标,得到7个系列标准工作液,最后一个混标的浓度为13.72 ng/mL。甲醇-水(1∶4)作为溶剂,配制内标Cl-Phe的母液(250 ng/mL)。将系列混标和内标混合,得到标准工作液。
1.5实验方法 在母鼠孕期17 d时,腹腔注射MAM 25 mg/kg建立精神分裂症感觉运动门控障碍模型,以PPI和AEP-P50抑制性缺损程度作为评价指标。选取母鼠所生雄性子鼠(体重80~100 g)30只,按体重分层随机分为模型组、愈癫汤组和利培酮组,每组10只。另选择健康大鼠所生健康雄性子鼠10只作为正常组。所有子鼠正常饮食、水,5周龄时,愈癫汤组给予愈癫汤2.3 g/kg灌胃,利培酮组给予利培酮混浊液0.36 mg/kg灌胃,正常组和模型组灌胃等量蒸馏水,均连续灌胃3周。
1.6神经递质含量检测方法
1.6.1样本的制备 灌胃3周结束后处死各组子鼠,取鼠脑组织样本(海马和纹状体)30~50 mg,装入EP管中。加入400 μL Cl-Phe(75 ng/mL)作为内标的甲醇-水混合溶液(含0.1%甲酸,v/v=4/1),低温匀浆,超声提取(冰水浴),离心(4 ℃,14 000 g),混合提取液,共500 μL,离心浓缩仪挥干,取150 μL上层溶液,装入进样小瓶。
1.6.2检测方法及数据处理 参考文献[3-4],采用AB Sciex Triple Quad TM 6500质谱系统和Waters ACQUITY UPLC色谱分离系统进行LC-MS/MS检测分析;仪器控制、数据采集和分析采用Analyst 1.5.2软件。测评条件:采用Waters UPLC氨基柱(2.1 mm×100 mm,1.7 μm,40 ℃)进行代谢物分离。色谱条件:流动相包括0.15%甲酸的水溶液(A)和乙腈(B),采用梯度分离(0.25 mL/min),进样量2 μL。0 min,5%B;0.1 min,15%B;2 min,20%B;2.3 min,25%B;2.31 min,50%B;5.31 min,50%B;5.57 min,65%B;6.57 min,65%B;6.58 min,100%B;11 min,100%B;11.5 min,5%B;13 min,5%B。质谱条件:电喷雾离子源,正负模式切换,多反应检测(MRM)具体参数见表1。MRM transition进行自动识别和积分(默认参数)。以质谱峰面积/内标峰面积为纵坐标,浓度为横坐标,绘制线性回归标准曲线。将样品的质谱峰面积代入标曲的线性方程中,计算浓度,并以样品实际重量进行校正。
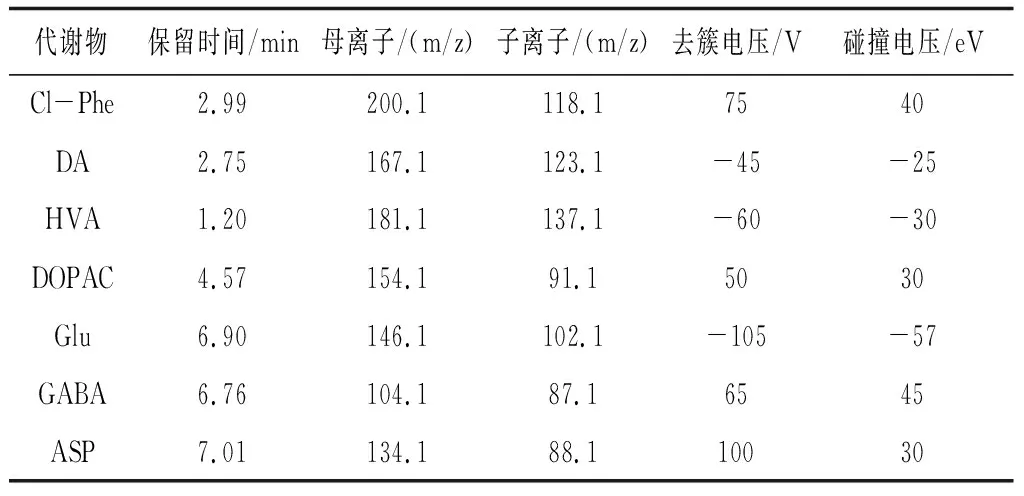
表1 多反应检测参数

2 结 果
2.1各组子鼠纹状体组织中DA、HVA、DOPAC含量比较 模型组DA、HVA、DOPAC含量均明显高于正常组(P均<0.05);愈癫汤组、利培酮组DA、HVA、DOPAC含量均明显低于模型组(P均<0.05);愈癫汤组DA、HVA含量均明显低于利培酮组(P均<0.05),愈癫汤组、利培酮组DOPAC含量比较差异无统计学意义(P>0.05)。见表2及图1~3。

表2 各组子鼠纹状体组织中DA、HVA、DOPAC含量比较

图1 多巴胺(DA)的UPLC-MS/MS ESI+MRM图

图2 高香草酸(HVA)的UPLC-MS/MS ESI+MRM图
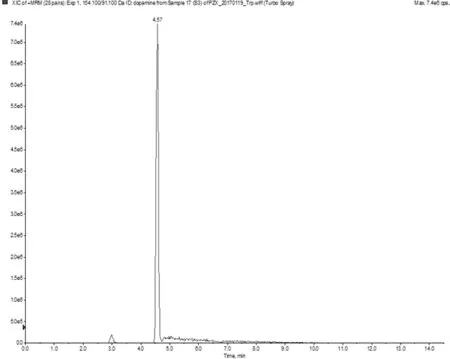
图3 3,4-二羟基苯乙酸(DOPAC)的UPLC-MS/MS ESI+MRM图
2.2各组子鼠海马组织中Glu、GABA、ASP含量比较 模型组Glu和ASP含量均明显低于正常组(P均<0.05),GABA含量明显高于正常组(P<0.05);愈癫汤组、利培酮组Glu和ASP含量均明显高于模型组(P均<0.05),利培酮组GABA含量明显低于模型组(P<0.05);愈癫汤组Glu含量明显高于利培酮组(P<0.05),愈癫汤组、利培酮组GABA和ASP含量比较差异均无统计学意义(P均>0.05)。 见表3及图4~6。

表3 各组子鼠海马组织中Glu、GABA、ASP含量比较
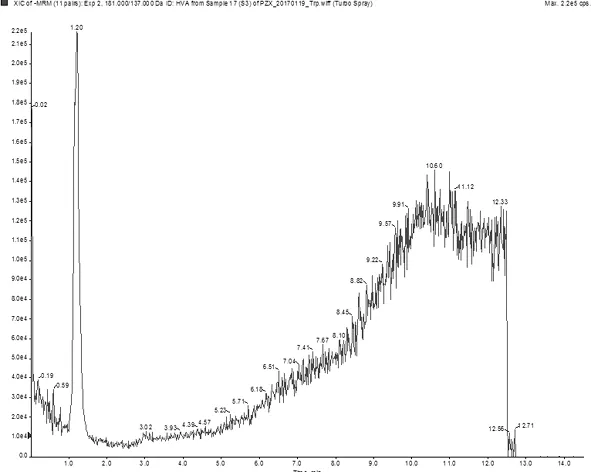
图4 谷氨酸(Glu)的UPLC-MS/MS ESI+MRM图

图5 γ-氨基丁酸(GABA)的UPLC-MS/MS ESI+MRM图

图6 天冬氨酸(ASP)的UPLC-MS/MS ESI+MRM图
3 讨 论
通过神经生化和影像、大脑病理形态和病理生化分析、精神药理学的多项研究证明,精神分裂症患者存在Glu能神经元功能异常[5-6]。Glu刺激N-甲基-D-天冬氨酸受体(NMDA-R)和GABA能神经元,作用于大脑皮质和边缘系统中兴奋性神经递质介导的传导通路,阻断神经元发出的神经冲动,形成负反馈机制调节自身释放,起神经抑制作用。NMDA-R阻滞α造成兴奋性传导的脱抑制状态,导致大脑神经递质过度释放,产生一系列神经精神症状。Glu作用于NMDA-R,增加兴奋性突触后电位,与DA能系统相互影响[7]。精神分裂症的发病涉及海马、纹状体、皮质-纹状体环路中的Glu能系统,与DA能系统可能存在某种形式的联系,拮抗中脑-纹状体DA能神经元,通过负反馈抑制Glu的释放。Glu在谷氨酸脱羧酶(GAD)的催化下生成GABA,参与Glu能神经元介导的兴奋过程[8]。多种神经递质共同调节中枢神经系统兴奋性和抑制性的稳态,维持大脑的正常生理活动。
Glu-GABA-DA神经递质网络参与精神分裂症的发病,经前额叶皮质Glu能神经元传导,中途换为GABA,终止于边缘系统的DA能神经元。Glu与GABA处于同一条神经代谢通路上,GABA的抑制性缺陷能够导致Glu和DA等兴奋性神经递质过度活化[9]。在精神分裂症的发病和治疗机制中,GABA和DA能系统存在相互调节作用。GABA能神经元通过纹状体-黑质通路,抑制DA能神经元;DA能神经元可能通过激动抑制性突触后电位,正反馈调节GABA能神经元[10-11]。免疫电镜双标技术发现,大鼠大脑DA能神经末梢系统以对称性突触支配着GABA能中间神经元 ,且与核内的Glu能投射神经元形成突触联系[12]。Glu、GABA和DA存在于共同的神经环路中,影响彼此的释放和功能活动,共同调控大脑功能[13]。
本实验结果显示,模型组大鼠纹状体中DA及HVA、DOPAC含量增加,存在DA能系统功能亢进,从而抑制纹状体、海马、皮质-纹状体环路中的Glu能系统,使海马Glu含量减少;Glu与GABA处于同一条神经代谢通路上,通过皮质-边缘Glu-GABA循环通路,活化GABA能系统,使海马GABA含量增加,ASP含量减少。经过愈癫汤干预后,大鼠纹状体DA、HVA、DOPAC含量减少,海马Glu、ASP含量增加而GABA含量减少。愈癫汤可能通过作用于Glu-GABA-DA神经递质网络,调控共同神经环路中Glu、GABA和DA的相互关系,影响彼此的功能活动和递质释放,帮助大脑恢复正常的生理功能活动,改善精神分裂症患者的认知功能。但精神分裂症的发病机制复杂,愈癫汤是否可通过其他途径发挥治疗精神分裂症的作用尚有待研究。
利益冲突:所有作者均声明不存在利益冲突。

