CXCR2对胃癌细胞侵袭、迁移及凋亡的影响
陆伟辉, 刘 威, 王 聪, 王正林
(1.复旦大学附属中山医院青浦分院普外科,上海 201700;
2.复旦大学附属中山医院普外科,上海 200032)
CXC类趋化因子受体2(C-X-C motif chemokine receptor,CXCR2)是促炎趋化因子的主要受体,主要表达于中性粒细胞、浆细胞、单核细胞、巨噬细胞以及内皮细胞[1-3]。其与肿瘤发生、发展密切相关。Robinson等[4]研究显示,CXCR2促进脑肿瘤的生长及进展。CXCR2活化促进乳腺癌侵袭、转移[5]。既往研究显示CXCR2在胃癌组织中高表达,是胃癌病人的独立不良预后因素[6-8],但其作用机制仍不明确。本研究旨在探索CXCR2对胃癌细胞侵袭、迁移和凋亡的影响。
材料与方法
一、材料
胎牛血清 (批号:16000-044)、Trizol试剂 (批号:15596-026)、Optim-MEM 培养基 (批号:51985-034)均购自美国Gibco公司。RPMI-1640培养基(批号:R8758)购自Sigma公司。细胞计数试剂盒(CCK-8,批号:C0038)购自 Beyotime公司。 CXCR2 siRNA(批号:AM16708)和 Lipofectamine 2000 购自Invitrogen公司。膜联蛋白Ⅴ(AnnexinⅤ)/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒(批号:556547)购自BD Pharmingen公司。白细胞介素8(interleukin 8,IL-8)ELISA试剂盒(批号:D8000C)购自R&D公司。CXCR2抗体(批号:ab14935)购自Abcam公司。Transwell侵袭小室(批号:3422)购自美国Costar公司。
二、细胞培养与转染
人胃癌细胞SGC-7901、MGC80-3购自中国科学院上海生命科学研究院。所有细胞培养于含10%胎牛血清的RPMI-1640培养基中,在37℃、5% CO2培养箱培养。
三、蛋白质印迹法
收集细胞,用细胞裂解液裂解细胞提取总蛋白。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离,恒流300 mA转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜。磷酸缓冲盐溶液(phosphatebuffersaline,PBS)洗涤膜3次,每次5min,加入适当比例稀释的一抗,4℃过夜。去除洗涤液,立即加入稀释的二抗,摇摆床上室温培养2 h。结束后去除洗涤液,PBS中洗涤3次,每次10 min。取电化学发光 (electrochemilumine scence,ECL)试剂加膜上,约1 min,使用计算机自动显影系统(ImageQuant LAS 4000 mini)进行显影。
四、荧光实时定量聚合酶链反应
取慢病毒感染后的胃癌细胞培养72 h,待细胞融合度达90%时收集细胞。用Trizol试剂提取细胞总RNA,按说明书操作。总RNA经紫外分光光度计测定260 nm与280 nm处吸光度(A)值,A260/A280为1.9~2.1。每份样品中取3 μg RNA行反转录合成cDNA。取 1 μL cDNA行聚合酶链反应(polymerase chain reaction,PCR)扩增。CXCR2上游引物: 5′-CCTACAACCTGGTCCTGCTG-3′, 下游引物: 5′-TGAGGCAGCTGTGAAGGATG-3′;IL-8 上游引物: 5′-ACACTGCGCCAACACAGAAA-3′,下游引物:5′-AACCCTCTGCACCCAGTTT-3′;GAPDH 上游引物: 5′-CCAAAATCAAGTGGGGCGA-3′, 下游引物:5′-TGATGACCCTTTTGGCTCCC-3′。
五、建立CXCR2过表达细胞系
CXCR2过表达的慢病毒购自吉玛基因公司。转染的前1天,以每孔约2×105个细胞预先将细胞接种到6孔板中;第2天,用含有聚凝胺(polybrene)的培养基替换原培养基,加入适量的慢病毒悬液,混匀后37℃温箱培养过夜。第3天,加入新鲜培养基稀释polybrene,再次37℃温箱中培养过夜。接着第3~4天继续培养。根据细胞生长情况传代,采用嘌呤霉素筛选,同时继续传代。筛选出带有抗性的细胞为成功转染细胞。
六、瞬时转染
CXCR2 siRNA及对照序列均购自Invitrogen公司,采用Lipofectamine 2000试剂盒。转染前1 d,乙二胺四乙酸 (ethylenediamine tetraacetic acid,EDTA)消化细胞后,将细胞加入6孔板中,转染时细胞密度90%为宜。无血清、无抗体的Optim-MEM培养基中加入DNA 2 μg。采用该细胞培养基稀释4 μL Lipofectamine 2000转染试剂,混匀后室温放置30 min。混合上述两种溶液后,加入含有细胞的培养孔中,轻轻摇匀后室温放置5 min,放入37℃温箱培养过夜。第2天从培养箱中取出细胞,将培养基换成含血清培养基,保温24~72 h后准备蛋白质印迹法表型验证。
七、transwell侵袭迁移实验
将细胞接种于含人工基质Matrigel的transwell小室中。37℃、5% CO2条件下培养 24~48 h后,取出transwell小室。用棉签擦去Matrigel胶上和上室中的细胞,使用结晶紫染色。显微镜观察、拍照。同一实验处理条件设置3个平行孔,每孔随机选取5个视野,计算染色细胞数。
八、细胞增殖实验
EDTA消化制备细胞悬液,以每孔约5 000个细胞接种到96孔板。同一实验因素设置3个平行孔。37℃培养,此时设置为基线0 h的细胞活性,给予相应的干扰因素后培养,相应时间节点行细胞活性检测。每孔加入10 μL CCK8试剂,混匀后培养1 h。测定450 nm吸光度,结果设置为(A),对照波长设置为630 nm。计算细胞的相对增殖活性=(Ax h-A空白对照)/(A0 h-A空白对照)。
九、细胞凋亡检测
用EDTA消化胃癌细胞。用PBS洗涤3次悬浮细胞。PBS重新悬浮细胞1次。2 000 r/min(离心半径9 cm)离心5 min后再次洗涤,调整细胞密度为106。取100 μL细胞悬液进行标记,加入5 μL的AnnexinⅤ-FITC。充分混匀后,在避光条件室温下 15 min。流式检测前加入5 μL的PI,上机检测前再加200 μL缓冲液。采用流式细胞仪检测。根据细胞染色情况,确定活细胞为PI-/FITC AnnexinⅤ-,坏死细胞为PI+/FITC AnnexinⅤ-,早期凋亡细胞为PI-/FITC AnnexinⅤ+,晚期凋亡细胞为PI+/FITC AnnexinⅤ+。
十、统计学分析
CXCR2上调实验中,对照组为vector,实验组为CXCR2;CXCR2下调实验中,实验组使用siRNA来沉默RNA表达,为siCXCR2,对照组使用试剂盒的标准对照序列,为siScr。数据分析采用SPSS 21.0软件。组间均数比较,Student t检验分析。P<0.05为差异有统计学意义。
结 果
一、CXCR2促进胃癌细胞侵袭,提高增殖活性
在胃癌细胞稳定过表达或瞬时下调CXCR2的表达后(见图1),检测CXCR2的表达对胃癌细胞增殖活力及侵袭转移能力的影响。
胃癌细胞上调CXCR2后 (MGC80-3细胞系见图 1A、C,SGC-7901 细胞系见图 1B、D),transwell实验证实胃癌细胞的侵袭、迁移能力较对照细胞显著增强 (MGC80-3 细胞见图 2A、B、C,P=0.02;SGC-7901 细胞见图 2D、E、F,P=0.01)。相反,笔者以小干扰RNA(siRNA)干扰细胞CXCR2的表达,CXCR2蛋白表达下调 (MGC80-3细胞系见图1A、C,SGC-7901细胞系见图1B、D)。CXCR2下调后,胃癌细胞的侵袭、迁移能力受到显著抑制(MGC80-3细胞见图 3A、B、C,P=0.01;SGC-7901 细胞见图 3D、E、F,P=0.01)。CCK8实验证实胃癌细胞系中CXCR2上调后增殖活性显著增强(见图 4 A、C,P<0.01),CXCR2 表达下调后胃癌细胞系增殖活性显著下降(见图4B、D,P<0.01)。

图1 胃癌细胞稳定过表达CXCR2的构建及采用RNA干扰技术下调CXCR2表达
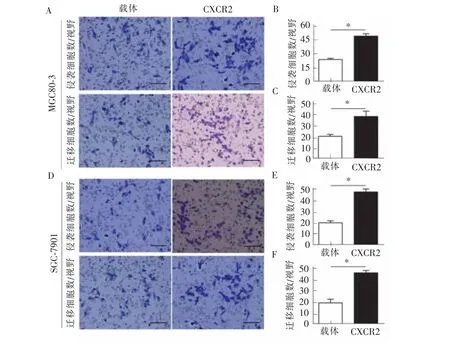
图2 胃癌细胞上调CXCR2表达对胃癌细胞侵袭、迁移的影响
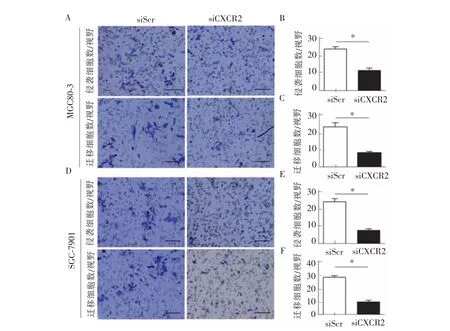
图3 胃癌细胞干扰下调CXCR2表达对胃癌细胞侵袭、迁移的影响
二、CXCR2过表达抑制胃癌细胞凋亡
通过稳定转染技术过表达胃癌细胞CXCR2,通过转染技术干扰胃癌细胞CXCR2的表达,以流式细胞技术检测胃癌细胞在无化疗药物、无血清培养基中培养24 h的凋亡情况。结果显示,上调CXCR2表达后胃癌细胞的凋亡率显著低于对照细胞(见图 4 E~H,P<0.01);下调 CXCR2 表达后,细胞凋亡率显著高于对照细胞(见图4 I~L,P=0.02)。上述结果说明,在无药物诱导时,胃癌细胞CXCR2的表达可抑制凋亡,维持胃癌细胞的生存。
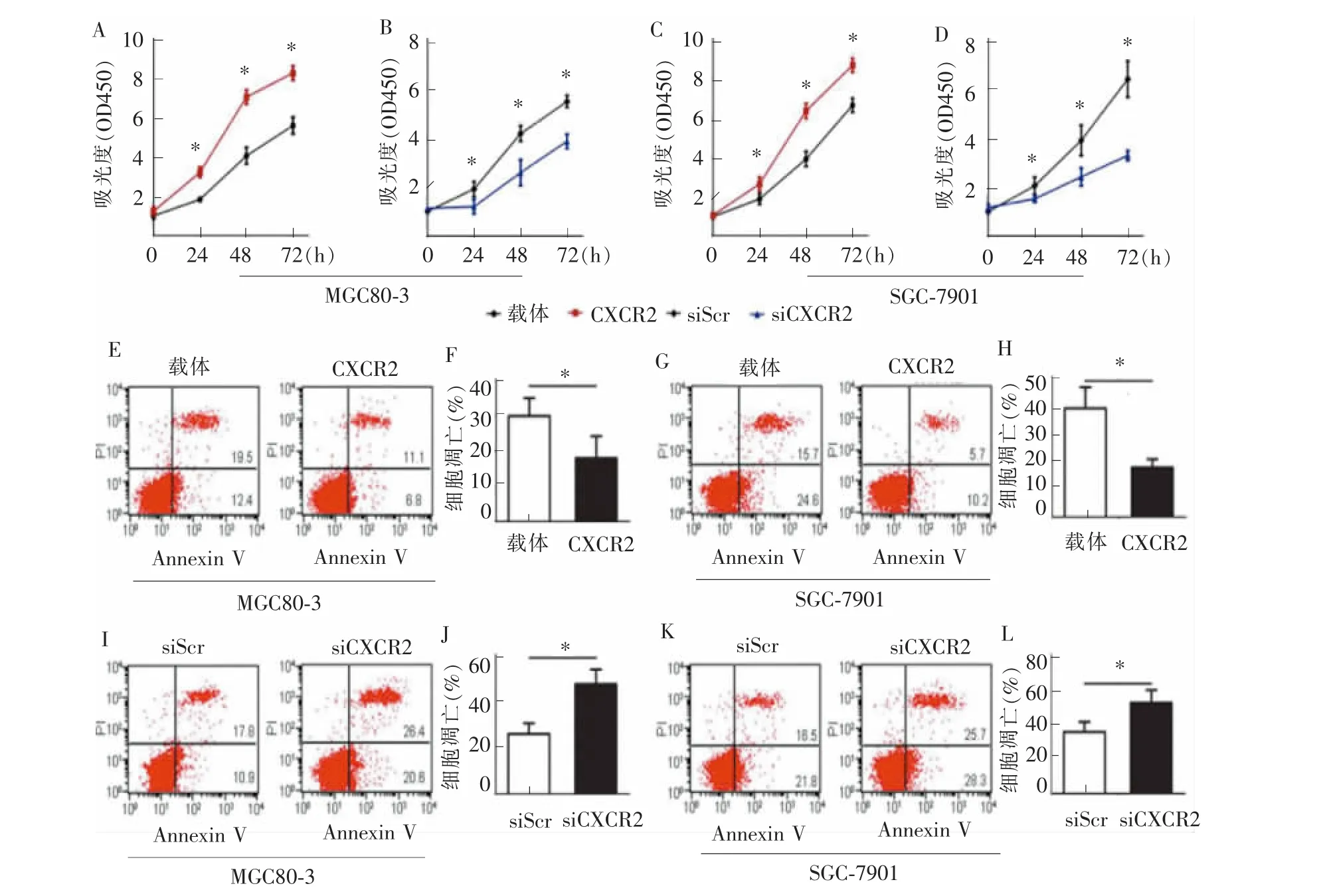
图4 上调或干扰胃癌细胞CXCR2表达对细胞增殖及凋亡的影响
三、胃癌CXCR2增强Akt磷酸化、上调Bcl-2抑制胃癌细胞凋亡
检测稳定过表达CXCR2细胞内Akt、Erk等与胃癌进展密切相关分子的表达量及其磷酸化情况。结果显示,CXCR2过表达可导致胃癌细胞Akt磷酸化水平显著上调,而Erk的磷酸化水平无显著改变(见图5A、C)。对凋亡相关蛋白Bcl-2、Bcl-XL及存活蛋白(survivin)检测发现,Akt磷酸化水平与凋亡抑制蛋白Bcl-2的表达水平一致,而Bcl-XL和存活蛋白表达量不受CXCR2影响(见图5B、D)。
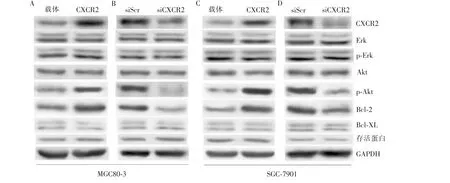
图5 胃癌细胞CXCR2过表达抑制凋亡的机制
讨 论
19世纪,Virchow首次描述炎症与癌症之间的关联[9]。多种类型的癌症起病过程中均有慢性炎症参与其中,其中趋化因子在将白细胞诱导至炎症和肿瘤所在部位的过程中发挥至关重要的作用[10-12]。促炎趋化因子参与慢性炎症进程及肿瘤微环境的形成。一个典型的例子是肿瘤部位分泌的IL-8通过趋化表达CXCR2的中性粒细胞向肿瘤部位迁移,后者参与肿瘤微环境分泌一系列生长因子及基质金属蛋白酶类,促使肿瘤生长、浸润及转移[13]。
趋化因子是细胞因子中一大类具有化学趋化作用的蛋白质。按照其二级结构中的N端氨基酸残基主要分 4大类:C、CC、CXC、CX3C类。 C类 N端仅有1个半胱氨酸;CC类N端不插入其他氨基酸残基;CXC类N端2个半胱氨酸残基中插入1个其他氨基酸残基;CX3C类N端插入3个其他氨基酸残基。趋化因子发挥多种功能,其配体主要结合相应的受体,激活下游信号通路,发挥功能。其受体属于G蛋白偶联的7次跨膜受体,根据其结合的趋化因子配体类型进行分类。目前发现1种C类趋化因子受体 (XCR1)、11种CC类趋化因子受体(CCR1~11)和6种CXC类趋化因子受体(CXCR1~6)。多项研究显示,CXC类趋化因子受体在多种肿瘤的发生、发展中起着重要作用[14-15]。1991年,CXCR2从人中性粒细胞系克隆获得。其与CXCR1都属于G蛋白偶联受体家族成员,在氨基酸组成水平上CXCR2与CXCR1的同源度达到78%,两者均可结合IL-8发挥生物学作用[16-17]。同时两者的分布特点类似。但两者在生物学功能上仍存在差异。CXCR1的配体主要为IL-8及CXCL6。相比CXCR1,CXCR2 有多个配体,包括 CXCL 1~3、CXCL 5~8[18]。CXCR2的生物学功能可能更复杂。笔者既往研究发现,CXCR2在胃癌组织中较相应正常胃黏膜组织中过表达。统计学分析显示,CXCR2高表达与胃癌进展呈正相关,并预示病人预后差[8]。在诱导内皮细胞趋化参与血管形成的过程中,CXCR2是发挥介导作用最主要的趋化因子受体[19]。所有具有ELR基序的CXC趋化因子均可通过结合CXCR2介导血管形成,而血管形成是肿瘤细胞增殖的重要条件[20]。Heidemann等[3]研究发现,CXCL8结合并激活CXCR2后,内皮细胞的纤维聚合能力、增殖能力以及细胞内下游信号分子ERK1/2磷酸化能力均显著增强。在以CXCR2特异性抗体或ERK1/2抑制剂处理细胞后,上述增强作用消失。通过敲除小鼠CXCR2基因构建的角膜微囊袋模型也证实CXCR2在血管生成过程中的重要作用[20]。胃癌病人中CXCR2的异常表达及高表达者生存预后相对较差,可能与CXCR2诱导肿瘤血管形成有关。因此,本研究对CXCR2在胃癌中的表达及功能进行探索。通过稳定上调胃癌细胞株中CXCR2的表达水平,发现CXCR2高表达后胃癌细胞的侵袭和转移能力显著增强,而下调CXCR2后胃癌细胞的侵袭、转移能力被显著抑制。
本研究发现过表达CXCR2后,胃癌细胞凋亡显著减少,而下调CXCR2后胃癌细胞的凋亡明显增强。既往研究发现凋亡抑制蛋白Bcl-2在胃癌发生中起着重要作用[21]。通过蛋白质印迹实验,发现CXCR2抑制胃癌细胞凋亡的机制在于CXCR2使细胞内Akt磷酸化水平升高,继而使抗凋亡基因Bcl-2表达上调。研究显示,在卵巢癌中CXCR2通过抑制p53的磷酸化激活Bcl-XL及Bcl-2,从而抑制卵巢癌细胞的凋亡[22]。本研究发现CXCR2过表达是通过增强Akt磷酸化进而激活Bcl-2高表达从而抑制凋亡。这可能与不同肿瘤、不同细胞系有关。
本研究发现,上调CXCR2表达增强胃癌细胞的侵袭、转移和抗凋亡能力。胃癌细胞中CXCR2的抗凋亡能力与CXCR2/Akt/Bcl-2通路相关。

