液相质谱联用法同时测定复方甘草片中甘草酸和吗啡
李冬云,韦梦秋
(1. 玉林市食品药品检验检测中心,广西 玉林 537000;2. 右江民族医学院,广西 百色 533000)
复方甘草片是临床上常用的祛痰镇咳复方制剂,由甘草浸膏粉、阿片粉或罂粟果提取物粉、樟脑、八角茴香油与苯甲酸钠制成[1-3]。复方甘草片作为基本药物,收录于《中国药典》2020年版二部,方法中分别对吗啡和甘草酸进行含量测定,均使用液相色谱仪,因基质复杂的缘故,吗啡的含量测定方法中需用固相萃取法(SPE)进行前处理,洗脱过程复杂耗时,可能导致洗脱不完全;甘草酸含量测定方法操作较简便,但常出现甘草酸峰与其他成分峰难以分离的情况[4-5]。本文建立了液相质谱联用法同时测定复方甘草片中吗啡和甘草酸的含量,此法前处理简便,准确,快速,能有效用于该药品的质量控制。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器 液相质谱联用仪(型号:Xevo-TQSmicro,美国沃特世公司),十万分之一电子分析天平(型号:XS-205DU,上海梅特勒-托利多仪器有限公司),数控超声波清洗器(型号:KQ-250DB,昆山市超声仪器有限公司)。
1.1.2 试剂 复方甘草片(桂林南药股份有限公司,批号CG190714;国药集团工业有限公司,批号:20190724,20191220);甘草酸铵对照品(批号:RJ171229-15,Stanford Chemicals公司);吗啡对照品(批号:171201-200822,中国食品药品检定研究院);甲醇、乙腈(色谱纯,德国默克公司);超纯水由Millipore超纯水仪制备。
1.2 实验方法
1.2.1 色谱条件 Agilent Zorbax Hilic Plus C18色谱柱(2.1 mm×100 mm,1.8 μm);流动相:乙腈-15 mmol/L乙酸铵(50:50,v/v),流速0.25 ml/min,柱温40 ℃,进样量 5 μl。
1.2.2 质谱条件 ESI+,毛细管电压4.0 kV,雾化器压力35 psi,干燥器温度300 ℃,干燥器流速12 L/min,化合物质谱详细条件见表1。
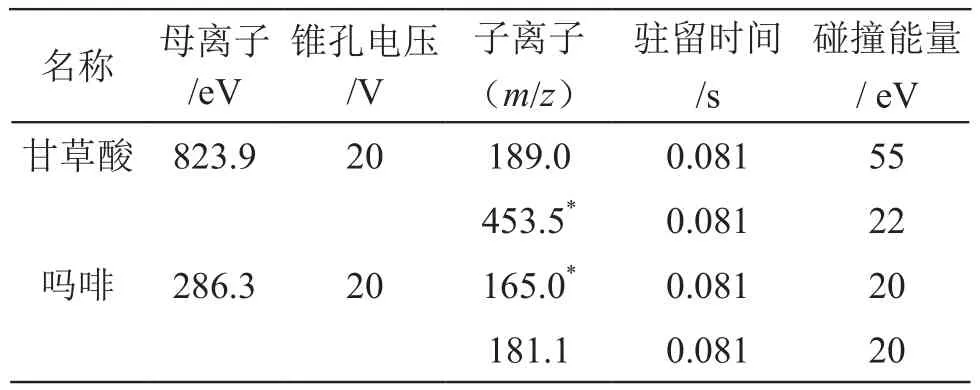
表1 目标化合物质谱参数
1.2.3 溶液的配制
1.2.3.1 对照品溶液的制备 精密称取甘草酸对照品48.75 mg、吗啡对照品11.08 mg分别置入50 ml量瓶,加甲醇,摇匀,作为各自的单标储备溶液,精密量取甘草酸储备液5 ml、吗啡储备液1.25 ml置入同一25 ml量瓶,用甲醇定容至刻度,摇匀,即得每1 ml含有甘草酸191 μg、吗啡11.08 μg/ml的混合对照品溶液。
1.2.3.2 供试品溶液的制备 取批次为CG190714的复方甘草片20片,称重,研细,称取相当于1片的量置于100 ml量瓶,加甲醇-水(1:1)适量,超声提取处理(300 W,250 kHz)20 min,取出冷却,用甲醇-水(1:1)定容至刻度,摇匀,过滤,精密量取1 ml置于20 ml量瓶,用甲醇-水(1:1)稀释至刻度,摇匀后用0.22 μm微孔滤膜过滤,滤液作为供试品溶液。
1.2.3.3 阴性样品溶液制备 取不含甘草酸和吗啡的阴性样品,同法制备阴性样品溶液,无干扰。
2 结果与分析
2.1 方法学考察
2.1.1 专属性试验 取混合对照品溶液、阴性样品溶液进样分析,对照品溶液中的吗啡与甘草酸MRM图谱及阴性样品的MRM图谱见图1。

图1 吗啡与甘草酸MRM图谱
2.1.2 线性与范围 吸取“1.2.3.1”项中的混合对照品溶液0.10,0.20,0.40,0.80,1.00 ml置入10 ml量瓶,然后加甲醇稀释至刻度,经0.22 μm滤膜过滤,依照“1.2”项下的色谱和质谱条件进样5 μl,以咖啡与甘草酸的响应值Y为纵坐标,以含量(X,μg/ml)为横坐标,得回归方程如下

表2 线性方程、相关系数、线性范围
2.1.3 精密度试验 精密吸取线性中混合对照品溶液的第3个浓度点,重复进样6次,分别测得甘草酸峰响应值为 58 443,57 652,57 886,58 412,58 069,58 613,RSD为0.64 %;吗啡响应值为9424,9376,9298,9412,9408,9351,RSD为0.51 %,表明仪器精密度良好。
2.1.4 稳定性试验 精密称取供试品(批号:CG190714),按“1.2.3.2”项方法制备1份供试品溶液,按照选定的色谱、质谱条件分别在供试品溶液制备后0、4,8,12,16,20和24 h进样5 μl,测得甘草酸响应值为:48 052,47 599,47 682,47 623,47 084,47 312,47 146,RSD为0.72 %;测得吗啡响应值为:4562,4531,4539,4567,4550,4512,4518,RSD为0.46 %,结果表明,试验溶液在24 h内稳定。
2.1.5 重复性试验 精密称取供试品(批号:CG190714)的样品6份,按“1.2.3.2”项方法制备6份供试品溶液,按照选定的色谱、质谱条件测得甘草酸含量为10.757,10.756,10.593,10.601,10.787,10,848 mg/片,RSD为0.97 %;吗啡含量为0.363,0.370,0.374,0.364,0.368,0.360 mg/片,RSD为1.4 %,表明分析方法重复性良好。
2.1.6 加样回收试验 精密称取供试品(批号:CG190714)的样品6份,精密加入甘草酸单标储备液4 ml、吗啡单标储备液1 ml,按照“1.2.3.2”项方法制备6份供试品溶液,按照选定的色谱、质谱条件测定,甘草酸回收率为:95.9 %,98.0 %,97.7 %,93.5 %,95.6 %,98.1 %,平均值为96.5 %,RSD为1.86 %;吗啡回收率为:105.6 %,106.5 %,104.7 %,107.4 %,103.8 %,102.0 %,平均值为105.0 %,RSD为1.90 %。
2.2 样品含量测定
分别取不同厂家、批次复方甘草片20片,按照1.2.3项下的方法制备,按照选定的条件进样,样品含量见表3。
3 讨论
3.1 2020年版《中国药典》利用吗啡的酸碱两性,先加入稀盐酸使其成酸性,然后再利用氨水碱化,使吗啡能在固相萃取小柱保留,最后利用酸化的甲醇洗脱收集,操作步骤复杂。本方法用甲醇直接超声提取,无转移过程,简化了前处理步骤也降低了处理成本。
3.2 通过对吗啡对照品前体离子扫描得到吗啡加合离子[M+H+][6-7],m/z 286.3,在不同碰撞能量下均产生m/z 165.0和m/z 181.1。经过工作站MS条件优化处理,在碰撞能量20 V时,两个子离子的离子相对丰度最高,且m/z 165.0高于m/z 181.1,故确定m/z 286.3/165.0为定量离子对,m/z 286.3/181.1为定性离子对。同法操作,甘草酸铵对照品在同样扫描处理过程中产生的定量离子对为m/z 823.9/453.5,定性离子对为m/z 823.9/189.0[8-9]。
3.3 由于吗啡在样品中含量低,标准规定为0.36~0.44 mg/片,且紫外检测容易受其他成分干扰,所以样品前处理需要固相萃取,增加了前处理步骤的复杂性和可操作性难度。液相色谱电喷雾三重四级杆质朴灵敏度高、选择性高和多离子检测模式(MRM)定量准确[10-11],因此,利用现有先进设备建立更简便、高效、准确的检测方法对药品生产企业提高质量控制能力和药品检验检测机构提高效率方面意义重大。
4 结论
本文采用液相质谱联用法同时测定复方甘草片中的甘草与吗啡含量,前处理简单,精密度、重现性、稳定性好,结果准确,为复方甘草片及含甘草、吗啡的药物制剂等质量控制提供依据和参考。
——吗啡

