HPLC 法同时测定甘草酸二铵制剂中18 α 和18 β 甘草酸二铵含量*
张轶华,田晓彤,孙 婷,高燕霞,李 挥
(河北省药品医疗器械检验研究院,河北 石家庄 050200)
甘草酸二铵是从甘草中分离、筛选的主要活性成分甘草酸的二铵盐,具有非特异性抗炎、抗过敏、稳定溶酶体膜及免疫调节作用,其抗病毒作用尤为突出。甘草酸二铵有2 个18 位差向异构体,虽然二者的分子结构仅18 位手性碳原子构型不同,但其在理化性质、药效学、药动学、不良反应等方面均存在差异,且分离测定存在一定困难。现同时测定2 个差向异构体的方法有薄层色谱(TLC)法和气相色谱(GC)法,其中 TLC 法灵敏度太低,而GC 法需要复杂的衍生化。现行标准中未对差向异构体进行分析[1],虽有高效液相色谱(HPLC)法测定甘草酸差向异构体的报道,但这些方法[2-5]耐用性较差。本研究中建立了同时测定甘草酸二铵制剂中18 α甘草酸二铵和18 β 甘草酸二铵含量的HPLC 法,为深入研究这2 个差向异构体的区别提供了定性、定量依据。现报道如下。
1 仪器与试药
1.1 仪器
Ultimate 3000 型高效液相色谱仪,包括四元低压梯度泵、全自动进样器、柱温箱和紫外检测器(美国Dionex 公司);XPR26 /A 型电子天平(瑞士 Mettler Toledo 公司)。
1.2 试药
18 α 甘草酸二铵对照品(a 厂,批号为 120703,含量为 99.0% );18 β 甘草酸 二铵对照品 (a 厂,批 号为130106,含量为 99.5%);甘草酸二铵胶囊(a 厂,批号分别为 100411,100412,100413);注射用甘草酸二铵(b 厂、批号为 100131,c 厂、批号分别为 091103,100603,d 厂、批号为 110501,e 厂、批号分别为 1008213 -2,0909215 - 2,0810203 -1);甘草酸二铵注射液(a 厂、批号分别为1003271,1004031,1004241,f 厂、批号为10060715,g 厂、批号分别为 0908021,1006131,h 厂、批号为 120111,i 厂、批号为 310060801,j 厂、批号分别为 08120601,10091801,10091802,k 厂 、批 号 为089131101,l 厂、批号为 090301);甲醇为色谱纯,其余试剂均为分析纯,水为双蒸水。
2 方法
2.1 色谱条件
色谱柱:Diamonsil C18柱(200 mm ×4.6 mm,5 μm);流动相:水 -60% 高氯酸溶液(48 ∶0.5,V / V,用氨水调pH 至 8.0) - 甲醇(48 ∶52,V / V);流速:1.0 mL /min;检测波长:248 nm;柱温:25 ℃;进样量:20 μL。
2.2 溶液制备
称取18 α 甘草酸二铵和18 β 甘草酸二铵对照品各25 mg,精密称定,置同一25 mL 容量瓶中,加甲醇-水(50 ∶50,V / V)溶解并定容,摇匀,即得混合对照品溶液。取胶囊剂型样品10 粒,另2 种剂型样品各5 瓶,内容物混匀,精密称取(量取)约相当于甘草酸二铵25 mg,置50 mL容量瓶中,用甲醇 - 水(50 ∶50,V / V)溶解并定容,摇匀,即得供试品溶液。取3 种剂型样品的辅料,以甲醇-水(50 ∶50,V / V)溶解制成阴性对照品溶液。
2.3 方法学考察
系统适用性试验:精密吸取2.2 项下混合对照品溶液、供试品溶液、阴性对照品溶液各适量,按2.1 项下色谱条件进样测定,记录色谱图。结果供试品溶液色谱中,在与对照品溶液色谱相应位置有吸收峰,阴性对照无干扰。理论板数以18α 甘草酸二铵、18β 甘草酸二铵峰计均大于1 500。分离度均大于1.5,基线分离良好。详见图1。
线性关系与检测限考察:用流动相稀释混合对照品溶液,制成质量浓度分别为 1.0,0.5,0.3,0.1,0.05,0.01,0.005 mg /mL 的系列混合对照品溶液,按 2.1 项下色谱条件各进样 20 μL,记录色谱图。分别以 18 α 甘草酸二铵和18 β 甘草酸二铵峰面积(Y)为纵坐标、进样质量浓度(X,mg/mL)为横坐标进行线性回归,得回归方程 Y1= 37.826 X1+ 0.737(r = 0.999 7,n = 7),Y2=49.436X2+0.248(r =0.999 3,n =7)。结果表明,18α甘草酸二铵和18 β 甘草酸二铵的质量浓度均在0.005 ~1.0 mg/mL 范围内与峰面积线性关系良好。以信噪比(S / N)= 3 计算 18 α 甘草酸二铵和 18 β 甘草酸二铵的检测限,结果分别为 0.056 mg /mL 和 0.082 mg /mL。

图1 高效液相色谱图1.18 α - glycyrrhizic acid 2.18 β - glycyrrhizic acidA.Mixed reference solution B - D.Test solution(the batch numbers are 100411,100131,1003271)E.Negative reference solutionFig.1 HPLC chromatograms
精密度试验:分别取混合对照品溶液,按2.1 项下色谱条件连续进样6 次,测定峰面积。结果18 α 甘草酸二铵和18 β 甘草酸二铵峰面积的 RSD 分别为0.42%和 0.60%(n =6),表明仪器精密度良好。
稳定性试验:取不同剂型样品(批号分别为100411,0909215 -2,10091801),分别按 2.2 项下方法制备供试品溶液,分别于室温放置 0,4,8,12,24 h 时按2.1 项下色谱条件进样测定,记录峰面积。结果3 批样品 中 的 RSD 分 别 为 0.56% 和 0.63% ,0.49% 和0.59%,0.62%和 0.69%(n =5),表明供试品溶液室温下放置24 h 内基本稳定。
重复性试验:取不同剂型(批号分别为100411,0909215 - 2,10091801)适量,分别按 2.2 项下方法制备供试品溶液,平行6 份,按2.1 项下色谱条件进样测定。结果 3 批样品中,18 α 甘草酸二铵和 18 β 甘草酸二铵含量平均值分别为 67.33% 和 33.72% ,66.32% 和32.98% ,67.25% 和 32.25% ,RSD 分别为 0.26% 和0.43% ,0.25% 和 0.48% ,0.61% 和 0.38% (n = 6),表明方法重复性良好。
加样回收试验:分别取已知18α 甘草酸二铵和18β甘草酸二铵含量的不同剂型样品(批号分别为100411,100131,1003271)各 9 份,分别加入低、中、高质量浓度的混合对照品溶液,按2.2 项下方法制备供试品溶液,并按2.1 项下色谱条件进样测定,计算2 种甘草酸异构体含量,并计算加样回收率。结果见表1 至表3。
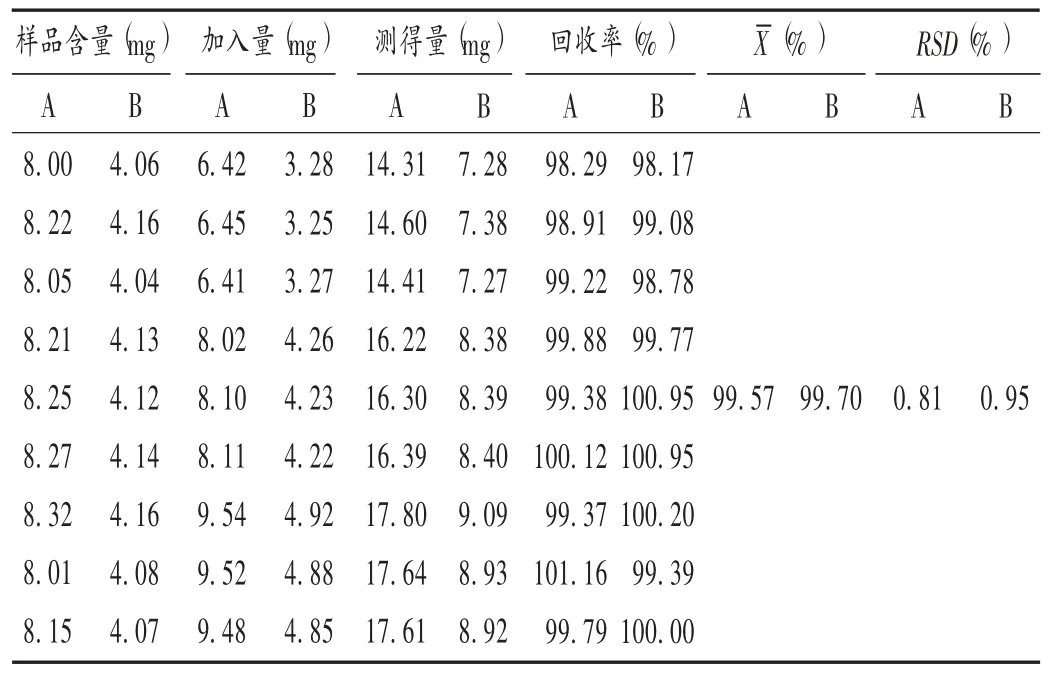
表1 甘草酸二铵胶囊加样回收试验结果(n =9)Tab.1 Results of the recovery test of Diammonium Glycyrrhizinate Capsules(n = 9)
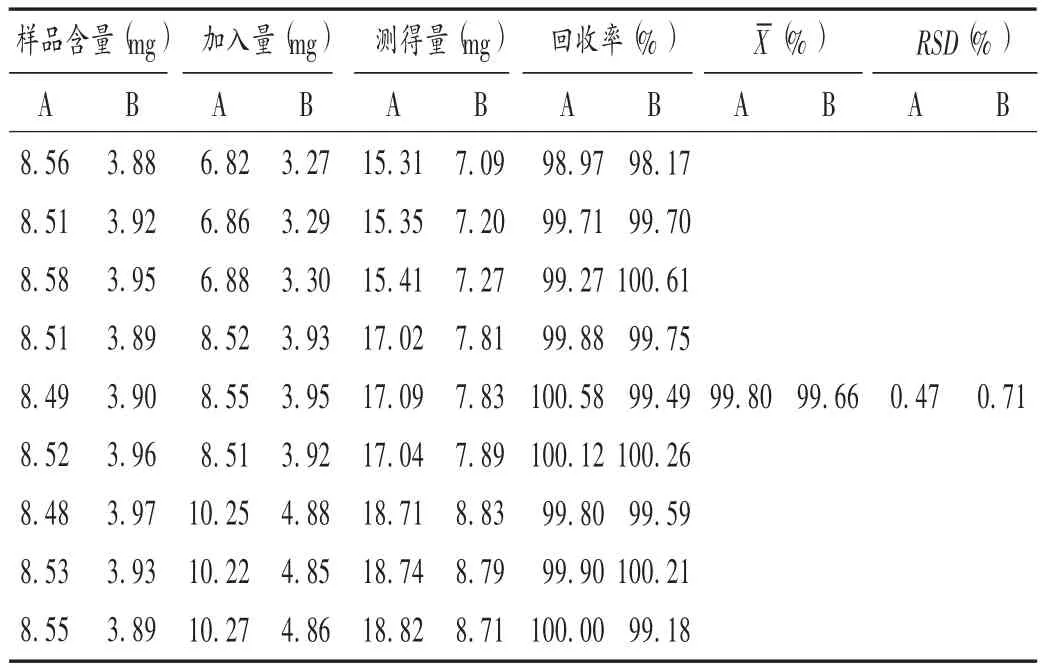
表2 注射用甘草酸二铵加样回收试验结果(n =9)Tab.2 Results of the recovery test of Diammonium Glycyrrhizinate for Injection(n = 9)
2.4 样品含量测定
结果见表4。

表3 甘草酸二铵注射液加样回收试验结果(n =9)Tab.3 Results of the recovery test of Diammonium Glycyrrhizinate Injection(n = 9)
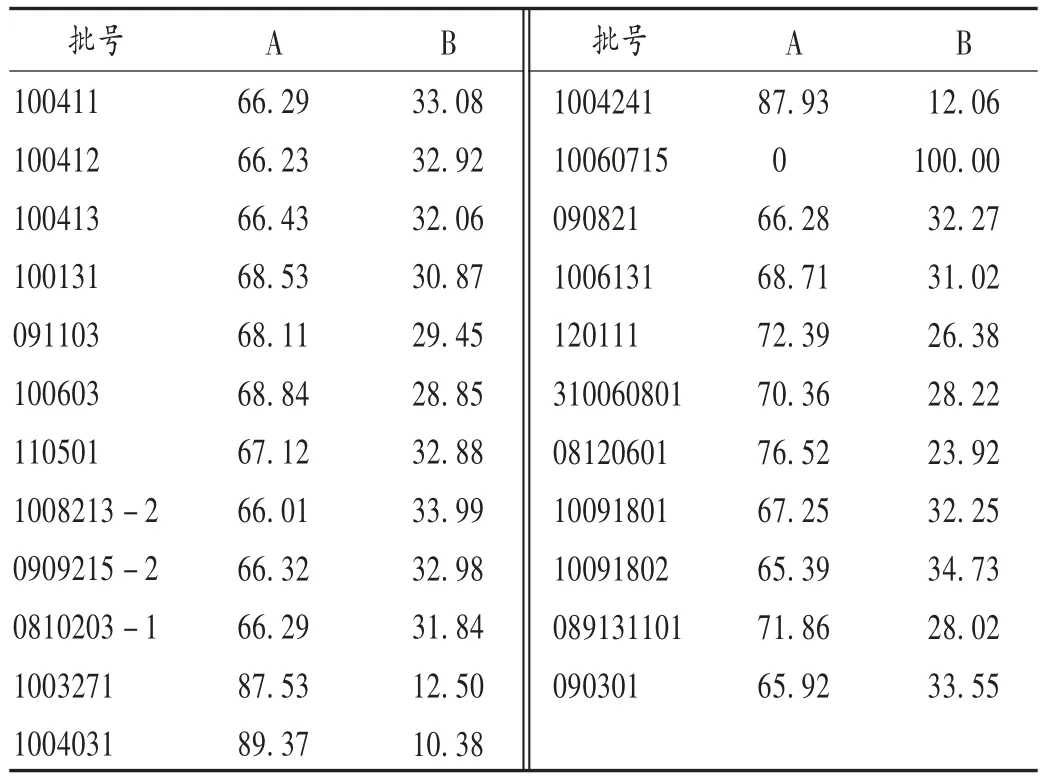
表4 样品含量测定结果(%)Tab.4 Content determination of 18 α - glycyrrhizic acid and 18 β -glycyrrhizic acid in the samples(%)
3 讨论
3.1 流动相选择
预试验中,流动相考察了1%冰醋酸-甲醇,3%冰醋酸-甲醇-四氢呋喃,3%冰醋酸-乙腈-四氢呋喃和3%冰醋酸-乙腈-四氢呋喃(用氨水调pH 至8.0),结果18 α 甘草酸二铵和18 β 甘草酸二铵均不能达到完全分离。在流动相为水-60%高氯酸溶液(48 ∶0.5,V / V,用氨水调 pH 至 8.0) - 甲醇(48 ∶52,V / V)时,18 α 甘草酸二铵和 18 β 甘草酸二铵完全分离,检测出的杂质峰最多,且杂质分离效果最好。
3.2 18 α 甘草酸二铵和 18 β 甘草酸的组成比例
除f 企业注射液剂型中仅有18 β 甘草酸二铵外,其余厂家不同剂型样品均为18 α 甘草酸二铵和18 β 甘草酸二铵共存,比例为 2 ∶1 ~ 7 ∶1 不等。甘草酸二铵提取自中药甘草,2 种18 位差向异构体的比例不易控制,且由于现行标准中未对差向异构体的比例进行要求,故各厂家制剂中二者的组成也不尽相同。已有文献报道,不同比例的18 α 甘草酸二铵和18 β 甘草酸二铵制剂药理作用也不同[6-10],因此亟须制订可行的方法控制其含量。

