初诊2型糖尿病患者中肝脏胰岛素清除率与临床特点及胃肠激素相关性的初步分析
张冬雪 文 祯 孙玉燕 姜 涛
(首都医科大学附属北京世纪坛医院内分泌科, 北京 100038)
近年来研究[1]显示,胰岛素抵抗患者中出现高胰岛素血症的原因中,除胰腺代偿性分泌胰岛素增加以外,胰岛素清除率下降(insulin clearance,IC)是另一个重要的发病机制。而人体内绝大部分胰岛素的清除过程是在肝脏中完成的,因此肝脏胰岛素清除率(hepatic insulin clearance,HIC)在调控高胰岛素血症中发挥举足轻重的作用。HIC参与患者胰岛素抵抗及胰岛功能损伤等糖尿病的重要病理生理机制,且是预测2型糖尿病的重要的独立危险因素[2],甚至HIC的下降可能加速胰岛细胞衰竭,是糖尿病发病的始动环节[3]。此外,胰岛素清除率在不同种族的糖尿病患者[4]及不同血糖状态之间存在较大的异质性[5-6],故我国初诊的2型糖尿病(type 2 diabetes mellitus,T2DM)患者中HIC的变化情况,及其是否与胰岛素抵抗、胰岛功能存在相关性、参与糖代谢,仍需探讨。
此外,研究[7]显示,静脉注射葡萄糖后HIC改变并不明显,但口服葡萄糖后患者HIC显著下降[8],HIC的改变似乎与胃肠激素引起的“肠促胰素效应”存在异曲同工之处。且与HIC类似,胃肠激素在T2DM患者中亦与其胰岛素抵抗及胰岛功能密切相关。同时,脂肪肝是诱发HIC下降的重要原因[9],肠抑胃肽(gastric inhibitory polypeptide,GIP)及胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)均参与肝脏脂肪代谢,因此笔者推测胃肠激素有可能参与HIC的改变。目前,少量研究[5,10]已经开始逐步关注GIP及GLP-1与HIC的相关性,但其研究结果有仍有一定的争议。此外,饥饿素(ghrelin)是近年来发现在2型糖尿病中举足轻重的另一种胃肠激素,且被证实参与肝脏脂代谢、炎性反应等非酒精性脂肪肝病的多个环节[11]。但目前仍未有关于ghrelin与2型糖尿病患者的HIC相关性的报道发表。因此,ghrelin、GIP及GLP-1与HIC是否存在相关性,在汉族2型糖尿病患者中亦是十分值得探讨的问题。
故本研究拟纳入初诊2型糖尿病患者,分析肝脏胰岛素清除率与其胰岛素抵抗及胰岛功能的相关性,同时探索胃肠激素ghrelin、GIP及GLP-1是否与HIC存在相关性,为我国T2DM患者防治工作提供新的理论依据。
1 对象与方法
1.1 研究对象
纳入首都医科大学附属北京世纪坛医院内分泌科初次诊断且未经药物治疗的2型糖尿病患者112例,平均年龄(46.21±1.53)岁,其中女性患者31人,占所有患者的27.70%。纳入标准:①明确诊断为2型糖尿病,符合《中国2型糖尿病防治指南(2020版)》[12]的诊断标准;②年龄≥18岁,性别不限;③未开始使用降糖药物及胰岛素治疗;④自愿参加本研究并签署知情同意书。排除标准:①合并酮症或高血糖高渗综合征;② 肝、肾功能不全;③哺乳或妊娠状态;④合并恶性肿瘤;⑤酗酒或精神类药物使用史;⑥感染状态;⑦合并甲状腺功能异常等内分泌功能异常疾病。HIC计算方法[2,5]:HIC=AUCIns/AUCC-P,其中AUCINS为OGTT试验过程中0~120 min胰岛素(insulin, Ins, pmol/L)浓度的曲线下面积(area under the curve, AUC),AUCC-P表示同期C肽(C-peptide, C-P, nmol/L)的曲线下面积。本研究中把肝脏胰岛素清除率中位数6.63作为切点,将患者分为低HIC组(n=56)及高HIC组(n=56)。低HIC组的HIC值为5.01±0.15,高HIC组的平均值为24.40±14.51,两组间差值的平均值为19.40±14.51。本研究方案经过首都医科大学附属北京世纪坛医院伦理委员会审批(批号:2017年科研伦审第13号),且受试者已经签署知情同意书。
1.2 临床指标收集
收集患者性别、年龄等一般资料。患者隔夜禁食10~12 h后,进行口服葡萄糖耐量(oral glucose tolerance test, OGTT)、胰岛素释放试验及C肽释放试验:分别于0 min(试验前),口服75g葡萄糖后30、60 及120 min分别采血。收集患者OGTT试验过程中血糖(glucose, Glu)、胰岛素及C肽检测结果。同时收集空腹三酰甘油(triglyceride, TG)、总胆固醇(total cholesterol, TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)、门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、谷氨酰胺转肽酶(γ glutamyl transpeptidase, GGT)、尿酸(uric acid, UA)及糖化血红蛋白(haemoglobin A1c, HbA1c)等代谢指标,上述检测均在首都医科大学附属北京世纪坛医院检验科完成。
1.3 胰岛素抵抗及胰岛功能指标计算
胰岛素抵抗指标评估:①稳态模型胰岛素抵抗指数(homeostasis model assessment-IR, HOMA-IR);②Matsuda指数(Matsuda index)。
胰岛功能评估指标:①稳态模型胰岛β细胞功能指数(homeostasis model assessment-β,HOMA-β);②β细胞早期分泌功能用以下指标评估,胰岛素生成指数(insulinogenic index,IGI),其中AUCIns/AUCGlu用于评估β细胞分泌胰岛素的总体水平。
1.4 胃肠激素检测
患者OGTT试验期间,分别于0、30、60及120 min采血。收集患者血标本3 mL,离心15 min (3 000 g), 留取血清,冻存于-80 ℃待检测。取25 μL血浆,根据说明书操作步骤,使用Millipore免疫试剂盒(Millipore Corp, 美国),在Luminex多重检测系统(Luminex 公司, 美国)中检测患者血浆中Ghrelin、GLP-1及GIP浓度。
1.5 统计学方法
2 结果
2.1 不同HIC组患者一般情况及代谢指标的比较
高HIC组及低HIC组患者在年龄、性别、BMI及腰围方面比较,差异无统计学意义(P>0.05)。在血糖控制方面,两组患者糖化血红蛋白及空腹血糖比较,差异无统计学意义(P>0.05,表1),75 g葡萄糖负荷后不同时间点血糖差异有统计学意义(P<0.001),但高HIC组患者负荷后30 min(P=0.026)及120 min(P=0.013)的血糖浓度明显高于低HIC组(图1A)。高HIC组患者OGTT曲线下面积亦高于低HIC组患者(1 702.45±54.90vs1 543.40±30.06,P=0.013)。高HIC组患者基础胰岛素(P<0.001)与葡萄负荷后30 min(P<0.001)、60 min(P=0.001)及120 min(P=0.001)胰岛素浓度均明显低于低HIC组(图1B、表2)。同时,不同HIC分组患者随着摄入葡萄糖时间的推移,出现不相同的变化趋势(P=0.016),且胰岛素曲线下面积均明显高于低HIC组(2 228.7±251.1vs4 452.4±492.1,P<0.01),但两组之间C肽曲线下面积差异无统计学意义(表2)。进一步分析发现,高HIC组患者中血脂(TG、TC、LDL-C、HDL-C)、尿酸及肝功能(ALT、AST及GGT)在两组患者中差异无统计学意义(P>0.05,表1)。

表1 不同肝脏胰岛素清除率患者的一般情况及代谢指标比较 Tab.1 Demographic and metabolic characteristics in patients with different hepatic insulin

图1 口服糖耐量试验中不同肝脏胰岛素清除率组患者葡萄糖及胰岛素释放曲线比较Fig.1 Glucose and insulin curve during an oral glucose tolerance test in patients with different hepatic insulin clearanceA: glucose curve in patients with different HIC. *P<0.05 vs low HIC; B: insulin curve in patients with different HIC. #P<0.05 vs high HIC; HIC: hepatic insulin clearance.
表2 不同肝脏胰岛素清除率患者的胰岛素敏感性及胰岛功能比较
2.2 HIC与患者胰岛素抵抗及胰岛功能的相关性
在胰岛素抵抗方面,低HIC组患者的HOMA-IR明显高于高HIC组(P=0.011),Matsuda指数在低清除率组中也明显降低(P=0.038),低HIC组患者的胰岛素抵抗程度相对严重。但在胰岛β细胞功能方面,高HIC组患者的空腹胰岛素及HOMA-β浓度均明显降低(P<0.001)。此外,虽然两组患者早期胰岛素分泌指标IGI间差异无统计学意义,但AUC-Ins/AUC-Glu在高HIC组明显下降(P<0.001,表2)。
2.3 HIC与患者胃肠激素的相关性
高HIC组患者的空腹血ghrelin浓度明显低于低HIC组(P=0.044, 图2A),且葡萄糖负荷后高HIC组患者中葡萄糖对的ghrelin的抑制作用减弱,即120 min 时高HIC组患者血清ghrelin较基线值下降的更少 (P=0.027, 图2B)。空腹GIP及GLP-1在两组不同肝脏胰岛素清除率的患者中差异无统计学意义。同时,GIP及GLP-1(P>0.05)在两组患者服用75 g葡萄糖后30、60、120 min及曲线下面积差异亦无统计学意义(P>0.05)。
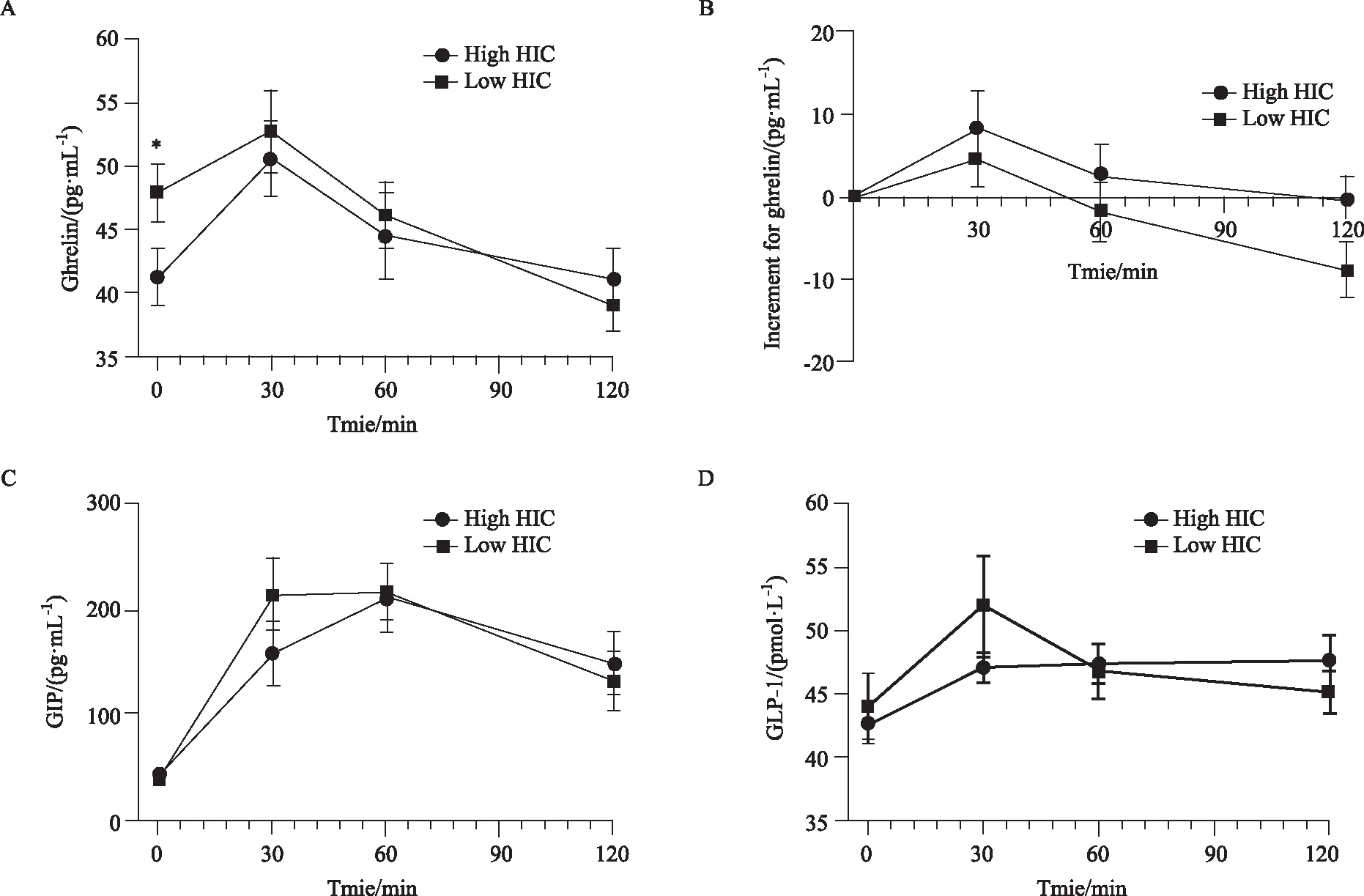
图2 不同肝脏胰岛素清除率患者胃肠激素比较Fig.2 Gut hormone in patients with different hepatic insulin clearanceA: ghrelin secretion curve in patients with different HIC,*P<0.05 vs high HIC; B: increment for ghrelin after glucose loading in patients with different HIC; C: GIP secretion curve in patients with different HIC; D: GLP-1 secretion curve in patients with different HIC; HIC: hepatic insulin clearance; GIP: gastric inhibitory polypeptide; GLP-1: glucagon-like peptide-1.
3 讨论
本研究收集初诊未治的汉族2型糖尿病患者的临床资料,行OGTT试验,同期检测75 g葡萄糖负荷前后的胰岛素分泌及胃肠激素浓度,发现肝脏胰岛素清除率影响患者胰岛素浓度,与患者胰岛功能及胰岛素抵抗相关,且较高的肝脏胰岛素清除率与空腹低ghrelin相关,同时葡萄糖对ghrelin的抑制作用几乎消失,但GIP及GLP-1与肝脏胰岛素清除率无关。
本研究中,高HIC组患者葡萄糖负荷后血糖浓度较高。研究[6]显示,患者HIC状态与血糖浓度存在一定的相关性。早在糖耐量正常的肥胖患者及代谢综合征患者中就已经出现胰岛素清除率明显下降的情况[2],而清除率下降诱发的代偿性高胰岛素血症,在这部分患者维持正常的糖耐量状态中发挥了重要的作用[6]。患者出现糖耐量异常后,HIC仍然代偿性下降;但患者达到T2DM诊断标准后,虽然其HIC较正常人代偿性降低,但其降低程度远低于糖耐量异常患者,提示T2DM患者中HIC下降的代偿机制可能受到损伤,造成血糖进一步升高。且随着糖尿病进展,HIC亦出现较大的异质性:与本研究类似在血糖较高的T2DM患者中HIC相对升高,可能失去了HIC的代偿机制[12]。HIC与胰岛功能存在一定的相关性,本研究中较高的HIC对应较低的HOMA-β及AUCIns/AUCGlu,即相对较差的胰岛功能。与本研究相同,Okura等[5]发现血糖控制欠佳的T2DM患者中HIC与HOMA-β呈负相关,糖耐量正常的代谢综合征患者的研究[2]中HIC与胰岛素浓度也呈负相关。同时,本研究中,HIC较低的患者中胰岛素抵抗相对严重。此外,研究[13]显示,ALT与肝脏胰岛素清除率呈负相关,同时与肝脏胰岛素抵抗呈正相关。本研究中虽然两组患者ALT差异无统计学意义(可能受样本量局限影响),但低HIC组患者的ALT浓度相对较高,胰岛素抵抗较重。HIC较低的糖尿病患者,可通过降低HIC代偿胰岛素抵抗,提高胰岛素浓度,甚至形成高胰岛素血症,以利于血糖的控制;但慢性高胰岛素血症会进一步加剧肝脏脂肪堆积,下降的HIC亦会造成肝脏脂肪变性,肝脏脂肪堆积、变性可进一步降低HIC,最终较低的HIC可能成为连接高胰岛素血症与肝脏脂肪变性的重要纽带[14],本研究中未测定肝脏脂肪含量,略有不足。综上,HIC相对较高的患者中,HIC似乎失去了其代偿功能,引起胰岛素浓度下降,虽然胰岛素抵抗减轻,但对应较差的胰岛功能,可能是其血糖升高的重要原因。
研究[8]显示,口服葡萄糖可降低糖尿病患者的肝脏胰岛素清除率,但静脉注射葡萄糖并不影响HIC浓度[7],因此笔者推测胃肠激素可能参与其中。但是,本研究中高HIC组与低HIC组初诊汉族T2DM患者的空腹及葡萄糖负荷后GLP-1、GIP浓度差异无统计学意义。与本研究结果相似,一项T2DM患者研究[5]中,采用本文中的方法及葡萄糖钳夹同时评估患者肝脏胰岛素清除率,采用馒头餐代替葡萄糖,亦未发现HIC与GIP、GLP-1的相关性,且在另一项糖尿病患者的研究[8]中也未发现口服葡萄糖后HIC的下降与GLP-1、GIP有相关性。但与本研究不同的是,在10例血糖控制较好的T2DM患者的研究[10]中,虽然发现HIC与GLP-1呈正相关,与GIP呈负相关,但上述研究中患者服用的是异麦芽酮糖,与本研究中使用的葡萄糖的吸收、代谢过程存在差异,异麦芽酮糖诱发较轻的负荷后高血糖及较轻的高胰岛素血症,而这种差异可能来源于胃肠激素的参与。综上,目前仍没有充分的证据支持T2DM患者GLP-1及GIP与HIC之间存在相关性。
饥饿素是主要由胃黏膜细胞(少量ghrelin由小肠内分泌细胞及胰岛ε细胞)分泌的短肽,可与生长激素受体结合,促进生长激素释放,且可直接开放β细胞上延迟开放钾通道,调控胰岛素释放:空腹状态ghrelin浓度较高,抑制胰岛素释放,预防低血糖;餐后状态下ghrelin快速下降,解除对β细胞的抑制作用,促进胰岛素释放,进而发挥降低餐后血糖的作用[15]。本研究中,低HIC组患者的空腹ghrelin浓度较高。研究[16]显示,增加大鼠肠道中ghrelin的浓度,可造成肝脏细胞胰岛素受体后信号通路活性降低。人体内胰岛素与肝细胞上胰岛素受体相结合,被肝细胞摄取、降解,完成胰岛素在肝脏中的清除过程[17]。此外,ghrelin升高可能造成肝脏脂肪堆积[11],而肝脏的脂肪堆积本身就是造成HIC下降的重要原因[9]。故推测本研究中较高的空腹ghrelin浓度与较低的HIC相关,可能与ghrelin介导的胰岛素信号通路受损及肝脏脂肪堆积有关,但这一假设仍需相关分子实验进一步验证。除此之外,本研究中高HIC组患者口服葡萄糖2 h后对ghrelin的抑制程度较低HIC组明显减弱。多数糖尿病患者与健康受试者类似,葡萄糖负荷后或进餐后患者ghrelin受到抑制,解除对β细胞的抑制作用[15],胰岛素分泌增加,降低负荷后血糖。但在部分肥胖及T2DM患者中餐后ghrelin被抑制的程度受到损伤[18]。且对多囊卵巢综合征患者的研究[19]结果,也与本研究类似,不但空腹ghrelin下降,同时餐后ghrelin被抑制的程度也减弱。同时,ghrelin餐后受抑制的程度亦受种族差异的影响[18]。因此,本研究中高HIC组患者葡萄糖负荷后对ghrelin的抑制作用受损,可能造成其对胰岛素释放的抑制作用较强,影响该组患者胰岛素浓度。与此同时,胰岛素浓度反过来亦会影响ghrelin浓度,即胰岛素与ghrelin之间存在相互作用[20]。故笔者推测,在本研究较高的HIC造成的胰岛素浓度下降,对ghrelin的抑制作用减弱,可能是造成该组患者葡萄糖负荷后ghrelin下降不明显的原因。由此可见,HIC与ghrelin在葡萄糖负荷后可能存在一定程度的相关性。
本研究中存在一定的局限性:虽然葡萄糖钳夹是评估HIC的金标准,但葡萄糖钳夹技术难度较高,招募患者相对困难,故本文中采用文献[2,5]报道的相对简易的方法估计患者HIC,有可能存在一定偏差。此外本研究中只是对不同HIC患者进行胃肠激素的初步探讨,将来需要进一步扩大研究的样本量的深入研究。同时ghrelin是否直接作用于肝脏,调节糖尿病患者的胰岛素清除率,是否影响肝脏脂肪堆积及其胰岛素信号通路,该机制需要深入的试验研究进一步探讨。
综上所述,本研究发现初诊2型糖尿病患者的肝脏胰岛素清除率与胰岛β细胞功能及胰岛素抵抗密切相关,虽然胃肠激素GLP-1及GIP参与其中的证据不足,但空腹ghrelin升高及葡萄糖负荷对ghrelin的抑制作用减弱均与肝脏胰岛素清除率存在一定的相关性,可能患者葡萄糖代谢中发挥潜在的调控作用。

