人工膜肺用于血液回输前一氧化氮负载的研究
赵 静,陈 涛,李三中,侯丽宏,雷 翀
当红细胞膜被破坏时,可释放游离血红蛋白(free hemoglobin,fHb),血浆中过量的fHb可引起血管内皮细胞功能障碍、血小板活化、炎症反应、氧化损伤等不良反应,从而导致微循环障碍、肺动脉高压、甚至肺、肾脏、肠道等器官的损伤[1-2]。其中,因fHb导致的内皮源性一氧化氮(nitric oxide,NO)耗竭是引起血管内皮功能障碍进而导致器官功能受损的重要机制[2-3]。如何降低因fHb的增加而引起的器官损伤是备受关注的临床问题。既往的研究及本团队前期的研究均提示,外源性的补充NO可减少fHb引起的内源性NO消耗,从而减少fHb相关的损伤[4]。临床最为常用的外源性NO的补充方法为吸入NO气体,然而,目前对于NO吸入的临床获益尚存在争议[5],且NO吸入治疗也存在一定弊端,因此,若在血液回输前,能在体外对于含大量fHb的血液进行NO负载后再进行回输,理论上可以在减少fHb相关器官损伤的同时避免直接吸入NO的损害和弊端。
本研究拟通过使用体外膜肺材料对长时间心肺转流(cardiopulmonary bypass,CPB)后回收的残余机血进行NO负载处理,初步建立血液的NO体外负载方法模型,检测体外膜肺材料对血液进行NO负载中的价值,探索使用人工膜肺对血液进行NO负载的有效参数,为后续的研究和临床应用奠定基础。
1 材料与方法
1.1 材料、试剂和仪器收集5例主动脉夹层动脉瘤行全主动脉弓置换术患者CPB结束后回收的、经肝素抗凝的残余机血450 ml/例(总CPB时间大于3 h,回收机血中含有大量fHb)、聚丙烯(polypropylene,PP)材质氧合器5个(广东科威)、医用一氧化氮气体、医用氧气、无菌储血袋、一次性无菌输血器、动脉血气针、真空采血管、fHb检测试剂盒(QuantichromTM Hemoglobin Assay Kit,BioAssay System)、NO治疗仪(SLE3600)、血气分析仪(GEM 4000)、低温高速离心机(中国湘立)、酶标仪(美国biotek)、Sievers NOA 280i NO分析仪(美国GE公司)。
1.2 NO负载装置及负载流程
1.2.1 人工膜肺的准备 使用0.9%的生理盐水预充排气人工膜肺并浸泡10 min,记录预充量。以20 ml/min的流速,使用机血冲洗浸泡过的膜肺,直至人工膜肺入血口和出血口血红蛋白浓度相等,记录冲洗量。每次使用新的参数前均需使用相当于冲洗量的新的机血冲洗人工膜肺,以排除前一次实验的影响。
1.2.2 相关参数的设置 本研究使用同等规格的大鼠膜肺,其膜面积恒定,NO气体浓度恒定,通过设定不同的血液流速达到调整气血比的目的。本研究依据输液泵本身的泵速限制,设置四种血液流速:20 ml/min、15 ml/min、10 ml/min、5 ml/min。为研究膜面积对于负载效果的影响,本研究中使血液多次通过膜肺来扩展膜面积,每个设定流速下,血液均通过3次人工膜肺以完成NO负载。
1.2.3 装置及负载流程(图1) ①将所收残余机血分为四等分,每个流速使用一份;②按照图1连接系统,并设置血液流速,使用血液冲洗人工膜肺后,分别按设定速度和浓度同时开启输液泵和NO气体,血液完全通过人工膜肺后则完成第一次NO负载,然后调换储血袋位置使其中的血液再次以该设定速度通过人工膜肺完成第二次及第三次NO负载,该设定血液流速下的实验完成;③调整血液流速完成其他三个设定流速下的NO负载实验,每次更改流速设定后,均需使用新的机血以最大流速20 ml/min冲洗人工膜肺,待四个流速下的实验均完成,该次实验结束。
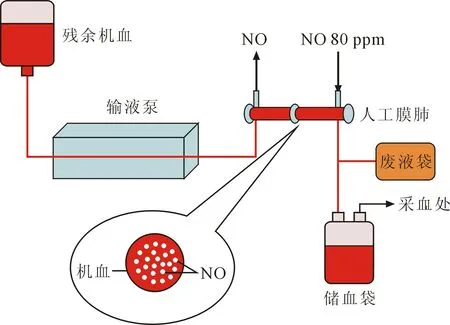
图1 NO装置及负载流程示意图
1.3 血样的采集及fHb、NO消耗检测在每个流速时的基础状态(每次调整血液流速后)及每完成一遍NO负载实验后分别采血4.5 ml用于血气检测及后续的fHb及NO消耗的检测。fHb浓度检测试剂盒按照说明书操作,使用酶标仪读取400 nm波长的吸收度;NO消耗使用Sievers NOA 280i一氧化氮分析仪进行检测,在玻璃反应槽中加入可持续产生稳定流量的NO气体的NONOate,Sievers可将稳定的NO信号转换为稳定的电信号,通过分析加入fHb标准品及含fHb血样品后电信号的变化即可计算出每一份样品的NO消耗。
1.4 统计学分析数据的统计分析采用SPSS 24.0统计软件进行。计量资料采用均数±标准差(mean±SD)表示,多组间比较采用方差分析,对NO负载后NO消耗及高铁血红蛋白(methemoglobin,MetHb)比例的变化趋势使用重复测量方差分析,组间两两比较使用最小显著性差异法(least significant difference,LSD),fHb及K+的变化使用方差分析,P<0.05被认为差异有统计学意义。
2 结 果
2.1 血浆消耗NO能力及MetHb的变化不同血液流速组之间,经负载后不同时点的血浆消耗NO的能力有显著差异(P<0.05)(表1)。对各组NO消耗数据进行重复测量的方差分析,不同组之间进行三次负载后NO消耗的均值之间有显著性差异(F=2.333,P=0.035)(图2A)。从变化趋势分析来看,三次负载之间均存在显著的线性变化趋势(F=582.747,P<0.01)和二次方变化趋势(F=7.236,P=0.02)。不同组间的线性变化趋势之间无显著性差异(F=0.805,0.515),但二次方变化趋势显著不同(F=6.580,P=0.007)。组间两两对比结果显示,NO消耗随时间的变化趋势在20 ml/min组与15 ml/min组间无统计学差异(P=0.692),在5 ml/min组和10 ml/min组间无统计学差异(P=0.056),而在20 ml/min组与5 ml/min(P<0.001)和10 ml/min(P=0.009)组之间有显著性差异。对于三次负载后,不同组之间NO消耗变化的差值之间无统计学差异(图2B)。
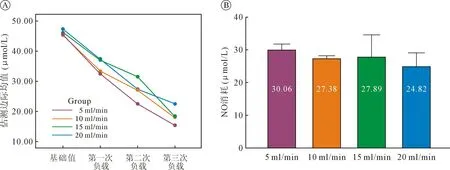
图2 NO负载后血中NO消耗的变化
表1 不同血液流速下血浆NO消耗的比较(μmol/L,±s)
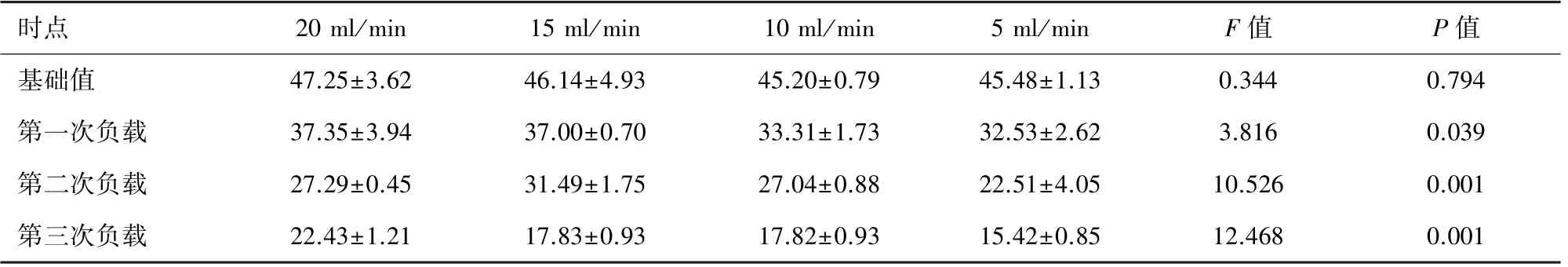
表1 不同血液流速下血浆NO消耗的比较(μmol/L,±s)
时点 20 ml/min 15 ml/min 10 ml/min 5 ml/min F值 P值基础值 47.25±3.62 46.14±4.93 45.20±0.79 45.48±1.13 0.344 0.794第一次负载 37.35±3.94 37.00±0.70 33.31±1.73 32.53±2.62 3.816 0.039第二次负载 27.29±0.45 31.49±1.75 27.04±0.88 22.51±4.05 10.526 0.001第三次负载 22.43±1.21 17.83±0.93 17.82±0.93 15.42±0.85 12.468 0.001
对组间各时点的MetHb比值进行方差分析,结果显示组间有统计学差异(图3A)。而经重复测量方差分析后所得结果与NO消耗结果类似,不同组之间进行三次负载时MetHb比例的均值之间有显著性差异(F=386.09,P<0.001)。从变化趋势分析来看,三次负载之间均存在显著的线性变化趋势(F=987.429,P<0.001)和二次方变化趋势(F=19.898,P=0.001)。不同组间的线性变化趋势和二次方变化趋势均显著不同(P<0.001)。同样经过三次NO负载后,与基础值相比,以20 ml/min的血流速度进行NO负载后血中MetHb比例升高程度最大(升高了1.637%)。之后依次为15 ml/min(1.188%),5 ml/min(1.181%)和10 ml/min(0.944%)。
2.2 不同血液流速下fHb及K+的变化血中fHb和K+均有轻度增加,但不同组间各时间点的fHb和K+并无显著性差异,且经三次负载后分别与基础值之间相比无统计学差异(图3B、图3C)。
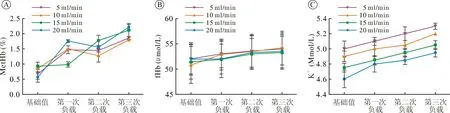
图3 负载过程中血浆MetHb、fHb和K+的变化趋势
3 讨 论
既往的研究显示,血中fHb的升高与患者并发症的发生具有显著相关性,而由fHb引起的血管内皮源性NO的耗竭是fHb相关不良反应的主要发生机制[2-3]。临床诊疗过程中有多种发生红细胞破坏导致fHb释放的场景:库存红细胞输注、自体血回输、CPB、体外膜氧合治疗、血液透析等[6-7]。如何降低因fHb的增加而引起的器官损伤是备受关注的临床问题。有学者尝试通过外源性的补充NO来减少fHb引起的内源性NO消耗,方法包括静脉应用可持续产生NO的药物(如L-精氨酸、硝普钠、鸟苷酸环化酶)或具有靶向释放NO的NO供体,但目前多处于临床前研究阶段[8-9],相比较而言吸入NO气体是相对常用的临床治疗方法。
本团队前期的研究显示,CPB心脏手术时由于红细胞被破坏,血中fHb大幅度升高,升高的比例对于术后发生急性肾损伤有重要的预测作用,而在CPB开始时吸入持续24 h的NO可降低fHb升高导致AKI的发生率[4]。然而,目前对于吸入NO的临床获益尚存在争议,其原因可能在于NO的生理作用广泛(血管紧张度调节、凝血过程、炎症反应和氧化作用)。因此,吸入时机、吸入时长及吸入对象的不同均可能导致不同的临床预后[5]。事实上,进行NO吸入治疗也有其弊端:首先,未接受气管插管患者的NO吸入效率较低;其次,吸入NO需要特殊的设备,并非所有的医疗单位均可满足;第三,由于NO和氧气可快速反应生成有毒性的二氧化氮(nitrogen dioxide,NO2),患者吸入高浓度NO2时可能造成呼吸道损伤;第四,长时间大量吸入NO可导致体内MetHb比例升高,影响氧气输送。因此,如果能在含fHb的血液进入机体之前降低其消耗NO的能力,理论上较全身使用NO供体或吸入NO治疗更具优势。本研究即是基于以上理论基础的初步尝试,结果显示,该负载模型可有效降低血液消耗NO的能力。
本研究中建立的NO负载模型是通过使用PP材质的人工膜肺完成负载的。既往有研究显示,NO可以通过扩散透过PP材质的人工膜肺,并且对于血小板功能具有保护性作用。而且既往的研究也显示,接受CPB的患者在CPB开始时通过PP材质的人工膜肺吸入NO可降低其血浆消耗NO的能力,提示PP材质的膜肺对NO有一定的通透性[4]。这是本研究中选用PP材质的小动物用模式氧合器的根据,该氧合器具有预充量小(约10 ml)、参数已知、制作工艺成熟等优点,在本研究中的应用可减少实验用血液的损耗、并可为开发适用于NO负载处理的气体交换装置的参数设置提供可靠参考。人工膜肺内含并列的PP材质的中空纤维集束,气体小分子可自由通过该中空纤维膜。中空纤维集束与膜肺外壁形成相互隔离的气路和血路,当可溶性或可被血液吸收的气体通过浸泡于血液中的中空纤维膜时,通过弥散作用穿过纤维膜到达血液,血中高浓度的气体小分子也可通过中空纤维膜释放逸出,达到气体交换的目的。使用人工膜肺进行NO负载相较于直接将NO气体通入血液完成负载有以下优势:①避免造成血液的污染;②避免气体直接通入血液产生泡沫;③避免因需要使用消泡剂增加输血的不安全因素;④避免直接通气时因气泡产生的溶血。
理想的负载模型理论上应该具有可快速负载、不增加血液破坏、可进行无菌处理、不需在血液中添加除NO之外的其他物质即可对血液进行按需负载等特点。本研究中使用的人工膜肺的负载效率与该材质对于NO气体的交换效率有关。而交换效率与其材质、气血比及交换膜面积有关。本研究中所用膜肺本身已经过无菌处理,其对血液进行NO负载时仅靠气体的弥散通过膜肺进入血液,而不需在血液中添加其他物质,已经满足以上特点中的两点。本研究拟通过实验来对该负载模型的负载效率和安全性进行检测。在本研究中,膜肺的材质和膜面积固定,选择使用固定的NO气体浓度,仅通过改变血流速度来改变气血比,通过增加血液流过膜肺的次数来扩展膜面积,这种方法不仅可节约用血,提高膜肺及血液的利用率,更为之后更为详细的参数计算带来便利。本研究的结果显示,无论血液以哪种速度通过膜肺,通过次数对NO消耗的下降均有显著影响,负载后NO消耗的变化呈线性或二次方变化趋势,NO消耗随通过次数的增加迅速下降,通过次数代表了膜面积,该结果说明通过扩展膜面积可显著提升该模型的负载效力,或者对于有大量红细胞被破坏的血液,如长时间CPB、体外膜氧合(ECMO)或透析时可以通过增加血液在该模型中的转流次数来对血液中fHb进行NO负载,进而减少fHb引起的器官损伤。
不同的血液流速对于NO负载的效力也有一定影响,现有模型中的四种流速相比,进行三次NO负载后,血中NO消耗在5 ml/min的血流速度下下降最多,而20 ml/min的血流速度下下降最少,但组间并无统计学差异。以上结果提示,现有负载模型中,虽然5 ml/min的速度负载效力更高,但进行三次负载的效果与20 ml/min的速度下进行三次负载的效果并无统计学差异,因此,在负载效果无统计学差异的情况下,使用20 ml/min的血流速度可大大提升NO的负载速度,以更好的应对各种紧急用血的临床情景。从安全性考虑,无论以哪种血流速度进行负载,该负载模型处理后的血液中fHb和K+浓度均有升高,但三次负载后与负载前以上结果并无显著性差异,该结果提示,此负载模型可能增加溶血,但仅进行三次负载时引起的溶血程度很轻,与基础值之间无统计学差异,不同血液流速之间也无统计学差异。从血中MetHb升高的程度来看,不同组间MetHb的上升趋势有所差别。MetHb比例的升高会使氧离曲线左移,从而影响氧的释放,据文献报道,MetHb在高于10%~20%时可能引起紫绀,35%~40%会导致头痛、疲劳、头晕和呼吸困难,高达60%~70%可能导致癫痫发作、心律失常、循环衰竭甚至死亡[10]。在本模型中,血液经NO负载后其中MetHb的比例均增加,不同组间相比,以20 ml/min的血流速度进行三次负载后MetHb比例升高的程度最高,但是,其最高值依然低于3%,远低于前述的临床危急值。以上结果提示,使用该模型对血液进行负载时所引起的MetHb的升高不会引起不良的临床效应,即使在大量输血的情况下亦可满足安全性条件。综合以上结果,在本负载模型中,推荐使用20 ml/min的血流速度对血液进行NO负载,负载速度更快,效率更高,并可满足临床的安全性要求。然而,本研究中所设血流速度受限于所使用微量泵的极限速度,是否更高的血流速度可以更高效的完成负载会在后期改良实验设备后进一步探索。
目前有关NO体外预负载的研究相对较少,但是有关内皮模拟表面的研究近年已然兴起,其主要目的是开发具有可持续释放NO功能的涂层材料或方法,如接触血液的材料[11]、人工血管或血管内支架,此类研究的目的也是通过外源性的补充NO以弥补因各种原因受损的血管内皮功能,而本研究目标是建立NO体外负载模型,在可能损伤血管内皮功能的血液进入机体之前通过预处理以降低其对内皮功能的损害,本模型中所用材料与设备均是已投入临床应用的成熟产品,较新材料的开发更易实现。
综上所述,本研究中所建立的使用PP材质的人工膜肺材料进行血液回输前的NO负载模型可有效用于含大量fHb的红细胞制品的体外NO负载,负载后可显著降低血液消耗NO的能力,但是负载过程可能会导致轻微的红细胞破坏。人工膜肺材料对fHb进行NO负载的效率与气血比和膜面积有关,现有模型中20 ml/min的血流速度优于较低血流速度下的NO负载。

