A型主动脉夹层下肢灌注不良踝臂指数分级与患者预后的关系
钟 亮,梁哲勇,李建鹏,李 静,闫 炀,周和平
急性A型主动脉夹层(acute type A aortic dissection,ATAAD)是心血管外科最凶险的疾病之一,其48 h内死亡率可高达50%。尽管近年来主动脉夹层的诊断水平和外科手术技术不断提高,但其手术近期死亡率仍高达20%[1]。近40%的ATAAD患者合并脏器灌注不良,而下肢灌注不良的发生率达4%~23%。灌注不良综合征严重影响了ATAAD患者的近、中期预后[2]。但是目前关于ATAAD患者下肢灌注不良严重程度量化指标的研究报道甚少。踝臂指数(ankle-brachal intex,ABI)是指踝动脉(胫后动脉或足背动脉)与肱动脉收缩压力之比[3],常用于反映患者下肢的缺血情况和狭窄的严重程度。美国心脏协会和心脏病学会指南建议将ABI<0.9作为诊断外周血管病变的界值标准及预测心脑血管疾病的发生风险[4]。中国人群将ABI<0.9作为低ABI进行分析亦具有较高的灵敏性和特异度[5]。本研究回顾性分析了本院近一年的ATAAD患者,根据术前ABI对下肢缺血程度进行量化分级,并初步探讨ABI对ATAAD患者近期预后的影响。
1 资料与方法
1.1 研究对象与分组选择本院2019年10月至2020年9月确诊并行孙氏手术(全主动脉弓替换、胸降主动脉支架“象鼻”术)治疗的166例ATAAD患者。排除标准:大动脉炎、白塞病患者、既往下肢动脉缺血病史、下肢动脉手术史、糖尿病足、临床资料不全等,最终纳入研究的患者共106例。根据国际上ABI分级,将所有患者分为三组:正常组(A组):0.9≤ABI<1.4;轻中度异常组(B组)0.4≤ABI<0.9;重度异常组(C组)ABI<0.4。研究终点设为院内死亡。
1.2 手术方法所有ATAAD患者均行左上肢肱动脉及下肢足背动脉或胫后动脉的动脉穿刺,监测有创动脉血压。采用腋动脉和右房插管建立体外循环。经冠状静脉窦逆行灌注del Nido停搏液进行心肌保护。对于术前下肢血压低、ABI<0.4的患者,手术开始后即分离股动脉,缝制荷包,在体外循环开始转机后,顺行插入10~14 F动脉插管,与“Y”型动脉灌注管一分支相连,行股动脉分流灌注。根据主动脉窦部夹层累及及主动脉瓣、主动脉根部病变情况决定行升主动脉替换、David或Bentall术。近端处理完毕后待鼻咽温降至28~30℃时停循环,经腋动脉、左颈总动脉行双侧顺行性低流量脑灌注[单泵双管,术中流量8~10 ml/(kg·min)],远端降主动脉植入术中支架,并将四分叉血管远端与术中支架近端吻合,吻合结束后,恢复全身循环。逐次完成头臂血管重建。如果恢复循环后上、下肢压差大于40 mmHg,即行升主动脉-股动脉人工血管转流术。
1.3 观察指标比较各组患者术前一般资料如性别、年龄、基础病因、体质量指数(BMI)等。术中主动脉根部采用的手术方式、人工血管转流术的应用及术中体外循环等指标。术后患者肾功能、肌红蛋白等指标的变化及持续肾替代治疗(continuous renal replacement therapy,CRRT)的使用情况、术后ICU滞留时间、呼吸机辅助时间及围术期死亡等。
1.4 统计学方法应用SPSS 25.0统计软件分析数据。计量资料用均数±标准差(±s)表示,两组组间比较采用t检验;计数资料用百分比表示,组间比较采用χ2检验。P<0.05认为有统计学意义。
2 结 果
2.1 术前一般临床资料三组患者年龄、性别、BMI指数、高血压病史、吸烟病史等均无明显统计学差异(P>0.05)。见表1。
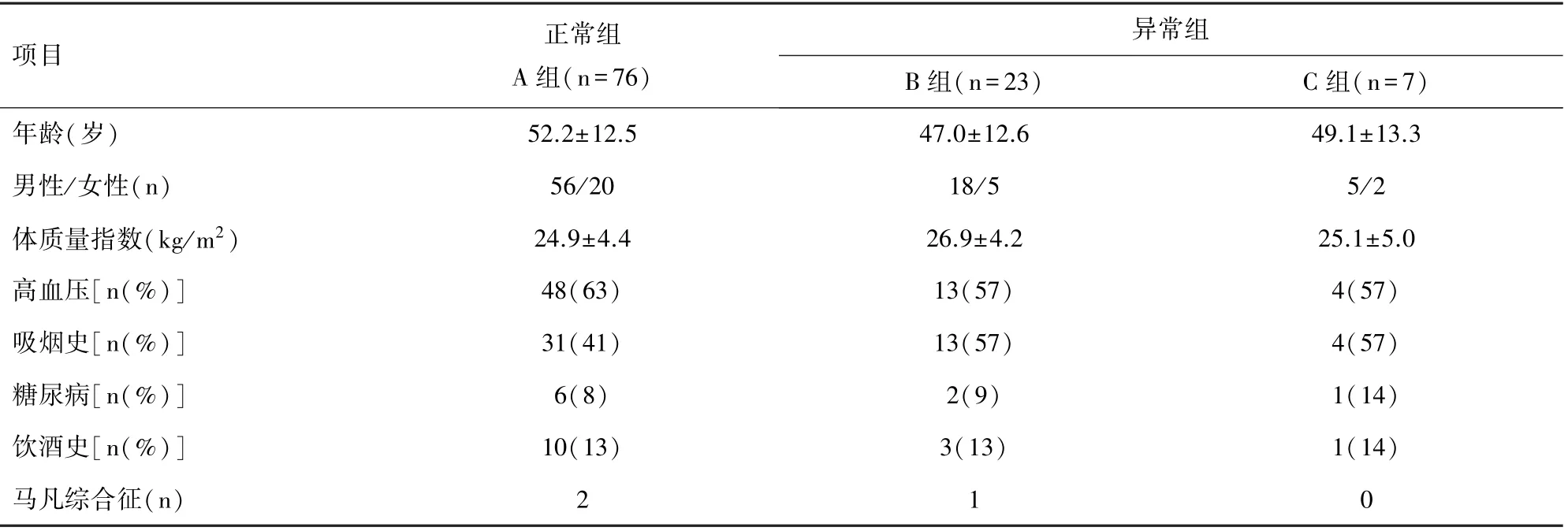
表1 三组患者基本情况
2.2 手术情况比较主动脉根部处理情况:行Bentall术12例,David术9例,升主动脉替换术85例。其中C组行人工血管转流术比例高达86%,明显高于另外两组,差异有统计学意义(P=0.01)。三组患者在体外循环时间、主动脉阻断时间、停循环时间均无明显统计学差异(P>0.05)。见表2。

表2 三组患者手术相关指标比较
2.3 肌红蛋白比较术前肌红蛋白水平C组高于A组及B组,但差异无统计学意义(P>0.05);术后肌红蛋白三组患者较术前均异常增高,其中C组[8 363.5(3 572.7,13 500.0)μg/L]患者明显高于A组[2 146.5(435.0,2 345.0)μg/L]和B组[4 049.1(702.5,7 544.5)μg/L],差异有统计学意义,如图1。

图1 三组患者肌红蛋白比较
2.4 术后肾功能变化及CRRT使用率的比较术前肌酐水平三组患者[79.5(50.3,90.0)μmol/L vs.115.0(52.0,115.0)μmol/L vs.85.3(46.0,125.0)μmol/L]差异无统计学意义(P>0.05);术后24 h肌酐三组患者均异常升高,其中C组[(278.7±56.8)μmol/L]患者明显高于A组[147.8±78.5)μmol/L]和B组[(162.8±104.7)μmol/L],差异有统计学意义,见图2。
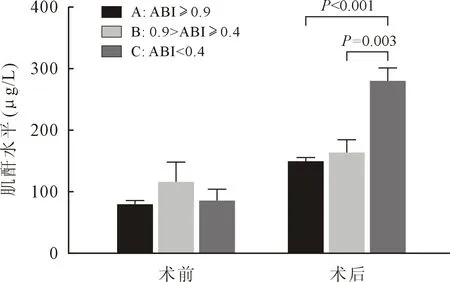
图2 三组患者肌酐水平比较
术后21例患者发生急性肾功能衰竭并行CRRT治疗,发生率为19.8%。其中发生急性肾衰并行CRRT使用率C组(57.1%)明显高于A组(14.5%)及B组(26.1%),差异有统计学意义(P<0.05)。
2.5 术后恢复比较各组ICU滞留时间及住院时间差异不明显,无统计学意义(P>0.05)。但术后机械通气时间C组明显长于A组和B组,差异均有统计学意义(P<0.01)。患者住院期间死亡患者共17例,其中C组患者死亡率71.4%,明显高于A组、B组,差异均有统计学意义(P<0.01)。见表3。

表3 三组患者术后恢复相关指标比较
3 讨 论
ATAAD是一类病变复杂、高死亡率的心血管疾病。近年来随着我国各级医院诊断水平的不断提高、胸痛中心建设的推广、患者健康意识的增加,诊断率明显提高,2019年全国大血管手术26 967例,较2018年增长了17.8%[6]。而随着孙氏手术的推广,ATAAD患者手术死亡率得到明显的下降。尽管如此,由于ATAAD病变复杂多变,术者对各类ATAAD患者预后情况的初步判断、术式的决策不一,导致患者术后早中期死亡率仍高达20%[7]。研究显示,脏器灌注不良综合征是影响ATAAD患者预后最危险的因素之一,研究报道近40%的ATAAD患者合并灌注不良综合征(malperfusion syndrome,MS),其中下肢动脉灌注不良在ATAAD患者中的发生率高达10%[8]。一旦出现下肢动脉灌注不良,局部组织缺血、水肿、进而导致横纹肌溶解、坏死,局部组织张力进一步升高,加剧血管压迫、缺血。同时随着肌红蛋白、酸性代谢产物、毒性因子、钾离子的释放入血,导致血红蛋白尿、高钾血症、代谢性酸中毒、急性肾功能衰竭等情况的出现,有毒物质的持续产生及释放,不能有效的排出体外,进一步引起内环境紊乱,多脏器功能衰竭,导致患者死亡。
然而目前对于下肢动脉灌注不良的量化指标的相关研究很少,本研究通过术前下肢与上肢压力之比,用ABI来量化反映ATAAD患者下肢缺血的严重程度。一旦主动脉夹层累计下肢动脉、真腔内血流减少甚至闭塞,就会导致远端灌注压降低,出现ABI降低,ABI下降的程度与远端夹层病变严重程度、分支血管灌注压力降低的幅度成正相关。本研究中,30例ATAAD患者(B组+C组)术前存在下肢缺血情况,发生率高达28%;其中接近7%患者(C组)存在下肢严重灌注不良。对于此类严重下肢灌注不良患者,术中在体外循环开始转机后,顺行插入10~14 F动脉插管行股动脉分流灌注,可尽早恢复肢体供血,缩短肢体缺血时间。
在本研究中,随着ABI的降低,远端灌注越差,增加了术中行人工血管转流术的可能。本研究中同期行下肢动脉转流患者14例,发生率13%。从各组患者人工血管转流率(A∶B∶C=2.6%∶26%∶85%)可以得出,并非ABI<0.4的所有ATAAD患者都需要行人工血管转流术,或ABI>0.9的ATAAD的患者都不用行下肢血管转流术。这其中可能和下肢血管灌注不良的分型相关,动力型下肢缺血ATAAD患者是由于远端动脉真腔狭窄或假腔压迫导致真腔塌陷引起下肢动脉缺血,其分支血管解剖上保持完整,在行孙氏手术后,术中支架植入展开后,假腔封闭,真腔开放,其血流和灌注压得到恢复。静力型则由于夹层远端内膜破裂,内膜卷曲导致缺血,往往在行孙氏手术后,需要同期行血运重建,恢复血运[9-10]。
既往研究显示18%~67%ATAAD患者术后发生急性肾损伤(acute kidney injury,AKI)[11],而在下肢缺血患者中,AKI发生率更高,这主要与横纹肌溶解、肌红蛋白释放、肾功能损害有关。对于肌红蛋白水平异常增高,CRRT可以有效的清除血中肌红蛋白,减轻横纹肌及肾脏损害,维持内环境稳定[12]。本研究中术前ABI越低,术后患者的肌酐、肌红蛋白水平越高(P<0.05),术后严重AKI发生率越高,行CRRT治疗的可能性越大(C组使用率达57%)。同时,本研究发现,对于ATAAD患者,随时ABI的降低,尽管本组患者在孙氏手术完成后,同期进行了人工血管转流,似乎并没有改善C组患者的预后,C组死亡率最高(A∶B∶C=10.5%∶17.4%∶71.4%)。
本研究为单中心的回顾性研究,样本量相对较少,有待于更大的样本量来进一步分析ABI分级与ATAAD患者预后的关系。同时在后期研究中,将围绕下肢缺血的不同类型,ABI对其血管转流术后的影响,进行进一步探讨。
4 结 论
采用ABI对术前下肢灌注不良综合征的严重程度进行量化分级,随着ABI的降低,ATAAD患者术后近期发生严重AKI并行CRRT治疗的可能性越大,近期死亡率亦越高。尽管术中对该类下肢动脉缺血严重的ATAAD患者进行人工血管转流术,但其近期死亡率及CRRT使用率仍旧没有得到有效降低。对于急诊ATAAD患者,ABI可以作为患者预后评估的一个量化因子,帮助外科医师客观评估患者目前病情及预后,完善下一步治疗方案。

