人类抗原R、中心体蛋白激酶2在前列腺癌中的表达及其临床价值
鲁博阳 赵 庆 单镜源 陈向峰 罗振国
佳木斯大学附属第一医院泌尿外科(黑龙江 佳木斯 154003)
根治性前列腺切除术是前列腺癌的标准治疗方法,但是,在部分病例中,该疾病遵循侵袭性病程,患者具有疾病复发,转移和与癌症相关的死亡[1-2]。前列腺癌中被放松调节或与不良结果相关的分子标志物的鉴定有助于评估潜在的新型治疗靶标,这可能有助于个体化和改善高危患者的治疗[3-4]。此外,已确定的预后因素如术前前列腺特异性抗原水平,但是其无法通过组织学分级,肿瘤分期,患者年龄和切除余量等临床因素预测患者预后[5]。因此,需要额外的预后标志物来评估个体的预后情况并计划个体化治疗。已有研究通过蛋白质组学发现前列腺癌组织和癌旁组织有众多表达差异蛋白[6],包括人类抗原R(HuR)和中心体蛋白激酶2(NEK2)。HuR通过与特定的mRNA亚群相互作用,提高了以下蛋白的水平:(1)促进细胞增殖,(2)增加细胞存活,(3)提高局部血管生成,(4)帮助癌细胞逃避免疫识别,(5)促进癌细胞的侵袭和转移[7]。NEK2参与有丝分裂细胞中中心体分离和双极纺锤体形成以及减数分裂细胞中染色质凝结控制[8]。NEK2通过磷酸化中心体蛋白,如CROCC,CEP250和NINL,调节中心体分离,导致它们从中心体移位。但是HuR和NEK2对前列腺癌的临床价值尚不明确。基于此,本研究探讨人类抗原R(HuR)、中心体蛋白激酶2(NEK2)在前列腺癌及其癌旁组织中的表达及其临床价值。
资料与方法
一、一般资料
纳入2018年1月-2021年1月我院收治的前列腺癌患者95例为恶性肿瘤组,其中,大于等于60岁的有43例,小于60岁的有52例,平均年龄(55.32±13.32)岁;有家族史45例,无家族史50例;肿瘤最大径大于等于5cm有58例,小于5cm有37例;组织学分级:G1和G2期共有34例,G3期有61例;精囊腺侵犯57例;临床分期:A和B期共有46例,C和D期共有49例。所有患者先前均已通过对从原发灶获取的活检样品进行组织病理学分析而诊断为前列腺癌。同时纳入2018年1月-2021年1月我院收治的前列腺增生患者69例为良性组,平均年龄(52.45±11.39)岁。排除标准:①严重心、肝、肾功能损害者;②服用过内分泌药物者;③患有其他肿瘤者;④患有精神疾病者。各组一般资料比较差异均无统计学意义(P>0.05),可纳入此次分析。本研究经医院伦理委员会审批,受试者均签署知情同意书。
二、免疫组织化学
将手术所得的组织进行包埋和切片。将载玻片脱蜡,再水化,浸入3%过氧化氢溶液中15分钟,在柠檬酸盐缓冲液(pH 6.0)中于95℃加热25分钟,然后于室温冷却60分钟。在每个孵育步骤之间,将切片用PBS(pH 7.4)洗涤。将载玻片用10%正常山羊血清在37℃下封闭30分钟,洗涤并在4℃下与抗HuR小鼠单克隆抗体(ab242410,abcam公 司),NEK2兔多克隆抗体(ab115731,abcam公司)结合。没有添加一抗的玻片用作阴性对照。用PBS洗涤后,按照制造商的说明使用PV-9000聚合物检测系统对玻片进行可视化,然后用苏木精复染。
三、总RNA抽取与实时荧光定量PCR
通过TRIzol试剂(Ambion)从组织中提取总RNA。按照制造商的说明,通过GoScript逆转录(RT)系统(Promega)将总RNA逆转录为cDNA。实时定量逆转录聚合酶链反应(qRT-PCR)用于通过Mx3005P实时PCR系统(Stratagene)上的GoTaq qPCR Master Mix(Promega)检测HuR,NEK2,GAPDH水平。所有结果均表示为三个独立实验的平均值±标准差。
四、统计学分析
使用Python中pandas package进行统计学分析。使用t检验比较连续变量。Chi-square检验分析NEK2和HuR与前列腺癌患者临床病理特征的相关性。应用受试者工作特征(ROC)曲线下面积(AUC)分析HuR和NEK2 mRNA水平对区分前列腺癌患者临床病理特征的效能。P<0.05的差异被认为具有统计学意义。
结 果
一、前列腺癌患者癌组织和癌旁组织中HuR和NEK2的表达水平
肿瘤组癌组织中HuR和NEK2的表达阳性率均高于良性组前列腺增生组织,见表1。肿瘤组癌组织中HuR和NEK2的蛋白表达水平和mRNA表达水平均高于癌旁组织,见图1和图2。
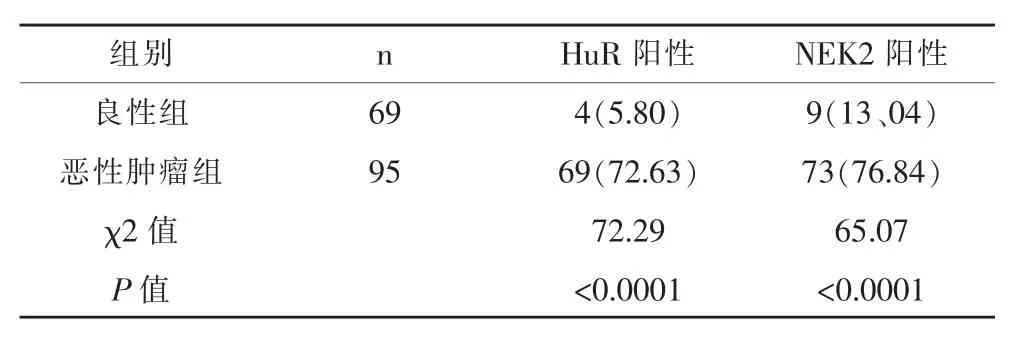
表1 良性组和恶性肿瘤组中HuR和NEK2的表达阳性率
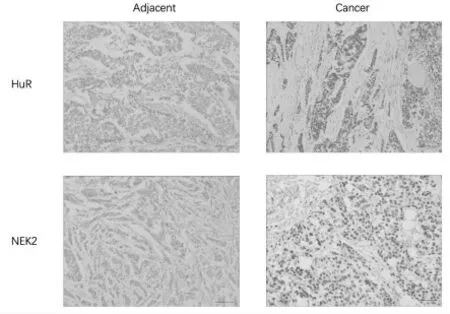
图1 前列腺癌患者癌组织和癌旁组织中HuR和NEK2的蛋白表达水平
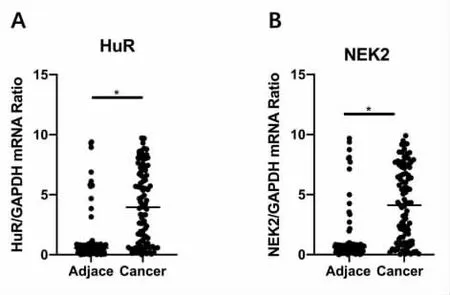
图2 前列腺癌患者癌组织和癌旁组织中HuR和NEK2的mRNA表达水平
二、HuR和NEK2与前列腺癌患者临床病理特征的相关性
肿瘤组癌组织中HuR和NEK2的阳性表达与年龄、家族史无关(P>0.05),而与肿瘤最大径、组织学分级、精囊腺侵犯、临床分期具有相关性(P<0.05),见表2。
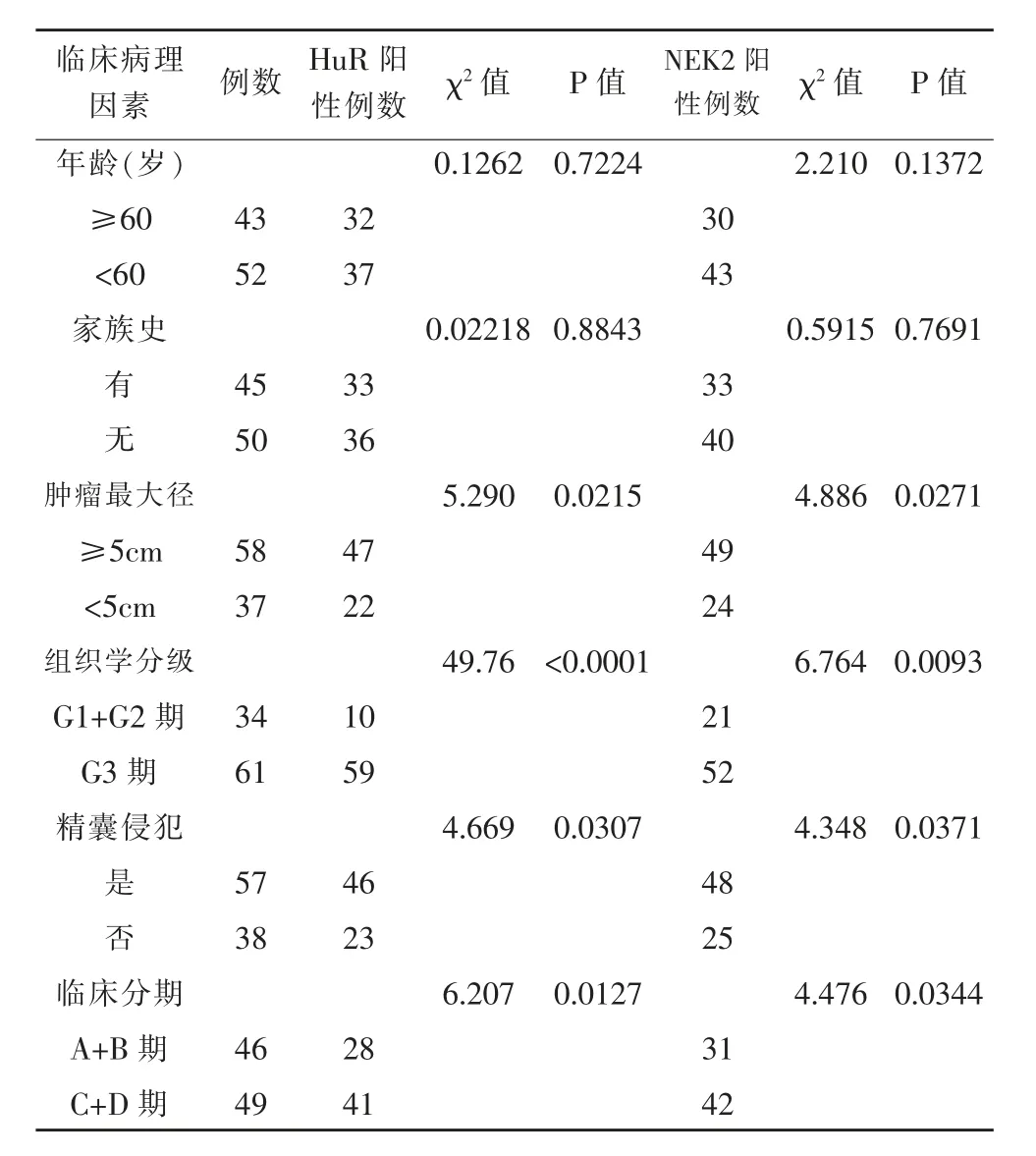
表2 HuR与NEK2与前列腺癌患者临床病理特征的相关性
三、HuR和NEK2 mRNA水平对区分前列腺癌患者临床病理特征的效能
为了评估HuR和NEK2 mRNA水平在前列腺癌患者临床病理特征中的诊甄别效能,将95例前列腺癌患者癌组织中HuR和NEK2 mRNA进行ROC分析。HuR mRNA水平在区别肿瘤最大径、组织学分级、精囊腺侵犯、临床分期有相关性的灵敏度分别为85%、92%、80%、86%,特异度分别为78%、82%、83%、78%。NEK2 mRNA水平在区别肿瘤最大径、组织学分级、精囊腺侵犯、临床分期有相关性的灵敏度分别为87%、89%、80%、83%,特异度分别为83%、85%、85%、82%,见表3。
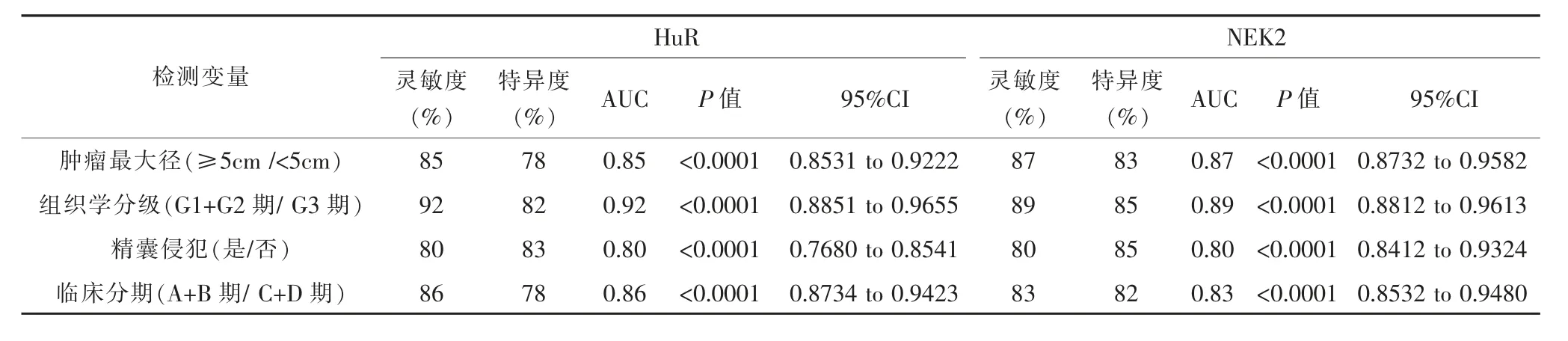
表3 HuR和NEK2 mRNA水平与前列腺癌患者临床病理参数的关系
讨 论
前列腺癌是威胁男性健康的最常见的恶性肿瘤之一[7]。2012年,全世界大约有110万人被诊断出患有前列腺癌[8]。据统计,美国每年约有220,800例新的前列腺癌病例,占男性恶性肿瘤的1/42。近年来,中国前列腺癌的发病率大大增加了[9]。尽管前列腺癌的筛查,诊断和治疗技术取得了显著发展,但其死亡率仍然很高[10]。主要原因是前列腺癌是一种典型的异质性疾病,其症状不明显且进展缓慢。但是,也有一些前列腺癌患者症状会迅速发展,并且可能会转移到骨骼或其他器官,最终导致相对较高的死亡率[11]。因此,迫切需要一些新的生物标志来指征前列腺癌的临床特征。
在本研究中,发现肿瘤组受试人员癌组织中HuR和NEK2的表达阳性率均高于良性组受试人员前列腺增生组织(P<0.05)。肿瘤组癌患者癌组织中HuR和NEK2的蛋白表达水平和mRNA表达水平均高于癌旁组织(P<0.05)。提示HuR和NEK2的蛋白表达水平和mRNA表达水平可能成为新的前列腺癌特征的标志物。
本研究发现前列腺癌患者癌组织中HuR和NEK2的阳性表达与年龄因素、家族史因素无关(P>0.05),而与肿瘤最大径、组织学分级、精囊腺侵犯、临床分期有相关性(P<0.05)。HuR是RNA结合蛋白Hu家族的成员,在许多细胞类型中普遍表达。HuR识别并结合含有腺苷和富含尿嘧啶元素的mRNA[12]。这些元素经常出现在几种不稳定的转录本的3'非翻译区域,这些转录本编码细胞因子,细胞周期调节因子或原癌基因。HuR与mRNA的结合稳定了mRNA,并防止其被核酸外切酶快速降解[13]。因此,HuR可能是提高了促肿瘤发生发展中重要蛋白的mRNA的稳定性来促进肿瘤的发生发展。NIMA相关激酶2(NEK2)是细胞周期调节蛋白激酶家族的成员,属于中心体相关蛋白激酶[14]。相关研究的学者发现了间期和有丝分裂期[15]。此外,大量研究表明,NEK2表达在多种肿瘤中异常升高[16]。此外,NEK2异常涉及恶性肿瘤的发生和发展的许多环节[17]。提示NEK2可以作为治疗人类恶性肿瘤的潜在靶标。HuR mRNA水平在区别肿瘤最大径、组织学分级、精囊腺侵犯、临床分期相关性的灵敏度分别为85%、92%、80%、86%,特异度分别为78%、82%、83%、78%。NEK2 mRNA水平在区别肿瘤最大径、组织学分级、精囊腺侵犯、临床分期有相关性的灵敏度分别为87%、89%、80%、83%,特异度分别为83%、85%、85%、82%,显示了HuR和NEK2 mRNA水平较好的区分效能。
综上所述,HuR和NEK2在前列腺癌组织中呈高阳性,与肿瘤最大径、组织学分级、精囊腺侵犯、临床分期有相关性,可作为前列腺癌患者临床病理特征诊断和预后的潜在生物学标记分子。

