出芽短梗霉菌PA-2对藜叶片生理生化的影响
朱 杰,杨 莹,程 亮,朱海霞,张 纲,赵 云,郭青云*
(1.青海大学农林科学院,青海省农业有害生物综合治理重点实验室,农业农村部西宁作物有害生物科学观测实验站,青海 西宁 810016; 2.海东市乐都区农业技术推广中心,青海 海东 810700; 3.西宁市农业农村局,青海 西宁 810016)
藜(Chenopodiumalbum)是一种耐盐的藜科藜属植物[1],适应性强,在干旱环境条件下生长旺盛[2]。目前防除杂草藜主要利用人工机械除草和化学药剂,由于化学防治存在残留、抗性等缺点[3-5],生物防治可以作为一种补充传统防治的潜在选择[6]。具有除草活性的微生物资源成为研究微生物源除草剂的热点[7]。生物除草剂不仅对杂草具有较好的防效[8-10],还可以增加作物产量[11],不会对植物产生危害。朱海霞等[12]研究得出多孢木霉对密花香薷和野燕麦等具有良好的除草效果,并且对豌豆和蚕豆无毒害作用;另外,使用微生物源除草剂可以改善物种群落结构,Zhang等[13]研究发现生防菌(Sclerotiumrolfsii)与化学除草剂相比,生防菌显著改善了加拿大一枝黄花入侵生境的杂草群落结构。由此可知,利用生防菌防治杂草具有生态和经济的双重效益。
青藏高原具备独特的气候环境,拥有丰富的极境微生物种群,为开发利用微生物资源提供有利条件[14]。本课题组从青海省平安县发病杨树叶片上分离得到出芽短梗霉菌株PA-2,前期对菌株PA-2进行除草活性测定,研究表明该菌株对藜的鲜重防效达78.46%[22],其可湿性粉剂对藜的鲜重防效最高可达75.0%[23],但前期研究缺少藜保护酶和超微结构的研究。有研究表明,植株受到病原菌侵染后,寄主细胞和组织将发生一系列与致病性相关的生理生化反应,这些反应常常涉及到植株水分和养分运输[15]、细胞超微结构[16]、病害产生[17]以及光合作用和其他代谢过程[18-21]。鉴于此,本研究通过对出芽短梗霉菌PA-2粗提物胁迫前后的藜植物体内保护酶活性、渗透性物质、光合色素、丙二醛、可溶性蛋白和可溶性糖以及细胞超微结构的变化进行分析,为解析出芽短梗霉菌PA-2对藜侵染的分子机理提供参考。
1 材料与方法
1.1 供试菌株
出芽短梗霉菌(Aureobasidiumpullulans)PA-2:青海省农业有害生物综合治理重点实验室从自然感病杨树叶上分离获得。
1.2 试验方法
本试验在青海大学农林科学院植物保护研究所进行。参考本课题组先前优化的培养基,制备出芽短梗霉菌PA-2的发酵液,备用。
在植物保护研究所温室内放置10个花盆,在田间划5个小区,在每个花盆及小区里移栽5株3~4叶期的藜幼苗,使幼苗生长到8叶期时,将上述PA-2发酵液用无菌水稀释到106~108CFU/mL的浓度,然后分别接种20 mL至5盆(区)藜上,另外5盆接种无菌水作为对照。在相对湿度约为60%,温度为20 ℃,分别在喷施第1天~第7天后采集处理组、田间组和对照组藜叶片。在每个采集时间点,采集5株长势一致植株所有中间叶片,设置3次重复。
1.3 生理指标测定
叶绿素含量[24]的测定:称取不同处理的0.1 g藜叶片,放入研钵中,在95%乙醇条件下浸泡 24 h。以95%乙醇作为空白对照,分别在波长665、649、470 nm下测定其对应吸光度(OD)。665 nm和649 nm分别是叶绿素a和叶绿素b最大吸收波长。利用下述公式分别计算叶绿素a和叶绿素b的浓度(mg/mL),然后计算叶绿素的总浓度(mg/mL),每个处理设置3次重复。
叶绿素a=13.95A665-6.88A649
叶绿素b=24.96A649-7.32A665
类胡萝卜素=(1 000A470-2.05Ca-114.8Cb)/245
叶绿素含量=(叶绿素总浓度×提取液体积×稀释倍数)/样品鲜重
丙二醛(MDA)含量测定采用TBA法[24];过氧化氢酶(CAT)活性采用钼酸铵法[25];过氧化物酶(POD)活性采用俞创木酚法[26];超氧化物歧化酶(SOD)活性采用羟胺法[26];苯丙氨酸解氨酶(PAL)活性采用苯丙氨酸比色法[27];可溶性蛋白质含量采用考马斯亮蓝染色法[27];可溶性糖采用蒽酮比色法[27]。
1.4 藜叶片细胞超微结构观察
分别在喷施PA-2发酵液1、2、3 d选取5片新鲜藜叶,轻轻擦净组织表面污物,将叶片切成0.5 mm×0.5 mm的小方块,每个处理制作15个切块,投入体积分数为2.5%的戊二醛固定液中,真空抽气至叶片完全浸入固定液中,4 ℃放置过夜,将初固定的样品取出,用0.1 mol/L磷酸缓冲液(pH 7.2)漂洗3次(每次15 min),再用1%的锇酸溶液固定3 h,经蒸馏水漂洗后,用70%、80%、90%、95%、100%乙醇进行梯度脱水,每个浓度进行15 min,中间用丙酮过渡,最后使用环氧树脂进行渗透并包埋[28]。KLB5型切片机切成片后,使用醋酸铀加柠檬酸铅进行双重染色,在透射电镜(Japan,HITACHI-7650)下观察并拍照。
1.5 数据分析
利用软件Excel 2005和SPSS 14.0软件对数据进行处理及统计分析。
2 结果分析
2.1 出芽短梗霉菌PA-2粗提物对藜叶片生理生化指标的影响
2.1.1 对藜叶片丙二醛(MDA)含量的影响
由图1a可以看出,在田间试验和盆栽试验中藜叶片MDA含量均高于对照,在第2天和第4天时,盆栽处理与田间处理分别出现峰值。第2天,盆栽试验中,藜叶片内的MDA含量上升至最大值,整体含量变化趋势是先上调后平缓下调;田间试验中MDA含量在第4天达到最大值,第6天接近对照。喷雾第2天时,MDA含量差异较大,盆栽处理比空白对照处理的MDA含量增加了580.0%,盆栽处理比田间处理的MDA含量增加了161.5%。
2.1.2 对藜叶片过氧化氢酶(CAT)活性的影响
由图1b可以看出,在田间试验和盆栽试验中藜叶片CAT酶活性均高于对照,盆栽处理在第2天达到最高值,后总体水平呈下降趋势;田间处理中CAT酶活性在第4天时达最大值,总体含量低于盆栽处理。经喷雾第2天时,不同处理CAT酶活性差异较大,盆栽处理比空白对照处理的CAT酶活性增加了367.2%。经喷雾4 d时,田间处理比空白对照处理的CAT酶活性增加了143.5%。
2.1.3 对藜叶片过氧化物酶(POD)活性的影响
由图1c可以看出,在田间试验和盆栽试验中藜叶片POD酶活均高于对照。盆栽处理在第2天达到最高值;田间处理中POD含量在第3天达最大值,第6天接近对照。盆栽试验中POD酶活性高于田间试验和对照。第2天时POD酶活性差异较大,盆栽处理比空白对照处理的POD酶活性增加了72.5%。盆栽处理比田间处理的POD酶活性增加了32.1%。
2.1.4 对藜叶片超氧化物歧化酶(SOD)活性的影响
由图1d可以看出,在田间试验中藜叶片SOD酶含量低于对照,第2天和第4天出现峰值,第2天达最大值;盆栽试验在第1天~第2天、第4天~第7天低于对照,在第3天~第4天高于对照,且第3天为最大值。第5天出现最小值,此时处理间SOD酶活性差异较大,盆栽处理比空白对照处理的SOD酶活性降低了20.0%,田间处理比空白对照处理降低了2.0%。
2.1.5 对藜叶片苯丙氨酸解氨酶(PAL)活性的影响
由图1e可以看出,PA-2喷施后,盆栽和田间处理组的PAL酶活性远低于对照组。在第1天3个处理的PAL酶活性基本接近。盆栽处理的PAL酶活性在第2天达到峰值,之后藜叶片内PAL酶活性一直缓慢降低;田间处理组,藜叶片中PAL酶活性变化趋势为先下降后上升再下降,在第5天时达到最大值。喷雾4 d时,各处理间差异较大,盆栽处理比空白对照处理的PAL酶活性降低了70.6%,田间处理比空白对照降低了48.7%。
2.1.6 对藜叶片可溶性蛋白含量的影响
由图1f可以看出,经PA-2喷施后,盆栽处理和田间处理的藜叶片可溶性蛋白含量总体水平小于空白对照。在第2天和第4天,盆栽与田间试验均出现谷值,且第6天,田间处理蛋白质谷值出现最大值,此时可溶性蛋白差异较大,盆栽处理比对照的可溶性蛋白含量降低了76.2%,田间处理比对照降低了36.4%。
2.1.7 对藜叶片可溶性糖含量的影响
由图1g可以看出,经PA-2喷施后,盆栽处理的可溶性糖含量总体水平低于田间处理和空白对照,且呈下降趋势。经PA-2喷施2 d后盆栽处理及田间处理的藜叶片中,可溶性糖含量下降速率最大,盆栽处理比空白对照处理的可溶性糖含量降低了54.0%,田间处理比空白对照处理降低了49.6%。
2.1.8 对藜叶片叶绿素含量的影响
由图1h可以看出,随着处理时间的延长,盆栽试验与田间试验中藜叶片叶绿素含量整体呈持续下降趋势,且均低于对照,叶绿素降低的速率为盆栽试验>田间试验。尤其是盆栽试验中,4 d后,叶绿素含量下降速率明显加快。在第7天时,盆栽处理比空白对照处理的叶绿素含量降低了54.9%,田间处理比空白对照处理降低了11.9%。
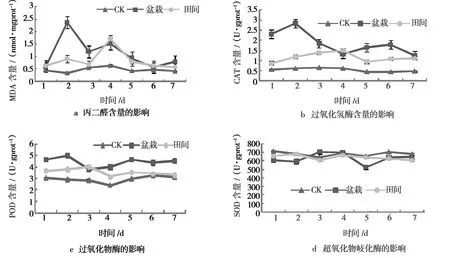
图1 出芽短梗霉菌PA-2不同时间胁迫下藜叶片丙二醛(MDA)、过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物岐化酶(SOD)和苯丙氨酸解氨酶(PAL)活性以及可溶性蛋白质、可溶性糖、叶绿素的含量变化
2.2 出芽短梗霉菌PA-2粗提物对藜叶片细胞超微结构的影响
观察各时间点叶肉细胞超微结构变化情况(图2)。在无菌水处理的藜叶片中,其细胞结构具有完整的结构,细胞壁和细胞膜等细胞器比较清晰。叶绿体呈梭形态,整齐的黏附在细胞质膜上,具有清晰完整双层膜结构,含有一些淀粉粒和嗜锇体;线粒体呈圆球状,结构完整的排列在叶绿体的周边;具有清晰可见的核膜核仁(图2A和图2B)。喷施PA-2发酵液的第1天后,叶绿体呈现肿胀,其内的一些嗜锇体叶呈现肿胀,叶绿体中淀粉粒也出现体积增大及数量增多的现象,而线粒体结构未发生明显变化(图2C和图2D)。经PA-2喷施2 d后,叶绿体肿胀变形加重,不再黏附细胞质膜,在胞内呈现杂乱无序的状态,细胞内具有一些淀粉粒,部分叶绿体呈现中空现象;而线粒体结构无明显变化(图2E和图2F)。PA-2喷施3 d后,叶绿体已被损伤至无完整的形状,外膜发生解体并分布有很多淀粉粒,线粒体结构开始出现肿胀(图2G和图2H)。
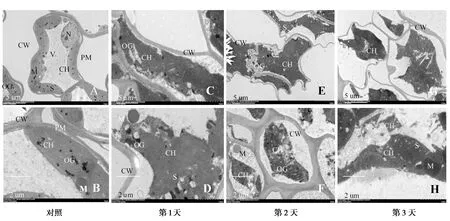
A和B:对照叶肉细胞超微结构;C和D:24 h叶肉细胞超微结构;E和F:48 h叶肉细胞超微结构;G和H:72 h叶肉细胞超微结构;CH:叶绿体;M:线粒体;CW:细胞壁;OG:嗜锇体;S:淀粉粒;V:液泡;N:细胞核;PM:质膜
3 讨论与结论
在具有除草效果的生防制剂胁迫后,植株主要表现在以下几个方面:器官结构改变,能量供应和色素合成和生长繁殖受影响等[21],其中以影响叶绿体的功能为主[29]。本研究采用PA-2菌株发酵液喷雾处理藜叶片后,发现藜叶片中丙二醛(MDA)含量、抗氧化酶活性、可溶性糖及蛋白质含量等相关的生理指标都发生改变,其中比较明显的是,叶绿素含量的显著下降。同时通过观察细胞超微结构发现,在PA-2侵染后,藜叶片叶绿体发生肿胀,一些叶绿体发生解体现象,推测PA-2可能通过严重影响藜叶片正常的光合作用来抑制其生长。丙二醛(MDA)是细胞膜脂过氧化的产物,其含量变化可以反映植物遭受逆境伤害的程度[30]。本研究发现,在盆栽和田间试验中,藜叶片中的MDA含量呈现先升后降,第6天接近对照,说明在PA-2菌株粗提物处理初期,细胞膜受到了一定的损害,随着时间推移,植物细胞膜通过抗氧化酶系统的调节作用缓解了部分损伤[31]。田间试验与盆栽试验于第2天、第4天MDA含量均有峰值出现,且田间试验中,在MDA含量增加时,SOD含量均明显增加;同样在盆栽试验中,MDA含量达最高值时,CAT与POD含量均达最大值。SOD、POD和CAT是细胞内清除氧自由基的酶促保护系统中重要组成,植物体内SOD活性增强,能有效清除O2-等活性氧自由基[32];POD在植物的逆境中可能更多起着协同补充的作用[33],CAT对清除ROS发挥着重要作用[34]。三者之间的协调能使植物体内活性氧自由基维持在较低的水平,避免损害生物膜[35]。由此可知,抗氧化酶代谢系统参与了PA-2发酵液胁迫藜叶片时的防卫反应。
从PAL含量变化曲线中可以看出,无论是田间还是盆栽试验,PAL含量总体水平下降,而PAL活性与酚类物质的合成有着密切的联系[36],它是莽草酸途径的限速酶,由该途径合成的中间产物都是植物体内一些重要的抗菌物质,如酚类物质、植保素和木质素等[37],本研究中PAL活性降低,一定程度上说明了藜植株酚类物质的合成受阻。可溶性蛋白和可溶性糖与对照相比总体含量下降,说明PA-2发酵液影响了可溶性蛋白和可溶性糖的合成。另外,植物对环境适应的基础是线粒体的活动[35],在PA-2发酵液处理的第3天超微结构图中可以观察到线粒体结构发生肿胀,说明藜受出芽短梗霉菌PA-2发酵液胁迫后,线粒体也受到一定的影响。综上所述,出芽短梗霉菌PA-2粗提物对杂草藜叶片的生理生化影响表现为以破坏叶绿素的功能为主,其次影响线粒体结构,降低酚类物质、可溶性糖、可溶性蛋白质的合成。

