青海高原不同种源西北小檗幼苗对低温胁迫的生理响应
向前胜,张 政,张登山*,王 宁,赵 越,孙 奎,铁 军,李积鑫,更桑才仁
1.青海大学农林科学院,青海 西宁 810016; 2.韶关学院,广东 韶关 512005 ;3.青海省海西蒙古族藏族自治州乌兰县自然资源局,青海 乌兰 817100; 4.青海省海东市乐都区上北山林场,青海 海东 810699;5.青海省玉树藏族自治州称多县自然资源局,青海 称多 815000)
西北小檗(Berberisvernae)又名匙叶小檗,属小檗科小檗属植物,为落叶灌木。具有抗旱、耐寒、耐盐碱、耐风蚀等特性,具有很大的生态价值。其植物体内含有丰富的次生代谢物小檗碱,被广泛应用于医药领域[1],具有极高的药用价值;最新研究表明,小檗碱可用作新型冠状肺炎治疗的潜在候选药物[2]。除此之外,西北小檗植株具有较高的观赏价值,常用作庭院绿化的观赏树种,果实可用作保健饮料开发和制作饲料的原料[3]。青海高原是西北小檗的重要分布区之一,主要分布在海拔2 300~4 000 m[4]。
前期关于青海高原西北小檗的研究主要集中在其体内次生代谢物与海拔、纬度的关系等领域,并得出了药用部位盐酸小檗碱的含量随海拔升高而增加的规律[5-8]。但是,对于不同海拔位置的西北小檗种源对环境的适用性研究及其对低温条件的响应尚未见报道。本试验通过收集玉树藏族自治州玉树市下拉秀乡、西宁市大通县新庄镇、海东市乐都区上北山林场共3处种源西北小檗成熟种子进行育苗,通过测定低温处理下不同种源西北小檗枝条的相对电导率并拟合 Logistic 方程计算出不同种源的低温半致死温度,对其幼苗进行低温胁迫,测定叶片的生理指标变化情况,比较不同种源的西北小檗幼苗对低温胁迫的生理响应规律,以期为西北小檗耐寒种质的筛选、耐寒基因挖掘以及高海拔城镇绿化树种的种源地选择及引种栽培提供理论依据。
1 材料与方法
1.1 种源地概况
于2019年10月份分别从青海高原玉树藏族自治州玉树市下拉秀乡、西宁市大通县新庄镇和海东市乐都区上北山林场的西北小檗自然分布群落收集成熟的种子。经清洗、风干、沙藏、杀菌等工序,于2020年4月播种在青海大学农林科学院温室中,以沙粒土和黏土1∶2为基质,繁育成苗。

表1 采种地概况信息表
1.2 试验方法
1.2.1 低温半致死温度试验 2020年9月份从育苗植株中选取粗度均匀150 d的新鲜枝条,每处种源15份,每份剪成10~15 cm长枝条,自来水冲洗干净后,用去离子水冲洗3遍,纱布擦干,每处种源留下1份,其余塑封后放置于0 ℃低温冰箱中备用。参照时朝等[9]的试验设计,设置可调式低温培养箱温度梯度分别为-10 ℃、-20 ℃、-30 ℃、-40 ℃,冷冻处理以 5 ℃/h 的速度降温,达到目标水平后,维持12 h,然后室温(16 ℃)解冻。对照处理 CK(16 ℃)为室温。每处种源各个水平 3次重复。相对电导率采用DDSJ-308F电导仪 (上海雷磁) 进行测定[10],将相对电导率拟合成 Logistic 曲线方程测定半致死温度[11-12]。
1.2.2 低温胁迫试验 选取3处种源150 d生西北小檗幼苗为试验材料。由于玉树藏族自治州的生长季4—9月份的月均气温为10.28 ℃,西宁市的生长季4—9月份的月均气温为13.3 ℃,海东市的生长季4—9月份的月均气温为12.28 ℃,故低温培养箱低温胁迫温度分别设定为12 ℃、8 ℃、4 ℃和0 ℃,对照温度条件为16 ℃,处理时间为48 h(光照黑暗处理各12 h,2次循环)。经低温胁迫处理后,各处种源随机挑选20棵苗,每株按从上至下的顺序选取无病虫害的第二对或第三对叶4~6片,采样后迅速进行试验。材料处理:将叶片表面灰尘擦去后用蒸馏水冲洗2~3遍,再用滤纸吸干表面蒸馏水,用剪刀除去叶脉,剩余部分剪碎备用。
1.2.3 生理指标测定方法 可溶性糖含量采用蒽酮法[13]测定;可溶性蛋白含量采用考马斯亮蓝法[14]测定;丙二醛(MDA)含量采用硫代巴比妥酸法[15]测定;超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)法[16]测定;过氧化氢酶(CAT)活性采用紫外分光光度法[17]测定;过氧化物酶(POD)活性采用愈创木酚法[18]测定。
1.3 数据处理
数据使用Excel 2007进行计算和作图,用SPSS 22.0进行 Logistic 方程拟合计算其低温半致死温度,同时进行方差分析和多重比较。
2 结果与分析
2.1 3处种源西北小檗枝条低温半致死温度
将3处种源的西北小檗枝条在不同温度处理下的相对电导率进行Logistic方程拟合,得出各种源的低温半致死温度。研究结果表明:3处种源植物材料Logistic方程的拟合度R2值均高于0.950。玉树市下拉秀乡、西宁市大通县和海东市乐都区3处种源西北小檗枝条的半致死温度分别为-21.55、-16.83、-15.78 ℃(表2)。从半致死温度的结果来看,玉树市下拉秀乡种源的西北小檗抗寒性高于西宁市大通县和海东市乐都区种源。

表2 3处种源的西北小檗枝条相对电导率 Logistic 方程及半致死温度
2.2 低温胁迫后西北小檗叶片生理指标的响应
将低温胁迫后的3处种源的西北小檗叶片生理指标进行多重比较。在整个低温胁迫过程中,3处不同种源西北小檗幼苗的可溶性蛋白和可溶性糖含量多重比较见图1。不同种源的西北小檗叶片可溶性蛋白和可溶性糖的含量对持续48 h的低温胁迫条件的响应不同。可溶性蛋白含量部分:在各低温胁迫条件下,玉树市下拉秀乡种源的含量均高于西宁市大通县和海东市乐都区。随着温度降低,总体呈现先增高后降低的趋势,在4 ℃条件下均达到最高值,含量分别为0.323 mg/g、0.317 mg/g和0.343 mg/g;0 ℃条件下相对于对照温度均有增加,相互间差异不显著。可溶性糖含量部分:3处种源可溶性糖含量随温度降低呈现先增高后降低的趋势。在对照处理16 ℃条件下,玉树市下拉秀乡种源可溶性糖含量低于西宁市大通县和海东市乐都区;随着温度降低,在12 ℃条件下玉树市下拉秀乡种源可溶性糖含量增大,均高于同温度下的其他两处种源,与海东市乐都区种源存在极显著差异;在4 ℃条件下均达到最高值,分别为玉树市下拉秀乡41.10 mg/g、西宁市大通县28.00 mg/g和海东市乐都区26.10 mg/g,且玉树市下拉秀乡种源与其他两处种源间差异极显著;随着温度降低,在0 ℃条件下,三者的可溶性糖含量均降低。
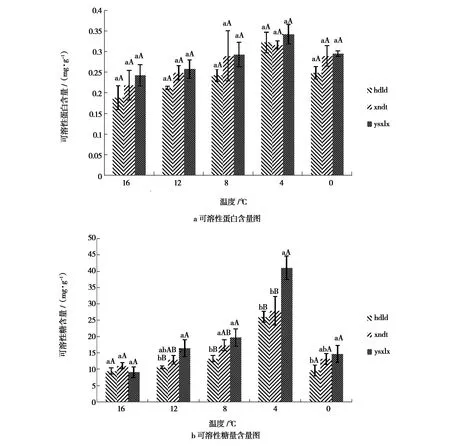
图中不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01);下同。
在低温胁迫条件下,3种不同种源西北小檗幼苗的MDA含量多重比较见图2,由图2可知,低温胁迫对西北小檗叶片MDA的含量造成了不同程度的影响,且随着温度降低总体呈现升高趋势。对照条件16 ℃温度下,玉树市下拉秀乡种源的含量最高,为7.40 nmol/g,且与其他两处种源存在显著差异;随着低温胁迫的进行,至0 ℃条件下,海东市乐都区种源MDA含量最高,为17.90 nmol/g,且与其他两处种源间存在极显著差异,西宁市大通县种源含量最低,为13.50 nmol/g。通过与16 ℃条件对比,可以发现海东市乐都区种源的增加量最高,为14.70 nmol/g,且高于其他两处种源;玉树市下拉秀乡种源的增加量最低,为6.7 nmol/g,说明玉树市下拉秀乡种源对低温的适应性更强。

图2 低温胁迫后3处种源西北小檗叶片MDA含量
在低温胁迫条件下,3处不同种源西北小檗幼苗的SOD、POD和CAT活性多重比较见图3。由图3可知,3处种源的西北小檗幼苗随胁迫温度的降低,其3种保护酶活性总体上呈现出先增加再降低的趋势。在16 ℃条件下,海东市乐都区种源SOD活性低于玉树市下拉秀乡和西宁市大通县;在12 ℃条件下,西宁市大通县种源的SOD活性最高;在8 ℃、4 ℃及0 ℃条件下,玉树市下拉秀乡种源SOD活性高于其他两处种源;在4 ℃条件下,3处种源均达到最高值,其中玉树市下拉秀乡种源SOD活性最高,为2 258.60 U/g;与对照相比,玉树市下拉秀乡、西宁市大通县和海东市乐都区的增加值分别为1 384.30、674.60、742.70 U/g。在16 ℃条件下,海东市乐都区种源POD和CAT活性高于其他两处;在12 ℃条件下,西宁市大通县种源的POD和CAT活性高于其他两处;玉树市下拉秀乡种源在8 ℃时,POD和CAT活性均出现大幅上升,均高于其他两处种源;在4 ℃的条件下,玉树市下拉秀乡种源的POD和CAT活性均较高,分别为132.60 U/g和142.20 U/g,与西宁市大通县及海东市乐都区种源存在极显著差异;在0 ℃条件下,3处种源的POD和CAT活性则降低。
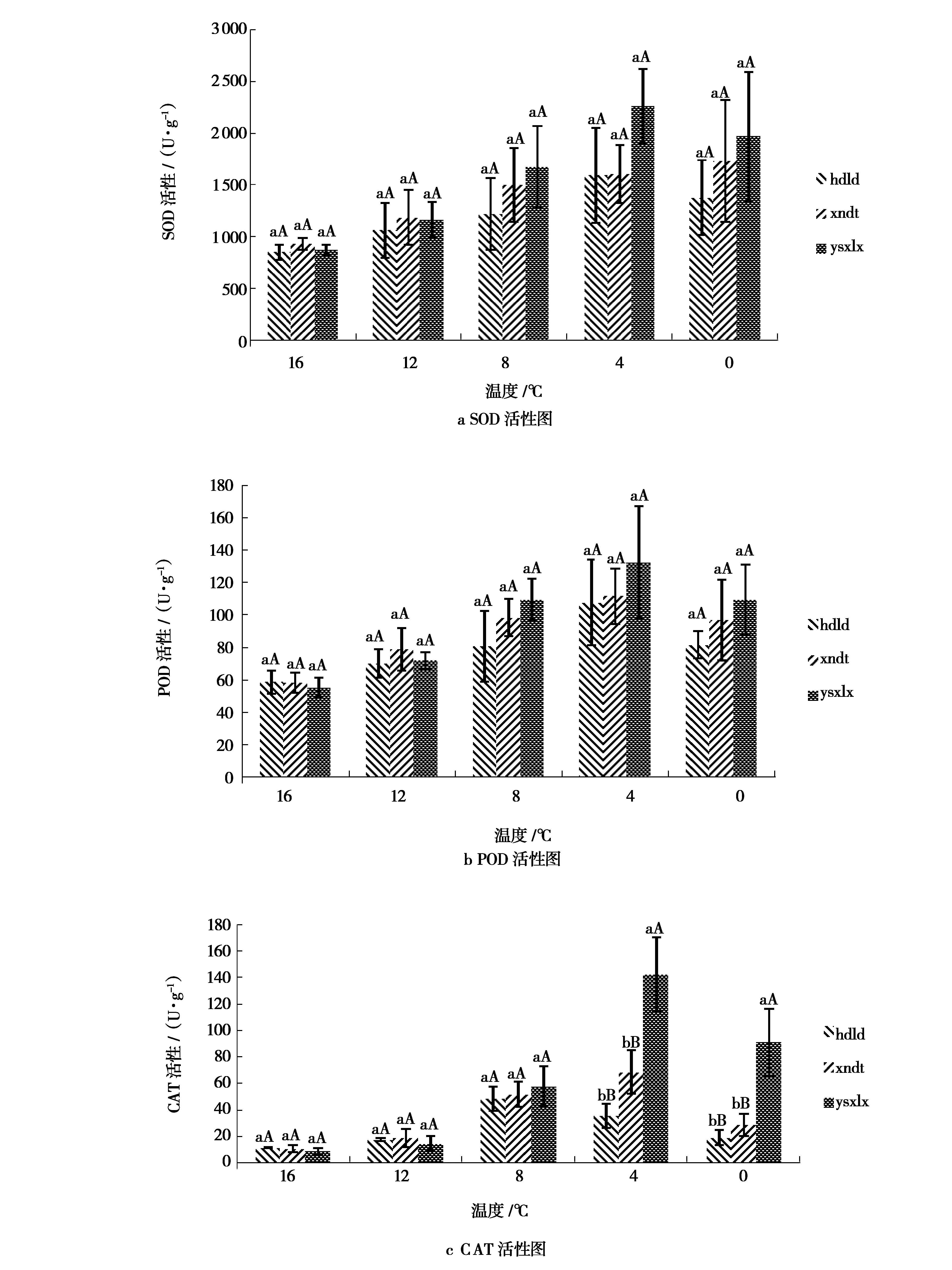
图3 低温胁迫下3处不同种源西北小檗叶片3种保护酶活性图
总之,在16 ℃和12 ℃时,玉树市下拉秀乡种源的SOD、POD和CAT活性均低于西宁市大通县和海东市乐都区种源,当温度降低至8 ℃和4 ℃时,其3种保护酶活性的增加量均高于其他两处种源,由此说明玉树市下拉秀乡种源的保护酶系统在低温条件下较其他两处种源更敏感,能在低温条件下迅速提高保护酶的活性,以减少体内细胞遭受低温带来的损伤。
3 讨论与结论
3.1 不同种源的西北小檗低温半致死温度比较
不同种源的西北小檗均适应了当地的环境,高海拔地区的种源对低温、强辐射和高温差等极端的环境条件适应性较强,低海拔地区的种源较能适应温和的生长条件。不同种源的西北小檗枝条在应对初期低温条件时,细胞质膜还能通过主动运输进行物质交换,随着低温加剧,细胞结构受到严重影响,质膜被低温破坏,主动运输功能完全丧失,同时,低温造成离子活性下降,致使电导率值下降,随着温度降低,将使细胞遭受到不可逆的致死性伤害。在整个过程中,细胞逐渐经历的是一个从可逆到不可逆伤害的发展过程。玉树市下拉秀乡种源的西北小檗幼苗枝条的半致死温度要低于西宁市大通县和海东市乐都区种源,说明玉树市下拉秀乡种源的西北小檗对低温的耐受性较强,在高海拔环境的生长进化过程中已经形成了一套能适应较为恶劣的生态环境的生理体系。
3.2 低温胁迫条件下,不同种源西北小檗可溶性糖和可溶性蛋白含量的比较
3处种源的西北小檗幼苗叶片的可溶性糖和可溶性蛋白含量在低温胁迫过程中都呈现先增高再降低的趋势,并在4 ℃条件下均达到最大值,其中高海拔玉树市下拉秀乡种源的可溶性糖和可溶性蛋白含量均高于其他两处种源。在低温条件下,可溶性糖含量的增加能提高细胞渗透浓度,以增加细胞的保水能力,降低其凝固点,从而提高植物抗寒性[19];可溶性蛋白含量的增加,可能是通过提高质膜中蛋白质之间的亲和力,以增强膜结构在冰融过程中的稳定性,从而提高其对低温条件的适应能力。在低温胁迫初期,植物主要依赖细胞内可溶性糖含量的增加,随着胁迫程度加剧,则可能主要是依靠细胞内蛋白含量的变化来提高其适应性[20]。因此,高海拔种源的西北小檗叶片能通过增加体内可溶性糖和可溶性蛋白的含量来适应低温条件,高海拔种源的西北小檗比低海拔种源更能适应低温环境。
3.3 低温胁迫条件下,不同种源西北小檗的MDA含量比较
西北小檗在青海省的自然分布海拔为2 300~4 000 m[4],高海拔地区的种源较能适应强辐射、低温的恶劣环境;低海拔种源的植物在进化过程中对恶劣环境的敏感度较高,但适应能力较差。玉树市下拉秀乡种源的西北小檗由于分布海拔较高,生长期的月均气温较其他两处种源低,在长期的自然选择下,其可能已形成了对极端环境条件的结构型性状和功能型性状的适应性,在低温、强辐射和高温差的条件下,细胞膜系统的敏感性及稳定性较强,因此,该处种源的幼苗叶片在16 ℃条件下的MDA含量较其他种源高。中、低海拔两处种源所处的环境条件较好,生长期的月均气温较高,在生长过程中遇到极端条件的频率较少,细胞膜系统对低温条件的反应较剧烈,且稳定性较差,在低温胁迫加剧的过程中,西宁市大通县和海东市乐都区种源的幼苗叶片较易受到低温的伤害,因此,MDA的增加量显著高于玉树市下拉秀乡种源,且低海拔的海东市乐都区种源的增加量要高于中海拔的西宁市大通县种源。同时也说明,高海拔处的玉树市下拉秀乡种源叶片细胞膜系统对低温条件的抵御能力要强于低海拔种源,其叶片膜质过氧化作用强度及质膜受损伤程度要低于低海拔种源,对低温的适应能力则表现出高海拔种源强于低海拔种源。
3.4 低温胁迫条件下,不同种源西北小檗保护酶活性的比较
在一定的低温范围内,保护酶活性的增加能有利于植物体内自由基的产生和清除之间的平衡,来减轻膜质过氧化对细胞造成的伤害。SOD作为保护酶系统的第一道防线,能将毒性较强的O2-歧化为毒性较弱的H2O2,而CAT与POD协同作用,则将H2O2转化为H2O和O2,彻底清除活性氧对植物细胞的损害[21-22]。3处种源的西北小檗幼苗在低温胁迫过程中,随着温度的降低,其各类保护酶活性总体上呈现出增加的趋势,以提高组织的抗寒性,降温至一定范围时,细胞膜受到严重伤害,酶的活性开始下降[23]。其中高海拔玉树市下拉秀乡种源3种保护酶活性的变化趋势与西宁市大通县和海东市乐都区存在较大不同,在16 ℃和12 ℃低于低海拔的两处种源,随着温度降低,在12~4 ℃,增加量远高于其他两处种源,在0 ℃达到最高值,且均高于其他两处种源。说明玉树市下拉秀乡种源的西北小檗由于长期生长在高海拔地区,其植物体细胞内对由于逆境产生的活性氧伤害的反应较低海拔种源更为敏感,能在一定温度范围内迅速提高体内保护酶的活性,以应对逆境对细胞的伤害,来维持细胞体内活性氧代谢的平衡状态。植物在应对外界逆境条件时,叶片是最能反应植物与环境的适应关系的部位,其中细胞膜系统是感受低温胁迫最敏感的部位,也是植物受低温伤害和抵抗低温伤害的关键结构[24]。在低温胁迫初期,细胞膜首先感受到低温条件,随着低温的加剧,质膜受损伤的程度也逐渐加剧,MDA的含量增加,高海拔玉树市下拉秀乡种源的增加量最少,低海拔海东市乐都区种源的增加量最多。同时,叶肉细胞通过调整体内的渗透调节物质的含量和保护酶活性的变化以抵御低温胁迫的伤害,由于不同种源的植物对逆境生理的反应能力不同,高海拔种源的渗透调节物质的含量及保护酶活性的增加量要高于低海拔种源,表现出高海拔种源西北小檗具有较强的低温耐受能力。
通过对玉树市下拉秀乡种源、西宁市大通县种源和海东市乐都区种源150 d生长期的西北小檗枝条和叶片分别进行低温半致死试验和低温胁迫试验,分别得到3处种源的枝条半致死温度,由低到高分别为玉树市下拉秀乡-21.55 ℃、西宁市大通县-16.83 ℃、海东市乐都区-15.78 ℃。同时,也得到了高海拔玉树市下拉秀乡种源的低温胁迫生理指标要优于低海拔的海东市乐都区和西宁市大通县种源的结论,其主要原因可能是高海拔种源在长期生长进化过程中已经形成了应对低温逆境的适应体系。本研究能够从一定层面反映出玉树市下拉秀乡、西宁市大通县和海东市乐都区三处西北小檗种源的抗寒性强弱,可为西北小檗耐寒种质资源的筛选、耐寒基因的挖掘以及青海高原三江源地区高海拔城镇绿化树种种源地的选择和植物资源的开发利用提供一定的理论依据。

