血脑屏障上有机阴离子转运多肽的表达、分子调控及其介导的药物转运
王敏,胡冰莹,孙莹莹,韦阳(杭州医学院,浙江省神经精神疾病药物研究重点实验室,杭州 310013)
血液和中枢神经系统(central nervous system,CNS)之间形成了三大屏障,即血脑屏障(blood-brain barrier,BBB)、血脑脊液屏障和蛛网膜屏障,这些屏障为维持CNS的稳态提供了高度可控的微环境。构成BBB结构基础的微血管内皮细胞(microvascular endothelial cells,MVECs)是介导血液-CNS之间物质交换的主要场所,MVECs之间存在紧密连接,限制了离子和其他小的亲水性溶质通过细胞间隙(细胞旁途径),因此,脑内所需的一些营养分子包括氨基酸、一元羧酸、有机阳离子、己糖、核苷和肽等需要通过跨膜转运途径穿过BBB[1],而相关转运蛋白的缺乏以及内皮细胞囊泡含量低等因素则形成了一种“运输屏障”。
由于BBB在很大程度上限制了药物向CNS的转运,导致很多CNS疾病治疗效果不佳甚至无效。因此越来越多的研究人员开始关注如何提高脑内病灶部位的有效药物浓度,改善药物的治疗效果。在大脑皮层,药物的外排由三磷酸腺苷结合盒转运蛋白(ATP binding-cassette,ABC)的成员介导[2],参与药物摄取的转运蛋白则属于溶质转运蛋白(solute carrier,SLC)家族[3]。BBB上的ABC超家族[如P-糖蛋白(P-glycoprotein,P-gp)]或SLC家族(如有机阴离子转运多肽)转运体是改善药物向大脑输送的重要靶点。值得注意的是,一些针对P-gp的小分子抑制剂的临床试验由于抑制剂本身的毒性或者脑内非病灶组织对外源药物的渗透性增强而产生严重的不良反应而失败。为此,越来越多的人开始关注内源性表达的SLC转运体。
有机阴离子转运多肽(organic anion transport polypeptides,OATPs/Oatps),作为SLC超家族的一个重要成员,可通过钠离子非依赖性转运系统介导大量的两亲性化合物(包括多种药物)的跨膜转运。有研究证明,OATPs/Oatps可作为CNS药物传递的潜在靶点,其底物如他汀类药物,在缺氧、炎症性疾病以及多发性硬化症中具有较好的神经保护作用[4]。同时OATPs/Oatps还可介导阿片类镇痛药(如deltorphin Ⅱ和DPDPE等)的血脑转运,从而治疗疼痛和脑缺氧[5]。本文旨在探讨OATPs/Oatps在BBB上的定位、功能表达、分子调控机制及其介导的药物转运过程,以期为CNS疾病的临床药物治疗提供新的思路。
1 血脑屏障
BBB由排列在脑微血管的内皮细胞及其间的紧密连接构成,包括基底膜、星形胶质细胞、周细胞和神经元在内的“神经血管单位”(neurovascular unit,NVU)也参与了其形成。脑微血管内皮细胞外有一层连续不断的基底膜,基底膜外又被星形胶质细胞终足围绕形成的胶质膜所包围,而周细胞是嵌入到微血管基底膜中的血管壁细胞,多层膜性结构共同形成了大脑的保护性屏障(见图1)。

图1 血脑屏障[9]Fig 1 Blood-brain barrier[9]
越来越多的研究表明,CNS疾病可能与BBB的功能障碍有关,包括一些神经退行性疾病[如阿尔茨海默病(Alzheimer disease,AD)和帕金森病]和与炎症相关的脑部疾病(如感染、中风、血管性痴呆和多发性硬化症)等[6-8]。
2 有机阴离子转运多肽
OATPs/Oatps由溶质载体有机阴离子转运蛋白家族成员基因(solute carrier organic anion transporter family member,SLCO/slco)编码,目前人体内发现的OATP包括6个家族(OATP1~6)、12个亚型(OATP1A2、OATP1B1、OATP1B3、OATP1B7、OATP1C1、OATP2A1、OATP2B1、OATP3A1、OATP4A1、OATP4C1、OATP5A1、OATP6A1),关于基因SLCO1B7和转运体OATP1B7的信息几乎没有文献报道,OATP1B3-1B7(LST-3TM12)是最近发现的OATP1B家族的新成员,该功能转运体是由SLCO1B3和SLCO1B7的剪接变异体共同编码的产物,定位于肝微粒体滑面内质网上,其底物包括硫酸脱氢表雄酮(DHEAS)和estradiol-17β-D-glucuronide等[10]。OATPs在人体组织中广泛分布,但有些亚型广泛表达,有些亚型选择性表达在某个部位,在细胞内稳态的维持和药物的处置方面发挥着重要作用。
2.1 OATPs/Oatps在BBB的定位与表达
为了进一步优化转运体介导的脑靶向递药系统,了解OATPs/Oatps在BBB的定位和功能表达至关重要,人OATPs和啮齿动物Oatps在基因和蛋白质表达以及底物谱方面存在明显不同。
定位于BBB的OATPs包括OATP1A2、OATP1C1、OATP2B1和OATP2A1。OATP1A2是第一个被鉴定且被证实在BBB中大量表达的OATP亚型,最初在人脑微血管和毛细血管内皮细胞的顶端发现[11-12],后来证实,在肿瘤和邻近的健康组织中也有表达[13],通过观察大脑皮质、小脑和海马体的石蜡切片,发现OATP1A2也定位于神经元和神经元突起[14-15]。相对于其他组织,大脑中 OATP1A2 mRNA的表达水平更高,并且与OATP2B1和P-gp相比,全脑组织裂解液中OATP1A2蛋白丰度更高[14,16]。与OATP1A2相比,OATP2B1的定位似乎仅局限于脑毛细血管的内皮细胞的管腔膜侧。OATP1C1是BBB处甲状腺激素(thyroid hormones,THs)的高亲和力双向转运体,研究发现OATP1C1分布在放射状胶质细胞、脑屏障、Cajal-Retzius细胞、脑干的迁移纤维以及一些具有特殊和复杂时空模式的神经元和胶质细胞中[17]。OATP1C1在BBB中的表达具有明显的物种差异性,在大鼠和小鼠的微血管内皮细胞上高度富集,而在人脑微血管内皮细胞上表达量甚微。除此之外,OATP1C1还定位在脉络层上皮细胞的基底侧[18]。OATP2A1,也被称为甲状腺素转运体,在全身组织包括大脑中广泛表达,目前已在脑额回神经元中检测到其蛋白水平的表达,但其在BBB中的具体定位尚不清楚。
啮齿类动物BBB中主要表达3种Oatp亚型:Oatp1c1、Oatp2a1和Oatp1a4[19-21]。Admati等[21]通过Oatp1c1 mRNA探针和抗-EGFP抗体对转基因鱼进行了双ISH/免疫组化,发现Oatp1c1在BBB的微血管内皮细胞的顶端和基底侧均有表达,同时也定位在特定脑区的神经元和星形胶质细胞。Kis等[22]研究表明,Oatp2a1定位在脑内皮细胞的管腔膜侧,其在BBB内皮细胞中的表达量低于其在星形胶质细胞、周细胞和脉络层上皮细胞中的表达。Oatp1a4是人OATP1A2在BBB上的功能性同源物,但与OATP1A2不同,Oapt1a4定位于BBB微血管内皮细胞的顶端和基底外侧膜[23],这意味着它可能还充当着外排转运体的功能[13,23]详见表1和图2。
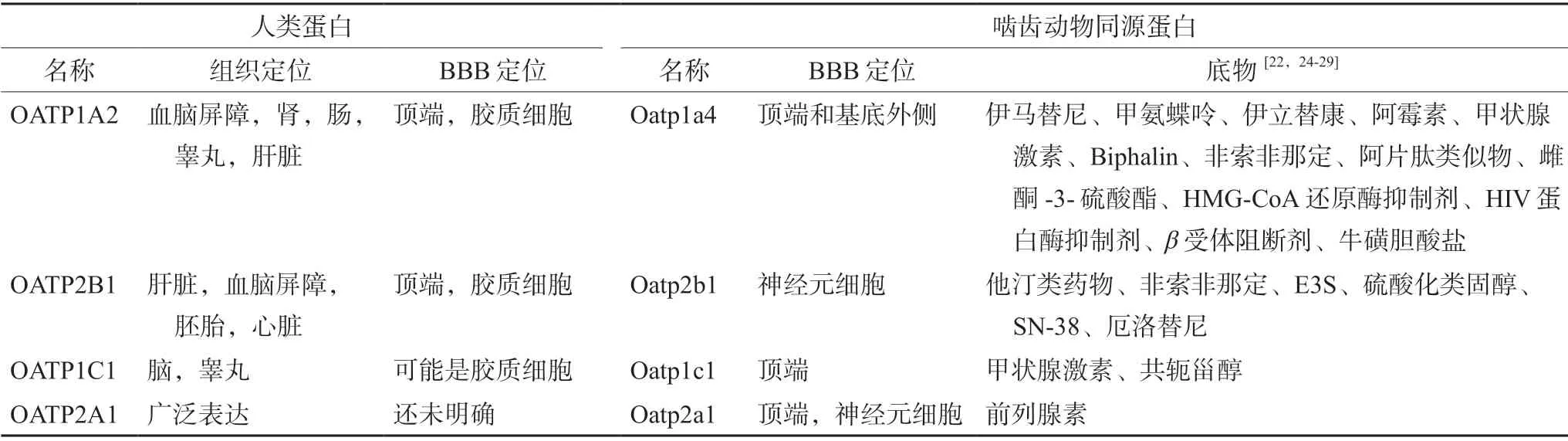
表1 OATPs/Oatps在BBB的定位及其底物Tab 1 Localization and substrates of OATPs/Oatps at the BBB
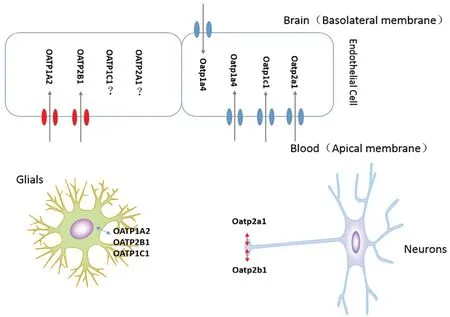
图2 OATPs/Oatps在BBB的定位Fig 2 Localization of OATPs/Oatps at the BBB
2.2 OATPs/Oatps的分子调控
要实现将OATPs/Oatps转运体作为增强CNS药物传递载体的目标,需要对其分子调控机制进行深入了解。遗传多态性、翻译和翻译后调控以及与诱导剂或抑制剂的相互作用都有可能导致OATPs转运功能的改变。
2.2.1 OATP1A2和Oatp1a4 近年来,有关OATP1A2分子调控的研究越来越多,其启动子中含有一个PXR反应元件,可通过与PXR结合,促进SLCO1A2的转录和翻译[30]。位于SLCO1A2转录起始位点上游-1836~-1845 bp处有一个核因子-κB(nuclear factor-κB,NFκB)的可能结合位点,并且肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)可通过NFκB的负性调控进而抑制SLCO1A2的转录[31]。OATP1A2的翻译后过程受到一组激酶,包括蛋白激酶C(protein kinase C,PKC)、酪蛋白激酶2(casein kinase 2,CK2)和AMP依赖的蛋白激酶(5'-AMP-activated protein kinase,AMPK)的复杂调控,PKC通过网格蛋白依赖性途径介导蛋白内化来调节OATP1A2的转运功能[32],CK2通过调节其在质膜上的定位,在优化OATP1A2功能中起着关键作用[33],而AMPK则可调控OATP1A2的亚细胞定位和蛋白稳定性[34]。PDZ蛋白,特别是盘状同源区域蛋白1(PDZ domain containing 1,PDZK1)和钠氢交换调控因子1(Na+/H+exchanger regulatory factor 1,NHERF1),通过与OATP1A2 C端的PDZ结合域直接相互作用激活OATP1A2功能[35]。
OATP1A2的转运活性还受pH值的影响,在pH 6.0条件下,OATP1A2介导的0.3 mmol·L-1雌酮3-硫酸盐的摄取率比在pH 7.4时高6.6倍[36]。缺血和再灌注对OATP1的表达和功能也具有调节作用,细胞暴露于糖氧剥夺条件2 h后,OATP1的表达显著增加[37]。Thompson等[38]也发现在缺氧1 h后的30 min复氧期间,大鼠体内Oatp1a4的表达增加,而在较长的复氧过程中,Oatp1a4的表达却降低,因此研究缺血再灌注过程中OATP1表达的分子调节机制具有重要的意义。
已有研究证实TGF-β/ALK1信号激动剂BMP-9可增强大鼠脑微血管中Oatp1a4的功能性表达,而高选择性ALK5抑制剂SB431542也可促进Oatp1a4介导的转运过程,这表明Oatp1a4转运功能可由通过ALK1和ALK5跨膜受体介导的TGF-β信号转导调节[24,39]。
2.2.2 OATP2B1 Pomari等[40]研究表明,驱动SLCO2B1转录的启动子具有组织特异性。不同的启动子启动不同SLCO2B1转录本的表达。这些OATP2B1变体使用5个不同的第一外显子(1a,1b,1c,1d和1e)和相关的启动子,但共享后续的外显子(外显子2~14)。通过分析SLCO2B1的启动子区域,发现5'侧翼区域包含一个顺式作用元件GC盒,它可与转录因子Sp1结合并控制来自肝脏和小肠的几种细胞系的SLCO2B1表达[41]。肝细胞核因子4-α(hepatocyte nuclear factor 4-alpha,HNF4α)可 与SLCO2B1-1e近 端启动子的某一区域结合激活其转录过程[42]。在HepaRG细胞中,MicroRNA-24的表达水平与OATP2B1 mRNA、蛋白质和HNF4αmRNA的表达水平呈负相关,这表明MicroRNA-24不仅抑制OATP2B1的翻译过程,而且可通过降解HNF4αmRNA抑制OATP2B1的转录过程[43]。抑瘤素M(OSM)是白细胞介素-6(IL-6)家族的一员,可以下调人肝细胞中OATP2B1的mRNA水平[44]。
除了特征明确的转录修饰外,翻译后修饰也会影响转运蛋白的定位和活性。OATP2B1的转运功能易受细胞外环IX-X半胱氨酸残基变化的影响[45],OATP2B1中共有6个色氨酸残基,即W272、W276、W277、W523、W611和W629,位于跨膜结构域11(transmembrane domain 6,TM11)的W611是影响OATP2B1转运功能的关键部位,而位于第三细胞外环和TM6交界处的W272、W276和W277对OATP2B1的转运功能也起到一定的影响[46]。OATP2B1的C端含有PDZ结合基序,PDZK1蛋白可通过与该区域结合调控其在细胞中的定位、表达和功能[47]。同源建模显示OATP2B1 TM1以及N端末端的TM2,4和5可能位于底物结合口袋内,对维持转运蛋白的摄取功能非常重要[48]。此外,第51位的苯丙氨酸(F51)似乎在OATP2B1的正确折叠中起着重要作用,因为F51的替代可能会导致转运蛋白的加速降解[48]。有研究表明OATP2B1可通过PKC介导的网格蛋白内在化,随后被胞内溶酶体靶向降解[49]。
2.3 OATPs/Oatps介导的CNS药物转运
2.3.1 抗AD药 目前普遍认为AD患者一个特征性的病理改变是β-淀粉样蛋白(Aβ)在大脑中不断积累。有研究表明,作为Oatp1a4底物的瑞舒伐他汀和牛磺胆酸盐可通过原位脑灌注降低小鼠大脑中的Aβ水平[50]。随着病情的加重,AD大鼠脑毛细血管中的Oatp1a4的表达量呈下降趋势[51],这在一定程度上影响了相关底物药物进入脑内病灶区发挥作用。
2.3.2 治疗缺血性脑中风的药物 阿片肽Biphalin在缺血性脑中风时可提供神经保护作用,他汀类药物与中风后早期的神经功能改善相关,而OATP1A2和Oatp1a4可介导阿片肽Biphalin和他汀类药物在BBB的转运过程,并且缺血再灌注期间OATP1表达的增加可以改善阿片肽Biphalin或其他与OATP1有亲和力的潜在脑缺血治疗药物的脑部运输[5,37-38]。
2.3.3 抗脑部肿瘤药 越来越多的证据表明,OATPs在各种类型的癌症中的表达会发生改变,在蛋白质水平上,OATP1A2和OATP2B1在形成BBB和血脑肿瘤屏障的内皮细胞的管腔膜以及胶质母细胞瘤细胞中均有表达,可介导一些化疗药物输送到肿瘤部位[13,52]。AZD1775是一种酪氨酸激酶Wee1的小分子抑制剂,是治疗胶质母细胞瘤的潜在化疗和放射增敏剂。在相对酸性的肿瘤微环境中,AZD1775主要通过OATP1A2介导的主动摄取过程进入脑肿瘤细胞[53]。越来越多的化疗药物被证明由OATP1A2和OATP2B1介导转运,OATP1A2介导甲氨蝶呤(MTX)的转运过程具有饱和性和pH依赖性,在细胞外酸性环境中,其转运速率可提高7倍[54]。除此之外,OATP1A2介导转运的化疗药物还包括伊立替康、阿霉素等,而SN-38(伊立替康的活性代谢产物)、厄洛替尼则由OATP2B1转运。
2.3.4 抗抑郁药 圣约翰草可用于治疗轻度抑郁症,金丝桃苷是圣约翰草的主要活性成分之一,通过激活核受体中的孕烷X受体(pregnane X receptor,PXR)从而增强CYP3A4的表达,在合并用药过程中可能引起严重的药物-药物或食物相互作用,限制了其临床使用。金丝桃苷作为OATP2B1的底物,可通过OATP2B1跨膜转运,因此OATP2B1可增加金丝桃苷的细胞摄取量,从而增强PXR的活化[55]。
2.3.5 抗癫痫药 在慢性癫痫大鼠的大脑中,Oatp1a4的蛋白水平显著降低,而mRNA水平不变,这表明慢性癫痫可能影响了Oatp1a4的转录后过程[56]。丙戊酸钠是临床上最常用的抗癫痫药,研究表明Oatp1a4参与了丙戊酸钠在血脑屏障处的转运,并且改变Oatp1a4的表达可能改善耐药癫痫患者对丙戊酸钠的耐药性[57]。
2.3.6 OATPs/Oatps的基因多态性对药物转运的影响 很多研究表明SLCO的基因多态性通过影响药物转运,从而显著改变其底物药物的药理和毒理反应。Angelini等[58]报道了接受伊马替尼治疗的189例慢性粒细胞白血病患者的主要反应与包括OATP1A2在内的几种SLC转运体的遗传变异之间存在显著关系。Zhou等[59]在一组受试者中鉴定了SLCO1A2的5个新的单核苷酸多态性(SNPs):G550A、G553A、G673A、A775C和G862A,它们分别编码OATP1A2变体E184K、D185N、V255I、T259P和D288N。通过HEK293细胞评估这些变体转运蛋白的功能,发现新的变异 体E184K、D185N、T259P和D288N对 底 物药物雌酮-3-硫酸酯、伊马替尼和MTX的转运量明显降低,仅为野生型的20%~50%。此外,SLCO1A2的遗传变异也可能是类风湿关节炎患者MTX毒性产生的危险因素。Wang等[60]用二元Logistic回归分析了SLCO1A2遗传变异与MTX毒性的关系,结果显示,550AA基因型与MTX毒性相关,并且H3(H3=AG)患者产生MTX毒性的风险较高。另一项体外研究也表明,相对于野生型,OAP1A2*3(A516C,E172D)和*6(A404T,N135I)变异体对3种测试底物即雌酮-3-硫酸酯、deltorphin Ⅱ和DPDPE的转运活性均显著降低[12]。
OATP2B1 rs2306168(1457C>T)是一种错义突变,与野生型相比,其转运活性降低50%。据报道,非索非那定在体内的消除受到OATP2B1 rs2306168的显著影响,具有C等位基因的受试者体内非索非那定曲线下面积(AUC)显著降低[61]。另一项研究表明,与野生型受试者相比,具有SLCO2B1c.* 396T>C变异体的受试者伏立康唑的口服吸收慢且生物利用度降低[62]。
这些数据表明SLCO1A2和SLCO2B1的基因多态性可能是药物处置和进入中枢神经系统的个体间变异性的一个重要的因素。因此,与OATP1A2和OATP2B1相关的遗传变异不仅会影响内源性和外源性化合物在外周器官(如肾脏、肠道)中的分布,还会改变向关键组织区室(如大脑)输送药物的程度,从而导致药物反应性的个体间差异。
3 总结与展望
自从Oatp基因被发现以来,有机阴离子转运多肽一直是研究者的关注点,人体相关的OATPs至今发现了12个亚型,其中OATP1B3-1B7尚未完全被确证。确认的11个OATP亚型影响着人体的生理功能,且在特定条件下可能成为疾病形成的关键因素。OATPs参与药物的转运,并有可能成为药物治疗的功能靶点。因此,对OATPs分布及功能的深入研究,对新药研发有重要的意义。
药物穿过BBB并在CNS内获得有效浓度的能力取决于多种转运机制。这些机制包括通过内流转运体进入大脑和由外排转运体介导的外流过程。笔者总结了定位于BBB的OATPs/Oatps的表达,分子调控及其介导的药物转运过程,这为优化神经系统疾病的药物治疗提供了新的靶点,包括TGF-β信号通路、核受体系统等。同时,发现细胞间信号通路存在复杂的相互作用,如ALK1和ALK5受体不仅参与调节Oatp1a4的转运活性,还与P-gp的功能调节有关[63],这些对于研究Oatp1a4和P-gp共同底物的转运具有重要意义。
此外,必须意识到,在BBB中高表达的OATPs/Oatps也定位在外周的其他器官,并且参与药物处置过程。例如,定位在肾小管上皮细胞顶端侧的OATP1A2参与底物药物的分泌[64],肝脏中表达的Oatp1a4则参与底物药物的代谢[65],因此,需重点关注OATPs/Oatps表达的组织差异性以及调控其表达的下游信号之间的分岔点,使得治疗CNS疾病的药物更少地在外周被代谢和分泌。目前,大部分研究只关注CNS疾病发生和发展过程中BBB处药物转运体的改变,却忽略了外周器官如肝脏、肾脏和小肠等部位关键药物转运体以及代谢酶的变化。有研究表明,在AD小鼠肾脏中,多药耐药相关蛋白2(MDR2)、OAT3和OCT2的蛋白表达分别上调1.6、1.3和1.4倍[66],这些改变可能会影响药物在外周的吸收、分布、代谢和排泄过程,最终影响进入CNS的有效药物浓度。
在大脑发育过程中,转运体蛋白的含量也在不断变化,如在脑毛细血管发育过程中Oatp1c1蛋白表达的上坡型变化可能满足了大脑正常发育对足够甲状腺激素的需求[67]。此外性别也可能会影响转运体的表达,与雄性大鼠相比,雌性大鼠脑微血管Slco1a4mRNA和Oatp1a4蛋白表达增加,但在青春期前大鼠中未观察到脑微血管Oatp1a4表达的性别差异性[68]。最后,转运体介导药物的转运存在立体选择性,一项临床研究表明,单剂量摄入苹果汁(含一种OATP2B1的有效抑制剂),可使其底物药物非索非那定AUC0~24(R构型)/AUC0~24(S构型)从1.49增加到2.00[69]。因此,未来在CNS疾病的治疗过程中,必须充分考虑到相关的生物变量,包括患者的年龄、性别和手性药物转运中的立体选择性等,这有助于最大限度地发挥药物的治疗效果。

