用于肿瘤光热治疗的吲哚菁绿纳米粒的构建与评价
陈宁,黄权华,李婷,李平飞,于红,皮玲琳,杨星钢,杨战鏖*(. 深圳华润九新药业有限公司,广东 深圳 58000;. 沈阳药科大学药学院,沈阳 006)
近年来,光热治疗(photothermal therapy,PTT)因肿瘤选择性强,不良反应少而被广泛研究[1-3]。PTT作为一种非侵入性的治疗方法,可用于高龄或同时患有其他疾病的患者,提高患者的顺应性[4];此外,PTT具有不良反应少、高度特异性、不易产生多药耐药性、可重复治疗等优点[5-6]。
PTT的重点就在于选择合适的光热材料。吲哚菁绿(indocyanine green,ICG)作为近红外有特征吸收峰的有机三碳花菁染料,具有较高的光热转换率[7],且升温迅速,ICG在激光照射下可迅速升温并杀死肿瘤细胞[8-9]。然而,ICG的临床应用也存在致命的缺陷,其体内半衰期t1/2仅有2~4 min,且极易与血浆白蛋白结合,从体内消除,组织透过性差[10]。在水溶液及生理条件下浓度越高越容易发生自聚集,从而导致荧光猝灭失去光学活性[11-12]。
为克服上述问题,通常将ICG搭载在载体上,以提高其稳定性,延长血液循环半衰期,提高其肿瘤蓄积率,进一步增加PTT的疗效[13-15]。因此,本实验选择目前应用比较广泛、生物相容性较好的两性聚电解质O-羧甲基壳聚糖(O-CMCS)和聚阳离子载体聚乙烯亚胺(PEI)为载体,采用安全简便的聚电解质法制备ICG纳米粒,可在一定程度上提高其在生理条件下的稳定性,增强组织透过性和肿瘤蓄积,用于肿瘤的PTT。
1 材料
1.1 仪器
Zetasizer Nano粒度测定仪(英国Malvern公司);JEM1200EX透射电子显微镜(TEM日本电子株式会社);DF-101S集热式恒温磁力搅拌器(上海凌科实业发展有限责任公司);UV-8型紫外分光光度计(上海元析仪器有限公司);808 nm激光器(PSU-H-LED公司);红外热像仪(Optris公司);离心机(湖南赫西仪器装备有限公司);IX71倒置荧光显微镜(美国Olympus公司);SpectraMax®M3多功能酶标仪[美谷分子仪器(上海)有限公司];激光扫描共聚焦显微镜(Olympus公司)。
1.2 试药
吲哚菁绿(ICG,百灵威科技有限公司);O-CMCS(武汉大华伟业医药化工有限公司);PEI(广东翁江化学试剂有限公司);甲醇(色谱纯,山东禹王化学试剂厂);Sephadex G50(Pharmacia公司);RPMI1640培养基(Hyclone公司);胰蛋白酶(Sigma公司);胎牛血清(FBS,杭州四季青生物制品公司);四甲基偶氮唑盐(MTT,美 国Sigma-Aldrich公 司);DMSO(Biochemica Applichem公司);4%多聚甲醛、Hoeches 33258、溶酶体绿色荧光探针、抗荧光猝灭封片液(碧云天生物技术研究所)。
1.3 细胞瘤株及动物
MCF-7细胞(上海佛雷堡生物技术有限公司);小鼠腹水瘤细胞(S180,沈阳药科大学药理实验室)。SPF级雄性KM种小鼠(体质量20~25 g)。
2 方法与结果
2.1 载吲哚菁绿纳米粒的制备方法
取适量ICG甲醇溶液滴加至15 mg·mL-1PEI溶液中,室温避光搅拌10 min。室温条件下,1000 r·min-1搅拌,将10 mg·mL-1O-CMCS以1滴·s-1的速度缓慢地滴加至PEI反应液中,室温避光继续搅拌30 min,即得载药纳米粒。过0.22 μm滤膜,收集滤液于茶色西林瓶中,封口膜封好,4℃保存备用。
2.2 载吲哚菁绿纳米粒的粒径与电位、包封率与载药量及形态
采用Zetasizer Nano粒度测定仪于25℃散射角为90°的条件下测定载吲哚菁绿纳米粒的粒径、粒径分布及zeta电位,测得纳米粒粒径为(148.7±5.6)nm,PDI为(0.072±0.028),粒径分布图如图1所示,粒径分布窄,zeta电位为-(21.7±0.35)mV。采用JEM1200EX透射电子显微镜观察纳米粒形态学,结果如图2所示。采用葡聚糖凝胶微柱离心法测定纳米粒的包封率和载药量分别为(72.6±3.1)%、(1.5±0.8)%。
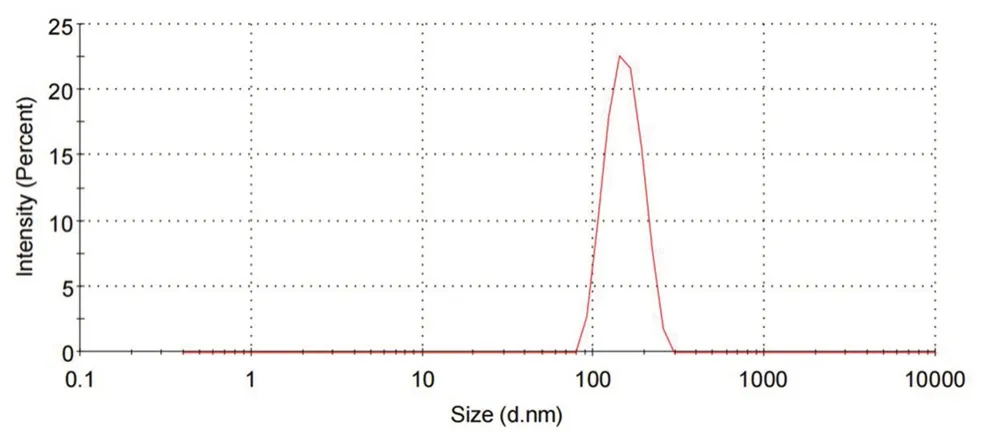
图1 ICG NPs粒径分布图Fig 1 Size distribution of ICG NPs

图2 ICG NPs透射电镜结果Fig 2 Transmission electron microscope of ICG NPs
2.3 光热效能
光热转化效率是评价光热剂性能的重要指标,良好的光热剂在激光照射下,应在一定时间内迅速升至肿瘤组织敏感的温度并保持一定时间,从而有效地杀死肿瘤细胞[16]。考察不同功率(1、2 W·cm-2)808 nm激光照射下不同质量浓度ICG(5、10、20、30、40 μg·mL-1)和ICG NPs(5、10、20、30、40 μg·mL-1)对光热转化效率的影响,记录时间-温度变化曲线,结果见图3,其Tmax光热图像见图4。
由图3和图4可知,pH 7.4的PBS在不同功率的激光照射10 min内,温度基本没有变化,这表明激光照射不能引起PBS的升温,可排除干扰;不同浓度的游离ICG与ICG NPs在不同功率激光照射下温度均先升高至Tmax后下降,5 min内可升高至Tmax,且药物浓度越高Tmax越高,因此在后续实验中照射时间选择为5 min;功率2 W·cm-2照射下的Tmax比1 W·cm-2相同浓度的ICG均有明显升高,因此在后续实验中选择2 W·cm-2照射;在相同功率的激光照射下,相同的药物浓度下,ICG NPs的升温要高于游离的ICG,浓度在5~40 μg·mL-1,∆T随浓度的增加先增加后下降,这可能是因为ICG浓度过大,纳米粒对ICG的分散减小,ICG因为分子聚集发生荧光猝灭,影响光热效能;2 W·cm-2照射下ICG NPs升温到Tmax所用时间明显短于游离的ICG,这表明纳米粒的包载提高了ICG的光学稳定性和光热转化效率。
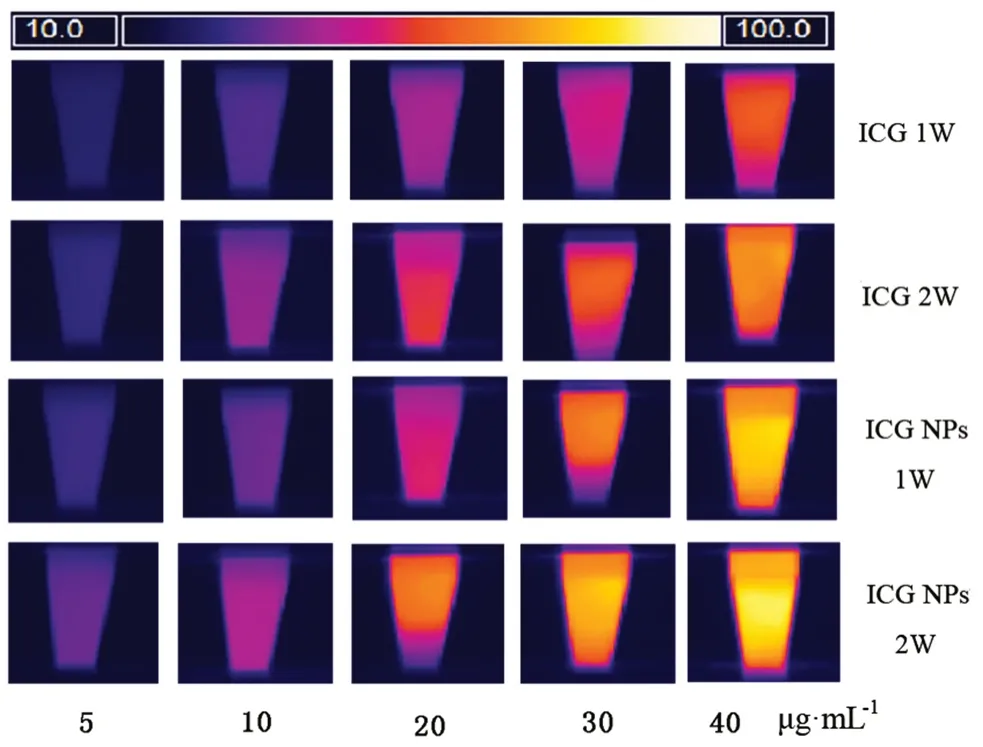
图4 不同浓度ICG和ICG NPs在不同功率808 nm激光照射下的Tmax光热图像Fig 4 Tmax of ICG and ICG NPs at different concentrations under different power 808 nm laser irradiations
2.4 MTT法测定细胞毒性
取对数生长期的MCF-7细胞,消化稀释成浓度为1×104个·mL-1的单细胞混悬液,取100 μL接种于96孔培养板中,置于培养箱(5% CO2,37℃)中培养24 h。待细胞完全贴壁后,吸去孔内培养液,加入200 μL不同质量浓度(1、5、10、20 μg·mL-1)的游离ICG、blank-NPs、ICG-NPs(0.22 μm无菌微孔滤膜过滤除菌)的培养液溶液。同时设置对照组(加细胞和培养液而不加药物)和空白组(只加培养液),每个浓度设置6个复孔。激光实验组在加药2 h后用近红外激光(808 nm,2 W·cm-2,10 cm)照射5 min;无激光对照组不给予照射,放入培养箱分别继续孵育24 h和48 h后,避光条件下每孔加入20 μL MTT溶液(5 mg·mL-1),继续培养4 h。每孔各加入150 μL DMSO,振荡使紫色结晶物完全溶解,用酶标仪测定各孔在490 nm波长下的吸光度(OD值)。按照Eq.1公式计算细胞存活率。

由图5可知,在无激光照射的条件下,空白纳米粒组在本实验考察的时间和浓度范围内,MCF-7细胞的存活率均>85%,这说明由O-CMCS与PEI构建的空白纳米粒具有良好的生物安全性,不会影响后续载药纳米粒对MCF-7细胞的毒性评价。不同质量浓度的游离ICG溶液与ICG纳米粒(1、5、10、20 μg·mL-1)在无激光照射的条件下与空白纳米粒组相比,随着ICG质量浓度的增大及孵育时间的增长MCF-7细胞存活率略减小,但在质量浓度为20 μg·mL-1、孵育时间为48 h,细胞存活率仍>75%,这说明无激光照射时游离的ICG溶液与ICG纳米粒均对MCF-7细胞无抑制生长的作用,无细胞毒性,生物安全性良好。
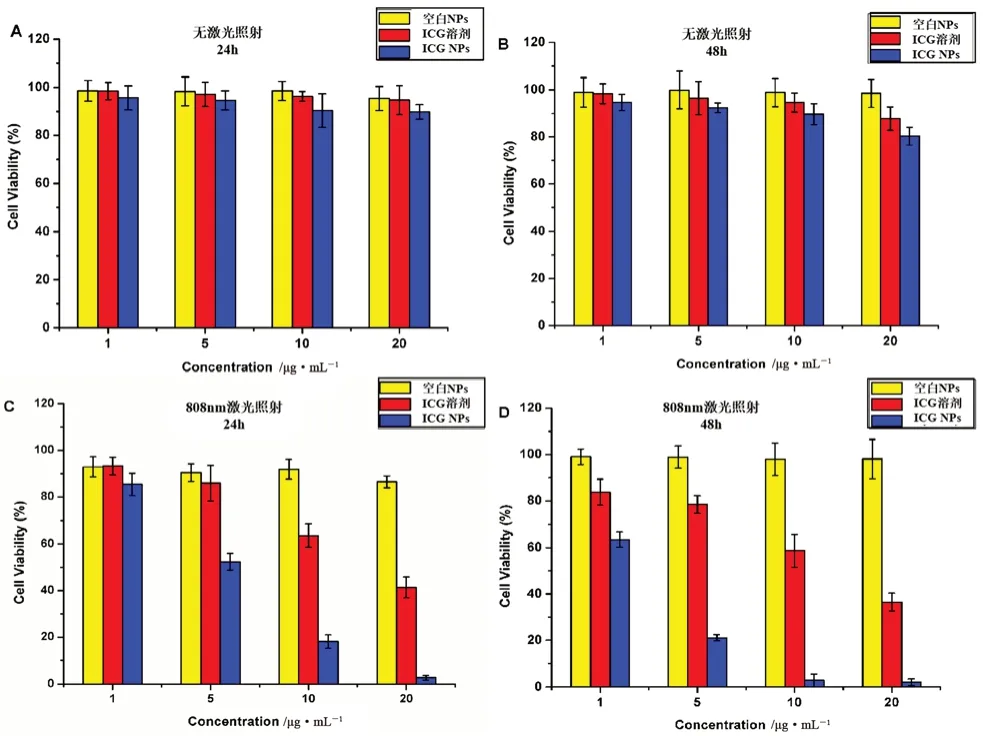
图5 空白NPs、ICG溶剂和ICG NPs对MCF-7细胞活力的影响Fig 5 Cell viability of NPs,ICG solvent,and ICG NPs incubation
在2 W·cm-2,808 nm激光照射5 min的条件下,各空白纳米粒组在本实验考察的时间和浓度范围内,MCF-7细胞的存活率均>85%,这说明在没有ICG存在的条件下,单纯的体外激光照射不会抑制MCF-7细胞的生长。在808 nm激光照射的条件下,当ICG从1 μg·mL-1增加到20 μg·mL-1时,MCF-7细胞孵育24 h的存活率从93.3%降到41.39%,孵育48 h的存活率从83.7%降到36.5%,这表明激光照射ICG产生的光热作用可有效地杀死MCF-7细胞,随着ICG质量浓度的增大,细胞存活率明显降低,细胞毒性显著增大,但对比孵育24 h与48 h细胞存活率没有明显不同,这表明ICG的光热治疗具有明显的浓度依赖性但无明显的时间依赖性。不同浓度下ICG NPs的细胞生长抑制作用均大于游离ICG,这表明将ICG包载于O-CMCS/PEI纳米粒中能够显著提高药物的细胞毒性,特别是在高浓度时差别大。
2.5 激光共聚焦观察溶酶体逃逸实验
MCF-7细胞,以2×105个·mL-1的浓度接种于6孔板中,置于5% CO2、37℃培养箱中培养24 h,当细胞生长密度达到80%,吸去培养液,PBS清洗3次,每孔加入2 mL含ICG、ICG NPs溶液的培养液(不含FBS)后继续孵育0.5、1、2和4 h 后,加入200 nL Lysotracker green 溶液(50 g·mL-1)继续孵育1 h,吸去上清液,多聚甲醛固定细胞30 min,PBS清 洗3次,用10 μg·mL-1的Hoechst 33258室温避光染细胞核10 min,移去染料,再用PBS清洗3次,取出细胞爬片反压在载玻片上,用封片剂封片,置于激光共聚焦显微镜下观察ICG纳米粒的溶酶体逃逸行为,结果见图6。
由图6可知,随着孵育时间的延长,黄色区域逐渐较少,而单独的红色和绿色区域逐渐变多,这说明随孵育时间的延长,逐渐地有红色荧光的ICG从溶酶体中逃逸到细胞质,这表明以O-CMCS/PEI制备的纳米粒具有明显的促进溶酶体逃逸的功能。
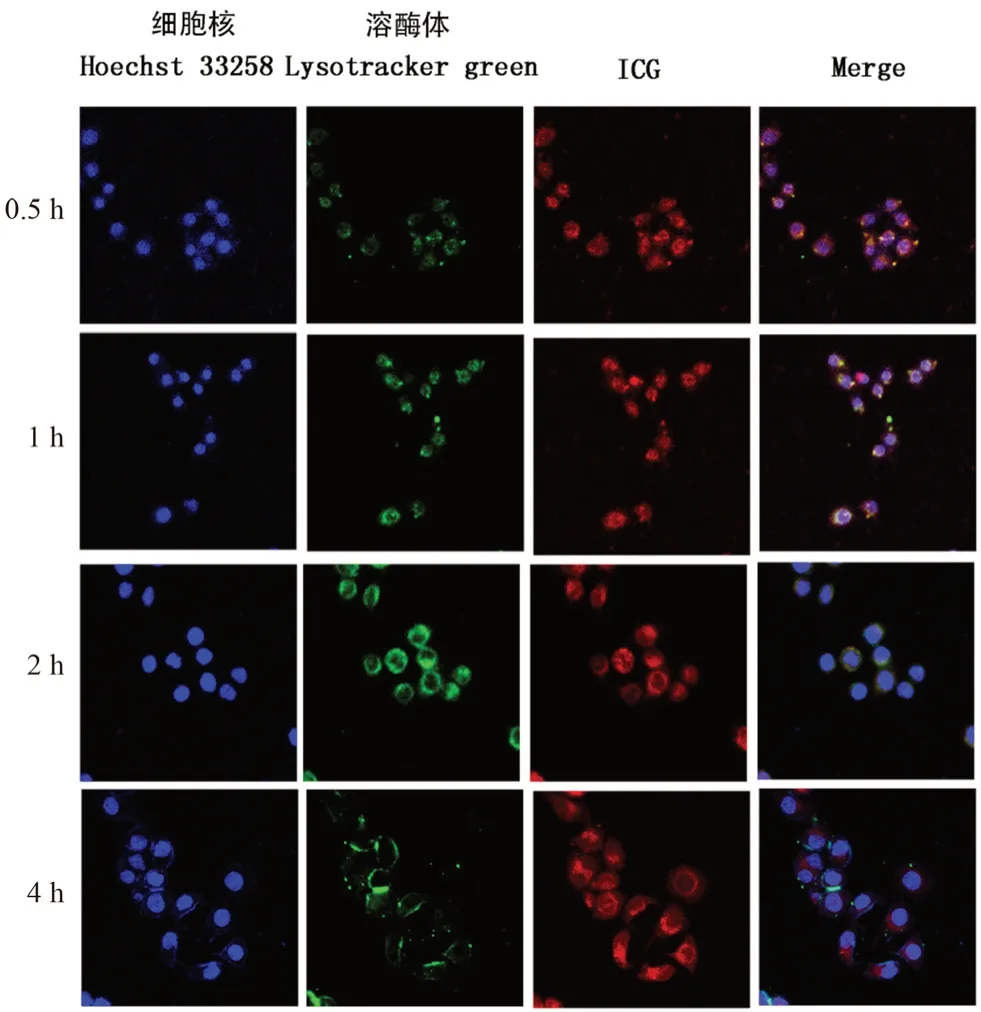
图6 MCF-7细胞中ICG NPs胞内溶酶体逃逸Fig 6 Intracellular lysosomal escape of ICG NPs in MCF-7 cells after incubation
2.6 药效学实验
2.6.1 溶血性实验 分别取8支EP管,首先进行编号,1号设为阳性对照组,2号设为阴性对照组,3~8号设为实验组,按表1于每管中加入2%红细胞悬液、生理盐水和纳米粒混悬液,纳米粒依次加入质量浓度为250、150、100、50、10、5 μg·mL-1。轻摇混匀后将EP管置于37℃恒温水浴中3 h,观察管中液体状态,若试管中的溶液呈澄明红色状且管底无细胞残留则为全部溶血;若溶液澄明呈红色或棕色且管底有少量红细胞残留则为部分溶血;若试管内上层液体无色透明所有红细胞都下沉则为无溶血。将EP管于3000 r·min-1离心5 min,吸取上清液,采用紫外分光光度法,于570 nm波长测定各组上清液的吸光度值。按照Eq.2计算溶血率。

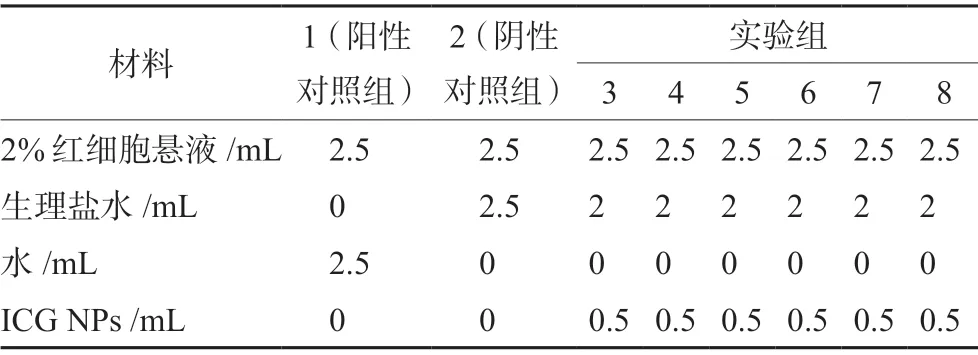
表1 ICG NPs溶血实验Tab 1 Hemolytic experiment of ICG NPs
ICG NPs的溶血性实验结果如图7所示,以生理盐水组为阴性对照组,可见0~3 h内不同浓度的实验组管均未见溶血现象。
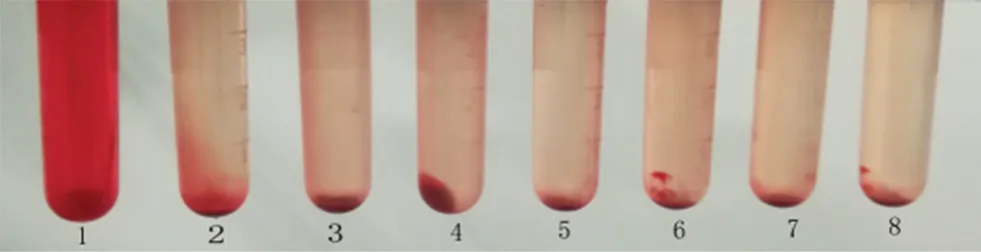
图7 ICG NPs溶血实验结果Fig 7 Hemolysis experiment for ICG NPs 1. 阳性对照组(positive control group);2. 阴性对照组(negative control group);3~8. 实验组(experimental group)
ICG NPs的溶血率如图8所示,3 h内不同浓度的ICG NPs的溶血率均小于5%,这表明ICG NPs注射液具有良好的血液相容性,可用于后续的药效学实验。
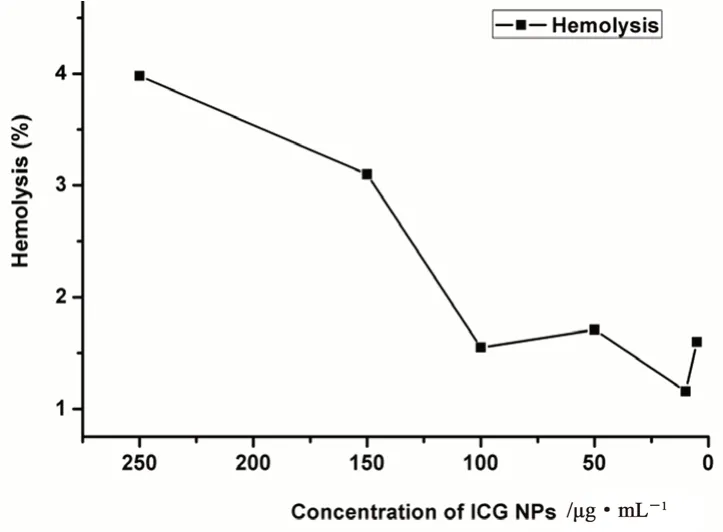
图8 不同浓度ICG NPs溶血率Fig 8 Hemolytic rate of ICG NPs at different concentration
2.6.2 荷瘤小鼠模型的建立 复苏S180细胞,用适量生理盐水稀释使细胞混悬液达到适宜浓度后接种于KM种小鼠腹腔内,每日观察,至小鼠腹部明显隆起时处死,局部消毒后,抽取腹水,活细胞计数后用生理盐水稀释至细胞浓度为有1×107个·mL-1的腹水稀释液,取0.2 mL腹水稀释液接种于小鼠右腋下的皮下组织内。建立荷瘤小鼠动物模型。
2.6.3 分组与给药 接种成功的荷瘤小鼠动物模型正常饲养7 d左右,当小鼠右腋下发现肉眼可见的肿瘤后,测量肿瘤体积大小,选取肿瘤体积约为150 mm3的荷瘤小鼠20只,随机分成4组,每组5只,进行编号。分别为生理盐水组、生理盐水+激光照射组、ICG NPs组、ICG NPs+激光照射组。分别于小鼠尾静脉注射相应的制剂,ICG的给药剂量为2 mg·kg-1,第一次给药记为第1日,分别在第1、4和7日各给药一次。其中激光组需要在给药2 h和4 h后用808 nm激光(10 cm,2 W·cm-2)照射肿瘤部位5 min,正常饲养小鼠。
2.6.4 药效学评价指标 给药后每日观察小鼠的精神和活动状态,每2日称量小鼠体质量,并记录;每2日用游标卡尺测量肿瘤的最长直径(L)和最短直径(S)大小,然后按公式Eq.3计算肿瘤体积(V):
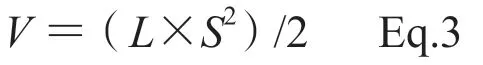
于给药后15 d脱颈处死小鼠,小心剥离肿瘤组织,用生理盐水清洗干净用滤纸擦干后称量瘤重,并记录。按Eq.4计算肿瘤抑制率(tumor inhibition rate,TIR):
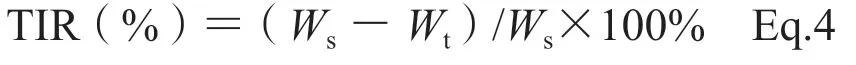
式中Ws为生理盐水对照组肿瘤的平均瘤质量,Wt为实验组肿瘤的平均瘤质量。
给药期间各组荷瘤小鼠的饮食与活动无明显变化,各组荷瘤小鼠的体质量随时间的变化见图9,各组荷瘤小鼠的体质量平稳增长,这说明激光照射与ICG NPs无明显的机体毒副作用,安全性良好。

图9 S180荷瘤小鼠给药15 d后体质量变化(n=5)Fig 9 Body mass changes of S180 tumor-bearing mice after the administered for 15 days(n=5)
给药期间记录各组荷瘤小鼠的肿瘤体积变化,如图10,生理盐水+激光照射组、ICG NPs组与生理盐水组之间无明显差异,其肿瘤体积均随时间的延长迅速增大,表明单独的激光照射以及ICG NPs在无激光照射下对肿瘤的生长没有抑制效果。而ICG NPs+激光照射组的肿瘤生长缓慢,第一次给药15 d后其平均肿瘤体积为386.64 mm3,这表明ICG NPs在808 nm激光照射下具有良好的肿瘤抑制活性。
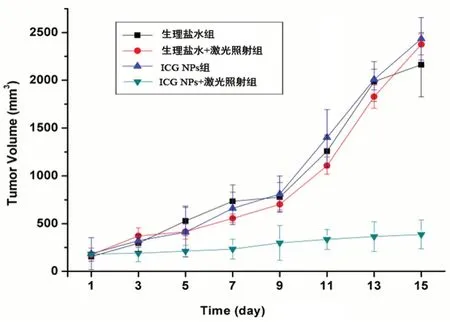
图10 S180荷瘤小鼠在给药15 d后肿瘤体积变化(n=5)Fig 10 Tumor volume changes of S180 tumor-bearing mice after the administered for 15 days(n=5)
给药15 d后,摘除荷瘤小鼠的肿瘤组织称重,并按Eq.4计算各组的抑瘤率(TIR),结果见图11、12。可知与生理盐水组比较,生理盐水+激光照射组与ICG NPs组肿瘤组织的平均质量无显著差别,TIR分别为8.7%、4.6%,ICG NPs+激光照射组抑瘤效果明显(为75.4%),与荷瘤小鼠肿瘤体积变化趋势大致相同,这表明仅激光照射或ICG NPs基本无明显的肿瘤抑制作用,而ICG NPs+激光照射组可有效的抑制肿瘤的生长。
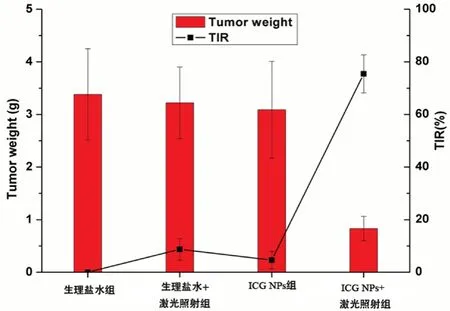
图11 S180荷瘤小鼠在给药15 d后肿瘤重量和肿瘤抑制率(n=5)Fig 11 Tumor weight and tumor inhibition rate of S180 tumor-bearing mice after the administered for 15 days(n=5)

图12 S180荷瘤小鼠在给药15 d后切除的肿瘤(n=5)Fig 12 Excised tumors of S180 tumor-bearing mice after the administered for 15 days(n=5)
3 讨论
本课题组选用生物可降解的在生理条件下负电荷两性高分子材料O-CMCS和PEI为载体材料,采用聚电解质复合法,制备了用于肿瘤的光热治疗包载近红外光热剂ICG纳米粒ICG NPs。在808 nm激光照射下,ICG NPs具有良好的光热转换效率,可明显抑制肿瘤生长。
通过激光共聚焦显微镜考察ICG NPs在MCF-7细胞中的摄取行为,结果表明ICG NPs与MCF-7细胞孵育4 h时可出现溶酶体逃逸现象。这主要是因为PEI作为聚阳离子聚合物,大量的伯胺及仲胺基团在内涵体或溶酶体的弱酸性环境中会捕获大量质子,与此同时也会引起大量的氯离子和水分子的内流进溶酶体中,导致溶酶体渗透性肿胀,从而使溶酶体破裂,药物渗漏,产生内涵体或溶酶体逃逸的现象,这就是“质子海绵”效应。
通过体外溶血实验考察了制剂静脉注射安全性,结果证明该制剂无体内溶血性,可用于静脉注射。在808 nm激光照射下ICG NPs具有良好的光热转换效率。在相同功率的激光照射下,相同的药物浓度下,ICG NPs的升温要高于游离的ICG,质量浓度在5~40 μg·mL-1,∆T随浓度的增加先增加后下降,这可能是因为ICG浓度过大,纳米粒对ICG的分散减小,ICG因为分子聚集发生荧光猝灭,影响光热效能;2 W·cm-2照射下ICG NPs升温到Tmax所用时间明显短于游离ICG,可能是纳米粒的包载阻碍了热量的扩散,使得局部温度短时间内快速上升并保持较长时间,这表明纳米粒的包载提高了ICG的光学稳定性和光热转化效率。

