蛋白质分选的共翻译转运途径*
方雪静 俞如旺
(福建师范大学生命科学学院 福建福州 350117)
核基因编码的蛋白质在胞质中游离的核糖体起始合成后,需要分选与转运到特定的功能位点,也称蛋白质寻靶(protein targeting)。其分选途径大致可分为2 条:①后翻译转运途径:蛋白质在胞质中完成翻译后才进行转运,线粒体、叶绿体及过氧化物酶体中的蛋白质多采用该途径进入细胞器;②共翻译转运途径:蛋白质先在游离的核糖体中合成一小段后,在信号肽的指导下边合成边转运到粗面内质网,经过加工最终分选到溶酶体、液泡等细胞结构,有的分泌至胞外。
人教版普通高中生物学必修1(2019 版)进一步明确了分泌蛋白的起始合成是在游离的核糖体上,通过共翻译转运途径分泌到细胞外,纠正了旧教材中的“最初是在内质网上的核糖体中由氨基酸合成肽链”。本文将详细阐述该途径。
1 共翻译转运机制的探究史
20世纪60年代,乔治·帕拉德(George Palade)发现细胞质中的游离核糖体产生非分泌蛋白,而附着在内质网上的核糖体则产生分泌蛋白。Palade 的学生冈特·布洛贝尔(Gūnter Blobel)认为产生该差异的原因不在于核糖体,而在于蛋白质自身[1]。他从分泌蛋白转入内质网的过程入手,对蛋白质的转运展开研究,并抓住了2 条线索:①成熟蛋白质的氨基酸序列总比初生蛋白质更短一些;②蛋白质的翻译和转入内质网的过程似乎是同步进行的。
1975年,Blobel 和戴维·萨巴蒂尼(David Sabatini)提出“信号假说”,认为分泌蛋白的内质网靶向性是由蛋白质N 端上的一个信号序列确定的。该信号序列被结合因子识别后,将指导部分合成的蛋白质及其核糖体到达内质网,后续的蛋白质合成将在内质网进行。受到Palade 研究的启发,Blobel 等设计了一种蛋白质的体外翻译—转运系统。该系统高度保守:编码分泌蛋白的人的mRNA、兔的核糖体、狗的内质网和酵母细胞膜的混合物可合成人蛋白,为信号假说提供了实验证据[2]。
1980年,Blobel 和Walter 发现了与信号序列相互作用的胞质核糖核蛋白颗粒,即信号识别颗粒(称为“SRP”),并证实其能介导新生肽—核糖体复合物与粗面内质网结合。随后近20年的时间,生物学家又相继发现了参与核糖体靶向内质网膜中特定的SRP 受体、通过共翻译去除信号肽的信号肽酶,以及内质网膜上的转运通道蛋白,使“信号假说”逐渐系统化[3]。Blobel 由此获得了1999年的诺贝尔生理学或医学奖。
2 指导共翻译转运的决定因素
共翻译转运过程是细胞内各种物质协调配合完成的,其中信号肽、信号识别颗粒及其受体、移位子是指导共翻译转运过程的主要决定因素。
2.1 信号肽(SP) 信号肽是携带初生蛋白质分选与转运信息的一段氨基酸序列,一般位于新生肽的N 端。其长度大概为15~30 个氨基酸残基,一级结构可分为3 个区域:信号肽的N 端、信号肽的C 端、中部的疏水核心区。信号肽的N 端是带正电荷的强极性区,其长度的差异是导致不同信号肽长度差异的主要原因。信号肽中部的疏水区由14~20 个中性氨基酸构成,可形成α 螺旋,是信号肽的主要功能区。研究表明,一旦疏水区的某个氨基酸被置换,该信号肽则失去了蛋白质的定位功能。信号肽的C 端是带负电荷的极性区,通常含有脯氨酸、甘氨酸,不易形成螺旋结构。此外,C 端某些不带电的小分子氨基酸决定了信号肽酶的作用位点[4]。
信号肽在不同的环境中有不同的构象,在水溶液中主要以β 折叠的形式存在,在脂质中则有形成α 螺旋的趋势,这对于信号肽与生物膜的相互作用有重要意义。近年来,对于信号肽的认识早已打破了Blobel 的“信号假说”中的内容——信号肽不一定位于初生蛋白质的N 端,也可能位于其中部或C 端。在完成蛋白质的转运后,信号肽也不一定被切除。此外,信号肽不仅与蛋白质的分选转运密切相关,一些初生蛋白质残基的化学修饰、蛋白质的降解也与信号肽紧密联系。
2.2 信号识别颗粒(SRP)及其受体(SR) 信号识别颗粒是一种核糖核蛋白颗粒,具有普遍的保守性。真核生物的SRP 由一个7S RNA 和6 种蛋白质组成[1]。SRP RNA 约有300 个核苷酸,能折叠成一定形态,构成6 种蛋白质的组装平台。这6 种蛋白质按分子质量命名为:SRP9/14、SRP19、SRP54、SRP68/72,其中SRP54 是一种GTP 酶。整个SRP可分为2 个结构域:S 结构域和Alu 结构域。S 结构域 由RNA 的中间部分、SRP68/72、SRP19、SRP54组成,主要功能是识别并结合信号肽,其中发挥结合功能的是SRP54;Alu 结构域由RNA 末端和SRP9/14 组成,其功能是在SRP 与信号肽结合后,阻断新生肽链的翻译[5]。
信号识别颗粒受体位于内质网膜上,可与信号识别颗粒特异性结合。哺乳动物的SR 由SRα 和SRβ2 种蛋白质组成,2 种都是GTP 酶。SRα 和SRP54 的部分结构域是同源物,在共翻译转运过程中可与SRP54 相互作用。SRβ 的跨膜结构域对SR功能是不可或缺的,在人的SR 中,处于GTP 结合状态的SRβ 协调信号肽从SPR54 释放,从而进入移位子通道。SRα 可在GTP 水解后与SRβ 分离[6]。
2.3 移位子(translocon) 移位子存在于内质网膜上,是核糖体与内质网膜相互作用的位点。普遍保守的蛋白质转运通道Sec61 复合体是移位子的功能核心。Sec61 复合体是一个异源三聚体复合物,由中央Sec61α 亚基和2 个较小的外周亚基Sec61β 和Sec61γ 组成。在原核生物中,该复合体称为SecY 复合体[7]。Sec61α 是最大的亚基,跨膜10 次。Sec61β 和Sec61γ 是单次跨膜蛋白,属于尾锚定蛋白家族。Sec61 复合体主要参与移位位点的三大功能,即它能形成一个蛋白质转运通道、识别功能信号序列、作为主要的核糖体受体[8]。
3 共翻译转运过程
将新生链运输到内质网,必需先找到正确的位置,即目标反应;其次,必需通过入口处的门,即移位反应[9]。其中,有些蛋白质进入内质网腔成为内质网中的驻留蛋白,或进一步加工再靶向其他细胞结构,有些蛋白质直接定位于内质网膜上成为膜整合蛋白。
3.1 进入内质网腔的蛋白 当信号肽从核糖体通道出口暴露时,SRP54 与信号肽的疏水核心结合,形成核糖体-新生链-SRP 复合物(RNC·SRP 复合物)。此时,SRP9/14 蛋白复合体阻断新生链的继续翻译。接着,RNC·SRP 复合物开始靶向内质网,在GTP调控的过程中与内质网膜上的受体SR 相互作用,至此完成目标反应。值得注意的是,GTP 与SRP和SR 的结合进一步强化了整个复合物与SR 的结合,但此过程仅是结合GTP,并不消耗GTP[1]。
在SRP 和SR 的相互作用下,核糖体和新生链都被转移到内质网膜上的Sec61 复合体上,此时翻译又重新启动。信号肽不仅有助于内质网靶向,还有助于Sec61 通道的完全开放。同时,Sec61复合体也结合正在翻译的核糖体,形成一个处于完全开放状态的水性多肽转运通道,新生链开始通过转运通道进入内质网腔[9]。位于内质网腔面的信号肽酶切去信号肽,蛋白质进行折叠加工。在GTP 水解供能的作用下,SRP 和SR 也解离并恢复到原来的状态准备下一轮反应(图1)。
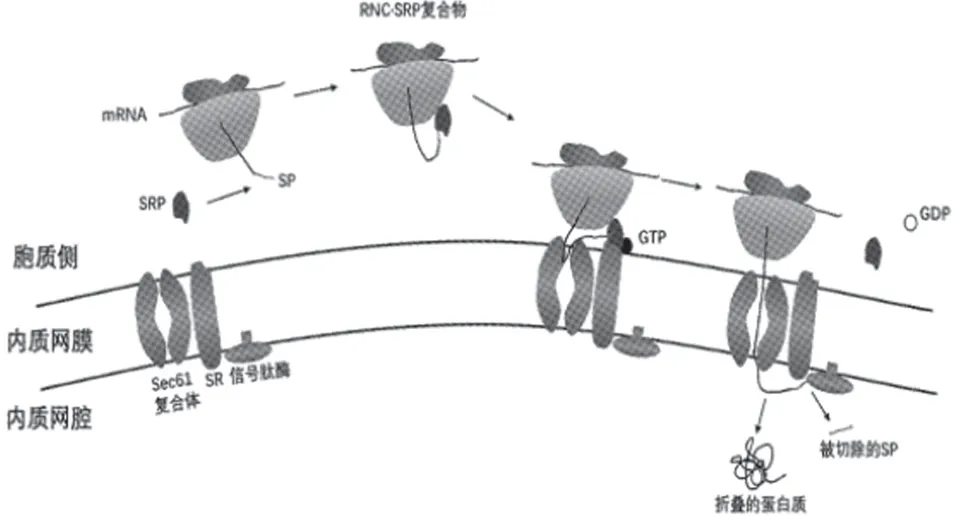
图1 新生链进入内质网腔过程示意图
3.2 内质网膜整合蛋白 大多数内质网膜蛋白也是由Sec61 复合体整合到脂双层中。信号序列指导新生链开始向内质网转移,可看作开始转移序列;在新生链的内部,可能存在与内质网膜脂双层具有高度亲和力的片段,称为内在停止转移锚定序列(STA)和内在信号锚定序列(SA)。具有该类序列的肽链将停止转运,不再进入内质网腔中,最终形成膜整合蛋白。含有多个开始转移序列和停止转移锚定序列的肽链将成为多次跨膜的膜整合蛋白[1]。
内质网的膜整合蛋白根据拓扑学特征大致可分为4 型,其不同点在于有、无可切割的N 端信号序列、定位方向和跨膜次数。Ⅰ型(例如,胰岛素受体、生长素受体等)、Ⅱ型(例如,高尔基半乳糖苷转移酶等)和Ⅲ型(例如,细胞色素P450)为单次跨膜蛋白,决定其拓扑学特征的是肽链内在的停止转移锚定序列和信号锚定序列;Ⅳ型(例如,G 蛋白偶联受体、葡萄糖转运蛋白等)为多次跨膜蛋白。新生肽链的跨膜取向也具有一定的规律性,根据“正内”规则,带正电的侧翼序列通常位于膜的细胞质侧。有证据表明,整合并不完全是序列自主的,还取决于序列的上、下段,从间隔非常近的跨膜片段到相邻序列的折叠状态和性质。膜蛋白的拓扑发生甚至受到辅助蛋白的影响,这些辅助蛋白可能是膜内的分子伴侣[10]。
4 靶向其他细胞结构的膜泡运输
在内质网加工后的蛋白质需要通过转运膜泡运输到高尔基体进一步加工,最后靶向溶酶体、液泡等细胞结构。转运膜泡根据其包被蛋白的不同,可分为COPⅡ包被膜泡、COPⅠ包被膜泡、网格蛋白/接头蛋白包被膜泡3 种类型,其中COPⅡ包被膜泡主要负责从内质网到高尔基体的物质运输。
4.1 膜泡的装配 以COPⅡ包被膜泡为例,简要阐述膜泡的装配过程。COPⅡ包被组分主要是Sec23/Sec24 和Sec13/Sec31 复合物、Sec16、小分子GTP 结合蛋白Sar1,其在内质网膜上的组装是逐步进行的。首先,Sec12(鸟苷酸交换因子)促进GTP 结合以募集Sar1,形成Sar1-GTP。Sar1 是一种GTP 酶,在GTP 结合状态下,Sar1 暴露了一个N 端疏水性的α 螺旋插入内质网膜。随后,异二聚体Sec23/24 被募集。Sec24 是与目标蛋白结合的主要适配器,一旦进入内质网,就与目标蛋白结合,进而将其转运到高尔基体。之后,Sec13/31 的异二聚体通过Sec23 和Sec31 之间的相互作用被募集。Sec13/31 在初生的囊泡上形成一层笼状的外被膜,推动膜的弯曲。最后,Sec16 结合到内质网膜的胞质表面,进一步加快被膜蛋白的装配。在Sar1 的作用下GTP 水解形成Sar1-GDP,并从膜泡释放使包被解聚[11](图2)。

图2 COPⅡ包被膜泡的形成过程
4.2 膜泡与靶膜的锚定和融合 膜泡与靶膜的锚定需要Rab 蛋白的参与。Rab 蛋白可视为一种分子开关,当它与GTP 结合形成Rab-GTP 时,其构象发生改变从而结合到膜泡上。结合了Rab-GTP 的膜泡与靶膜上的Rab 效应器相互作用,这样膜泡即锚定在靶膜上。膜融合主要是SNARE 蛋白的相互作用。膜泡上的v-SNARE 蛋白,能与靶膜上的t-SNARE 蛋白进行配对,这种配对具有特异性。融合过程类似“拉链”,从配对形成的SNARE复合物的N 端到C 端形成一股拉力将双层膜拉在一起,完成膜的融合[12]。

