胃、直肠同时性双原发癌一例
白满灵 马小云
1 临床资料患者女,75岁。2019年9月因“间歇性腹胀5年,间断便血1年余”就诊于武威市人民医院并收入院。患者于31年前行胆囊切除术,20年前行阑尾切除术。无肿瘤家族史,有偏头痛病史10余年,长期口服阿司匹林、对乙酰氨基酚等NSAID。入院后行肿瘤标志物检查示:铁蛋白131.6 ng/mL,AFP 7.3 μg/L,CEA 18.5 μg/L,CA19-9 60.32 U/mL,CA242 31.6 U/L。体格检查示:全身皮肤黏膜无出血点和瘀斑,浅表淋巴结未触及肿大;腹部平软,剑突下轻度压痛,余无明显压痛及反跳痛。电子胃镜检查示:胃窦小弯近胃角处一平坦凹陷性病灶,大小约1.5 cm×1.5 cm,中央凹陷,表面覆灰白苔,边缘水肿隆起,取活组织2块,质脆,出血多(图1)。胃部病灶活组织检查(简称活检)病理结果示:(胃窦小弯近胃角)溃疡,病灶区黏膜呈高级别上皮内瘤变,腺癌形成(图2)。电子结肠镜检查示:直肠距肛缘10 cm处一不规则肿块阻塞肠腔,表面呈结节状隆起,覆大量灰白苔,管腔狭窄明显,肠镜无法通过,表面溃烂出血,取活组织4块,质脆,出血多(图3)。直肠病灶活检病理结果示:(直肠距肛缘10 cm)腺癌(图4)。腹部扫描+增强CT检查示:①直肠上段癌并双侧髂血管旁、腹膜后多发淋巴结转移(T3N2M0);②肝胃间隙多个淋巴结肿大;③脂肪肝;④胆囊缺如;⑤绝经后子宫;⑥胰腺、脾脏、双肾、膀胱未见明显异常。诊断为胃窦癌、直肠癌。
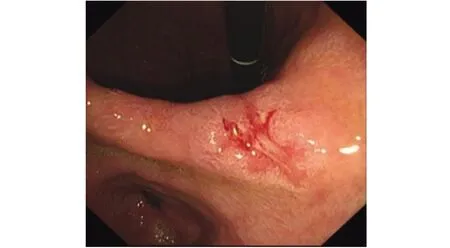
图1 术前电子胃镜显示

图2 术前胃部病灶活检病理图片 (H-E染色,×40)

图3 术前电子结肠镜显示
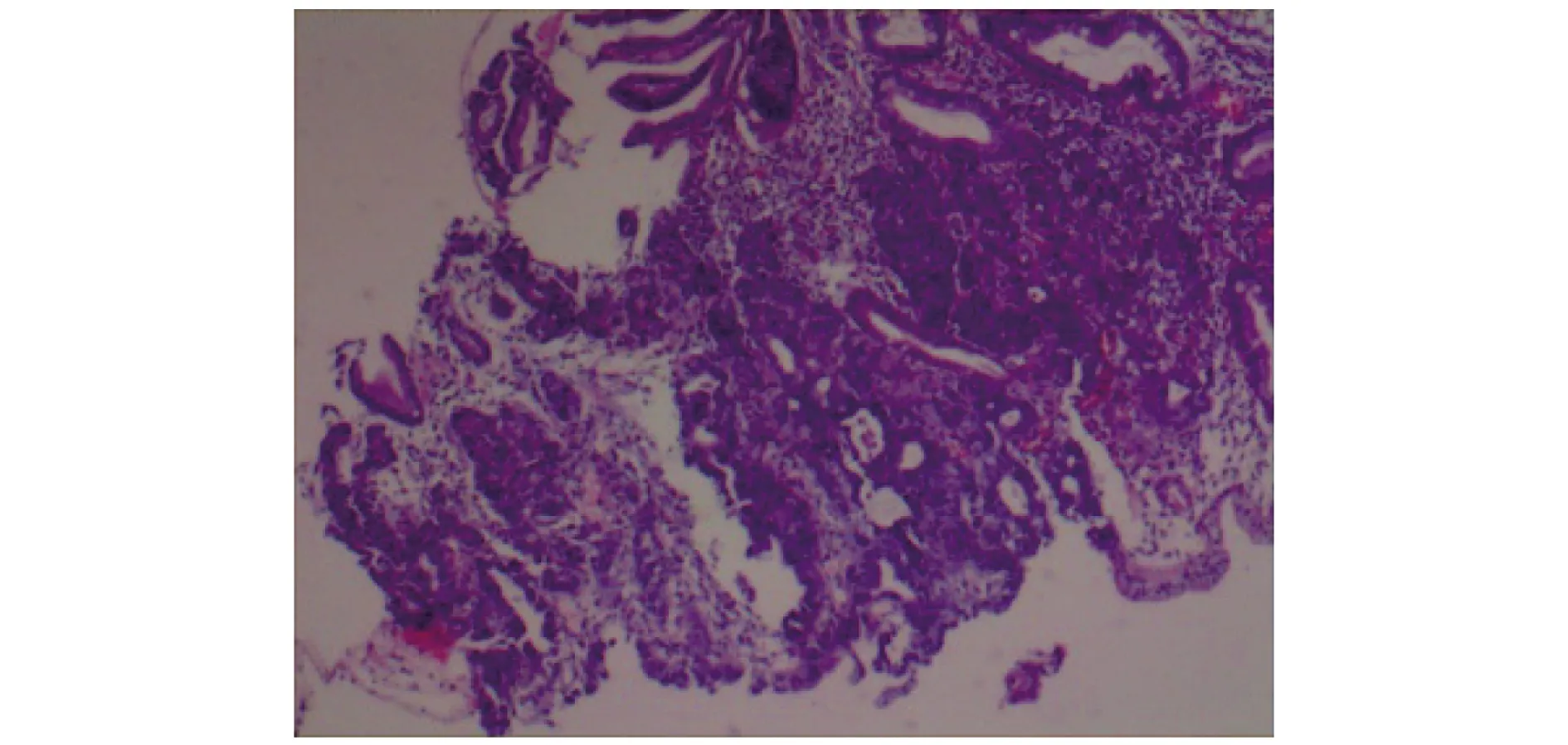
图4 术前直肠病灶活检病理图片 (H-E染色,×40)
2019年9月11日采用内镜黏膜下层剥离术(ESD)行胃癌切除,术中见病灶中央凹陷处与黏膜下层纤维化明显,经反复黏膜下注射后剥离(图5)。术后病理诊断:低分化腺癌,癌组织侵及黏膜肌层,脉管内未见肿瘤细胞,水平切缘及基底切缘均未见肿瘤细胞(图6)。免疫组织化学检查示:癌细胞E-Cadherin(+)、CDX-2(+)、CK7(-)、CK20(-)、P53(-)、Her-2(-)、Ki-67(阳性细胞约占40%)。根据术后病理确诊为早期胃癌,考虑术中发现的组织纤维化由溃疡及取活检操作所致。术后1周,患者生命体征平稳,一般状况可,复查血常规、凝血功能、肝功能、肾功能、电解质各项指标均无明显异常,遂再行直肠癌根治术。术后病理诊断:中分化腺癌。术后患者恢复良好,一般状况可;术后1个月行XELOX方案(奥沙利铂+卡培他滨)化学治疗(简称化疗)1个周期(未完成),因患者不能耐受而放弃,随访3个月未见肿瘤复发,截至发稿前仍在随访中。

图5 术后胃镜显示
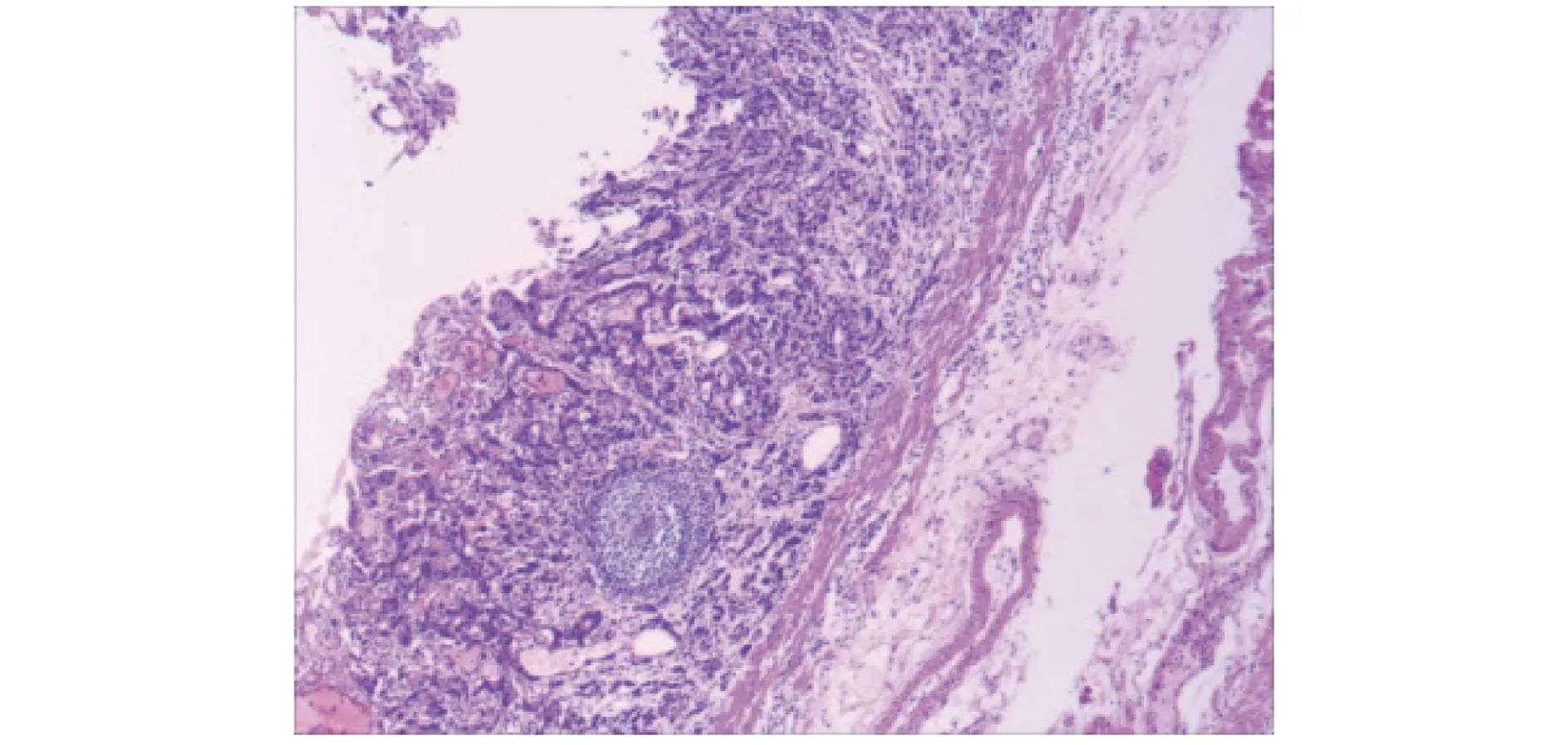
图6 术后胃部病灶活检病理图片 (H-E染色,×40)
2 讨 论多原发恶性肿瘤(也称多原发癌)指同一患者的单个或多个器官、组织同时或先后发生2种或2种以上的原发恶性肿瘤。多原发癌的发生可能与患者的遗传因素(多有家族史,如抑癌基因p53突变)、免疫水平降低(红细胞和T淋巴细胞免疫水平均明显降低)、医源性因素(放射治疗和化疗导致第二原发癌发生)、个体易感性、生活方式(吸烟、饮酒、口服药物)及环境等有关[1-3]。随着诊疗技术的不断进步,多原发癌的检出率呈明显上升趋势。国内多原发癌的检出率为0.52%~3.66%,国外多原发癌的检出率为0.73%~11.70%[3]。第一原发癌以鼻咽癌多见,其次为乳腺癌、肺癌等。第二原发癌以肺癌多见,其次为直肠癌、鼻咽癌等[4]。多原发癌患者存在性别差异,肺部和消化系统肿瘤以男性多见,主要原因可能是男性多吸烟或饮酒[5]。本例患者为75岁女性,同时罹患消化系统的胃窦癌和直肠癌,长期口服NSAID,基本符合多原发癌的临床特点。目前,多原发癌的诊断多采用Warren等[6]修订的标准:①每种肿瘤必须经病理证实为恶性肿瘤;②每种肿瘤均独立存在,彼此无关,具有各自独特的病理学形态;③肿瘤间必须有一定距离间隔,发生在不同部位或不同器官;④每处肿瘤必须排除为其他肿瘤的转移病灶。多个恶性肿瘤发生间隔时间6个月内为同时性多原发癌,>6个月为异时性多原发癌。根据上述标准,本例患者符合同时性双原发癌的特征。据国内外报道,多原发癌患者5年生存率为9%~22%。多原发癌的治疗方式与转移癌和复发癌完全不同,一般遵循各个原发癌本身的治疗原则,有手术指征的首先考虑行手术切除,手术疗效与单发癌相似。既往研究[7-9]结果表明,多原发癌的病灶数目与患者生存时间无显著相关性。
本例患者75岁,高龄患者常伴有心脑血管疾病、慢性支气管炎、肺气肿、糖尿病、肾功能不全等1种以上基础疾病,亦常合并低蛋白血症、贫血等,增加了麻醉、手术风险,甚至有部分患者因此不能耐受手术。报道显示,>80岁的结直肠癌患者中,有合并症及并存疾病者达84.6%[10]。因患者免疫力低下,对手术耐受性较差,术后恢复较缓慢,更易发生肺部感染、尿路感染、切口愈合欠佳或感染、心律失常、吻合口漏等并发症,此类患者术后死亡原因多为成人呼吸窘迫综合征(ARDS)、感染性休克、多器官功能障碍综合征(MODS)等,死亡风险可随年龄增加而增大[11]。同时行胃癌、直肠癌根治术的手术创伤大,大大增加了患者围手术期风险。分析该患者两处病灶的特点,胃肿瘤考虑为早期胃癌,病灶有溃疡形成,但范围<2 cm,病理诊断为低分化腺癌,属于胃ESD相对适应证(<2 cm、无溃疡的分化型早期胃癌为ESD的绝对适应证)[12]。与传统外科手术相比,ESD创伤小,可提高肿瘤组织切除率,显著降低术后并发症的发生率,缩短术后住院时间,促进患者术后恢复[13-14]。本例患者ESD术后1周经评估,各项指标与术前无明显变化,遂行直肠癌根治术,减少了直肠癌进展和转移的风险,患者获益多。此外,高龄患者的器官功能有不同程度减退,合并症多,结直肠癌术后各类并发症发生率高达30%[12]。本例患者若先行直肠癌根治术,一旦发生严重的术后并发症,再行ESD治疗胃癌的时间将延迟,可造成早期胃癌发生进展或转移,从而不得不考虑行外科手术,大大增加了手术的难度和风险。
因此,临床上应加强对多原发癌的重视,对于一个肿瘤不能解释的临床表现,应考虑多原发癌存在的可能,避免误诊和漏诊。治疗方式的选择应首先考虑手术根治,其次需根据患者个体情况选择合适的治疗方案,ESD对治疗消化道早期癌和改善多原发癌患者的预后具有重要意义。

