膀胱浆细胞样尿路上皮癌的临床和病理学特征
宋瑞祥 陈星晔 张振声 白辰光 王辉清 礼 嵩 周 铁 许传亮
膀胱癌是发病率相当高的恶性肿瘤,每年有近40万新发膀胱癌病例[1]。膀胱癌最常见的病理类型为尿路上皮癌,而浆细胞样尿路上皮癌(plasmacytoid urothelial carcinoma, PUC)是其中罕见的病理分型,这一组织学类型被收录于2004年WHO尿路上皮癌 (urothelial carcinoma,UC) 中[2],占侵袭性UC的1%~3%[3]。Sahin 等[4]首次报道该病例,因患者肋骨和颅骨提取的细胞具有多发性溶骨性肿瘤学特征,起初被误诊为多发性骨髓瘤。在以“浆细胞样尿路上皮癌(plasmacytoid urothelial carcinoma)”为主题词的Pubmed数据库中,仅有100多例PUC,大多为单病例报道或小样本研究[5]。因此,PUC的治疗方式尚未形成统一共识[6-7]。本研究回顾性分析在海军军医大学第一附属医院泌尿外科确诊的PUC患者临床和病理组织学特征,旨在提高临床医师对PUC的认识。
1 对象和方法
1.1 研究对象 回顾性分析于2015年9月—2019年12月海军军医大学第一附属医院泌尿外科收治的5例PUC患者的临床资料、治疗方式、病理诊断和免疫组织化学(简称免疫组化)染色特征和预后。
1.2 方法 入组患者需由2名病理科医师同时确诊为PUC。病理诊断依据《刘彤华诊断病理学》。术者为独立带组10年以上,每年行手术50例以上的泌尿外科主任医师。手术方式参照《2019版中国泌尿外科疾病诊断治疗指南——膀胱癌诊断治疗指南》。经手术切除和活组织检查(简称活检)的组织进行病理学和免疫组化染色检查。
2 结 果
2.1 一般资料 5例PUC患者中,男4例、女1例;平均年龄为77岁(范围66~85岁),随访6~67个月。3例非肌层浸润 (T1期)PUC患者行经尿道膀胱肿瘤电切术(TURBT),随访期内无肿瘤复发。1例肌层浸润(T3期)患者行根治性膀胱切除术(RC),术后10个月死亡。1例首诊时已发生多处转移行抗程序性死亡蛋白1(PD-1)免疫治疗3次,随访6个月死亡。患者的临床资料、治疗方法和随访情况见表1。

表1 患者的临床资料、治疗方法和随访情况
2.2 PUC形态学、影像学、病理学和免疫组化染色特征 膀胱镜下见PUC呈肿块型或菜花样(图1A),CT尿路造影(CTU)示肿物突向膀胱(图1B、1C)。
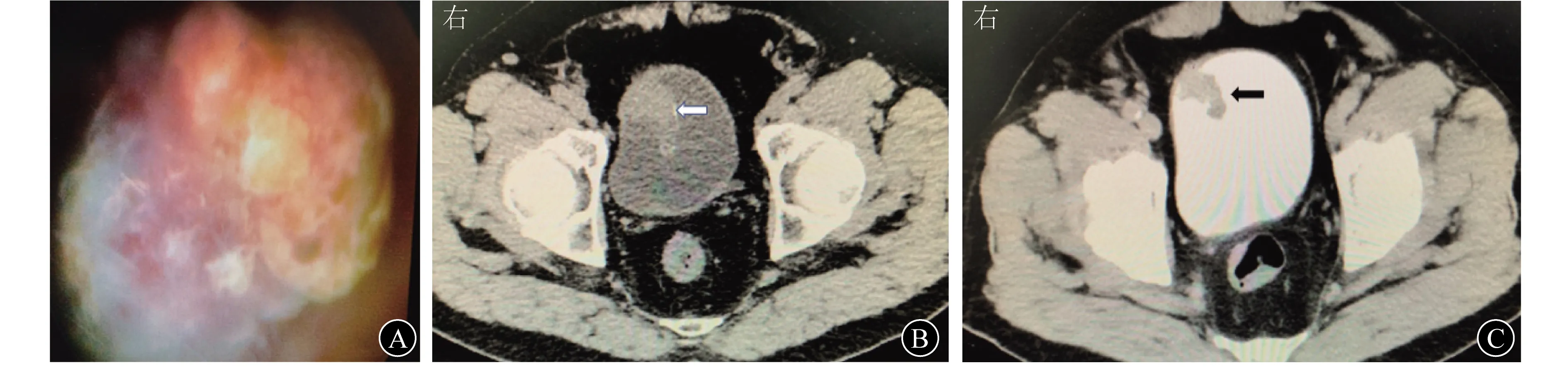
A 膀胱镜表现 B CTU平扫(白色箭头为PUC) C CTU排泄期(黑色箭头为PUC)图1 病例2患者的影像学和膀胱镜表现
光学显微镜下见PUC细胞呈弥漫性浸润性生长(图2A),肿瘤细胞核偏位,具有丰富的嗜酸性细胞质,与浆细胞非常相似(图2B)。PUC通常与UC细胞同时存在,可具有印戒细胞形态的特征(图2C)。
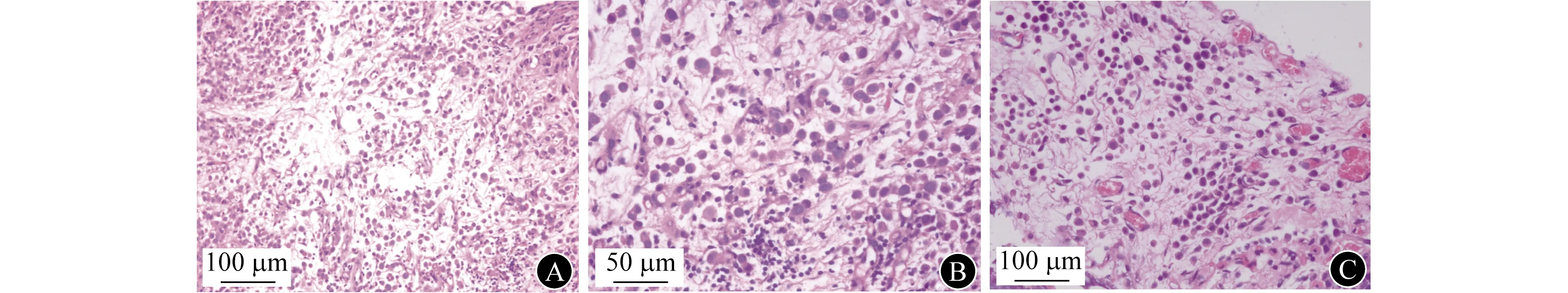
A PUC呈弥漫性浸润生长(×200) B PUC细胞具有偏心性细胞核和丰富的嗜酸性细胞质(×400) C PUC与UC同时存在,可具有印戒细胞形态的特征(×200)图2 PUC的组织病理学特征(H-E染色)
5例患者PUC的免疫组化检查结果(表2)显示,4例患者P53表达阳性;Ki-67阳性指数40%~80%;5例患者低分子细胞角蛋白(CAM5.2)、细胞角蛋白(CK)7、GATA结合蛋白3(GATA-3)和重组蛋白(CD138)呈部分或弥漫阳性(图3A和图3B);2例P63和1例CK20为阴性,其余为阳性或部分阳性;5例尿路上皮特异蛋白3抗体(uroplakin Ⅲ,UPK3)均表达阳性(图3C),其中2例为弱表达;3例上皮钙黏素(E-cadherin,E-cad)表达阳性、2例阴性(图3D)。
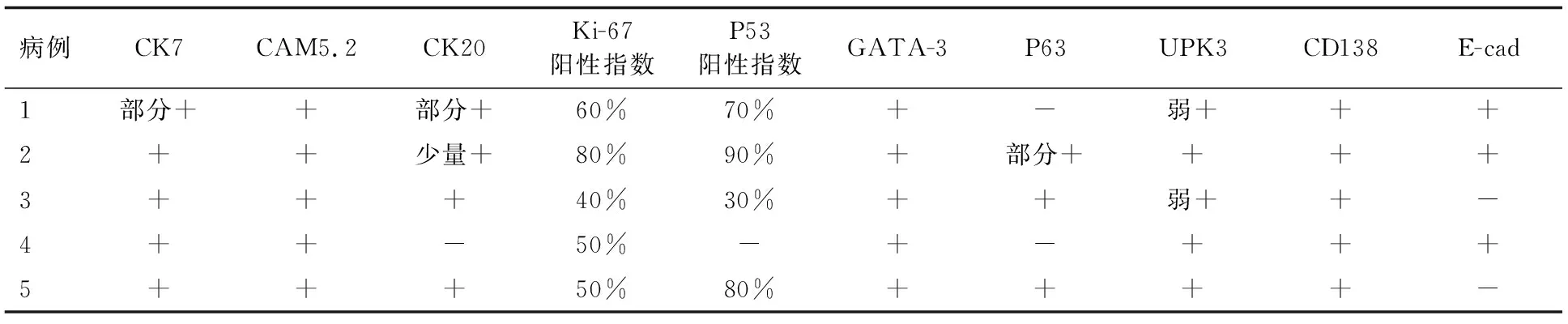
表2 5例患者PUC的免疫组化检查结果
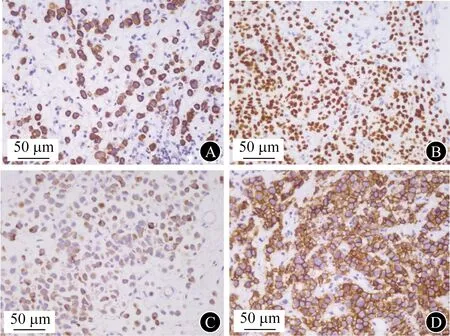
A CK7呈弥漫阳性 B GATA-3呈弥漫阳性 C UPK3表达阳性 D E-cad表达阳性图3 PUC的免疫组化染色特征(×400)
3 讨 论
PUC是UC的一种罕见亚型,据Mai等[2]报道其约占浸润性UC的3%,占肌层浸润性UC的2.7%。PUC发病年龄46~81岁,男性发病率高于女性,男女之比为2∶1[8]。本研究的5例患者中4例为男性,发病年龄范围66~85岁,以无痛肉眼血尿为首诊症状,与既往文献报道相符。3例非肌层浸润PUC,术后随访无复发。1例肌层浸润PUC,1例首诊时已发生多处转移,这2例均于1年内死亡。据此认为,PUC分期≥T2期的患者,病情进展迅速,预后差。
膀胱镜下见PUC的形态多样,可呈菜花样、肿块样或弥漫样,少数病例可呈溃疡状。本研究中,肿瘤多发生于三角区、左侧壁和前壁。光学显微镜下,由分散的非典型癌细胞组成,这些细胞具有相对丰富的嗜酸性细胞质和偏心细胞核,表现为中等多态性,可呈淋巴细胞样或印戒细胞样,PUC细胞占癌细胞的5%~100%,大小中等,多为圆形、卵圆形或多角形,核大而圆[9-11];可混有数量不等的高级别UC,癌细胞间黏附性较差,呈条索状、巢状、片状或无规则分布于疏松或黏液样基质中,PUC这一形态学特征可能是其具有较强浸润性或预后不良的因素之一。免疫组化染色方面,Shimada等[12]认为,CD138和β人绒毛膜促性腺素(β-HCG)在PUC中高表达,可能成为诊断标志物。王见璋等[13]发现,CD138表达于尿路上皮及其相关病变中,但是CD138阳性不能作为PUC的诊断依据。E-cad在普通型UC中高表达,而在PUC中表达阴性,可用于两者的鉴别。Mai等[2]和Perrino等[14]认为,E-cad表达缺失与癌细胞特征的变异和侵袭性增加有关,也可能与肿瘤侵犯肌层及其复发相关。但Fox等[11]发现,仍有部分PUC病例(27%)E-cad表达阳性。本研究的5例患者中,3例E-cad表达阳性;5例患者CK7、CAM5.2、GATA-3、UPK3和CD138均呈阳性;4例CK20表达阳性;Ki-67阳性指数亦较高,提示癌细胞增殖活跃度偏高,恶性程度较高,这可能也是PUC浸润能力强及预后较差的原因之一。
在治疗方面,目前尚无统一的治疗标准和专家共识,尤其是针对T1期PUC。本研究中,按照常规膀胱UC的指南治疗,3例患者为T1期,行TURBT,术后辅助膀胱灌注治疗配合定期膀胱镜检查,随访至今均未见肿瘤复发或进展。1例T3期患者行RC,因高龄术后未行辅助化学治疗(简称化疗),术后9个月死亡。1例患者首诊时已有远处转移,失去手术机会,选择抗PD-1免疫治疗,随访6个月死亡。经文献回顾分析,大部分患者接受RC和辅助化疗,化疗方案为M-VAC(甲氨蝶呤、长春碱、多柔比星、顺铂)和GC(吉西他滨和顺铂)[9],个别T1期患者行TURBT,术后密切随访[15]。基于顺铂的辅助化疗是局部晚期膀胱癌的首选治疗方法,具有组织学变异的PUC与高级别UC相比具有更高的进展风险。因此,Keck等[16]认为,与高级别UC相比,PUC的预后更差,总生存期更短。RC和辅助化疗是相对有效延长PUC总生存期的治疗方式。而且,Kaimakliotis 等[17]认为,治疗PUC应该更为积极,RC可适用于任何分期的PUC。尽管不确定PUC是否为膀胱癌预后较差的独立危险因素,但其预后不良可能与首诊时已为高分期有关[18]。
程序性死亡蛋白配体1(PD-L1)通过与PD-1形成复合物在抑制免疫系统中起主要作用[19]。临床药物研究发现,抗PD-L1和抗PD-1药物对UC患者有快速且持续的反应和疗效,PD-1表达越高的浸润性UC患者的疗效更好,但抗PD-1药物治疗PUC的疗效尚不明确[20-21]。本研究中,病例4行PD-1和PD-L1检测,均未表达PD-1或PD-L1,尝试应用抗PD-1免疫治疗,第3个治疗周期时病情进展,随访6个月后死亡,提示抗PD-1免疫治疗可能不是适合晚期PUC的治疗方式。
总之,PUC首诊时已为较高分级和分期可能是病情进展迅速、预后较差、总生存期短的原因。因此,病理科医师和泌尿外科医师应提高对该疾病的认识。治疗方面,非肌层浸润PUC可首选TURBT,术后强烈建议配合膀胱灌注治疗和定期膀胱镜检查;肌层浸润PUC亦可于确诊时积极行RC,术后辅助化疗。临床上仍需累积病例进一步提高对PUC的认识。

