益生菌辅助治疗非酒精性脂肪性肝病的效果
胡 晓
福建省立医院药学部,福建福州 350001
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是指排除酒精、病毒、药物及其他类型的肝脏疾病,因肝脏脂肪异常累积引起的病理综合征[1]。NAFLD 的真实内涵是营养过剩、胰岛素抵抗(insulin resistance,IR)、相关代谢紊乱引起的慢性肝损伤[2]。NAFLD 逐年上升,目前已成为全球最常见的慢性肝病[3]。在我国,NAFLD 的发生率也呈现逐步上升、低龄化的趋势[4]。近年来,NAFLD 与肠道菌群的关系被日益关注,肠道和肝脏之间有一条双向交流通路叫做肠-肝轴(gut-liver axis,GLA),其中一条通路就是门静脉,门静脉提供肝脏的大部分血供,故肠道菌群与肝脏是密切相连、相互影响的[5]。人体的胃肠道中有500~1500 种细菌,肠道系统中的细菌重达1~2 kg,健康的肠道菌群对机体的免疫调节起到至关重要的作用[6]。大量研究表明,肠道菌群失调在人类肝病发病机制中起着重要作用,尤其是NAFLD[7-8]。本研究以此为出发点,选取福建省立医院接收的72 例NAFLD 患者作为研究对象,展开益生菌辅助治疗NAFLD 的效果观察,旨在为NAFLD 的治疗提供新思路。
1 资料与方法
1.1 一般资料
选取2018年1月—2019年12月福建省立医院接收的72 例NAFLD 患者作为研究对象,采用随机数表法将其分为观察组(n=36)和对照组(n=36)。两组患者的一般资料比较,差异无统计学意义(P>0.05)(表1),具有可比性。
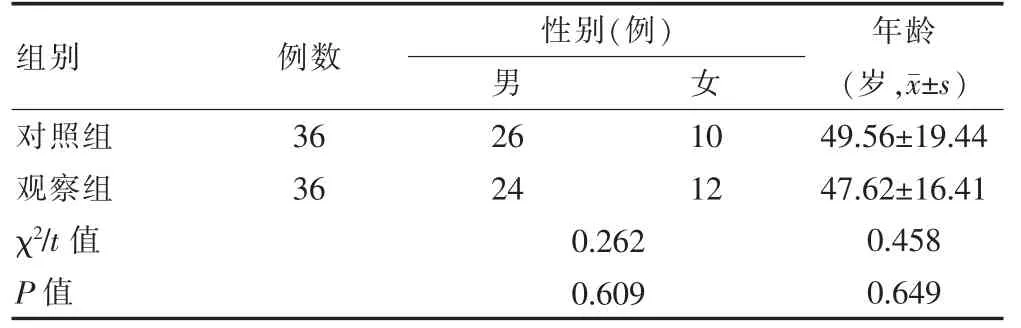
表1 两组患者一般资料的比较
纳入标准:①患者均符合《非酒精性脂肪性肝病防治指南》(2018 更新版)中NAFLD 的诊断标准[2];②患者的年龄18~69 岁;③患者及家属对本研究知情同意;④患者近3 个月内未使用益生菌制剂和调脂药物。排除标准:①无过量饮酒史者(折合乙醇量男性<30 g/d,女性<20 g/d);②各类酒精性、病毒性、药物性、自身免疫性肝病者;③肝豆状核变性、全胃肠外营养、炎症性肠病等导致的脂肪肝者;④妊娠期、哺乳期妇女;⑤重症疾病、精神病、对本研究涉及药品过敏、存在禁忌证患者。
1.2 方法
对照组患者采用常规对症治疗,具体如下:饮食指导、运动调整+常规NAFLD 治疗,饮食方面向地中海饮食结构调整; 运动调整包括有氧运动和阻抗训练[9]。
观察组患者采用常规对症+口服肠道益生菌联合治疗,具体如下:常规对症治疗方案与对照组相同,加用双歧杆菌乳杆菌三联活菌片(商品名:金双歧,内蒙古双奇药业股份有限公司,国药准字S19980004,生产批号2017112571)辅助治疗,用法为2000 mg/次,tid。
两组治疗时间均为3 个月,3 个月后进行门诊随访,并进行两组患者的肝功能相关的血清学生物标志物检查。
1.3 观察指标及评价标准
1.3.1 两组患者治疗前后各项实验室检查指标的比较实验室检查指标包括谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,GGT)、总胆红素(total bilirubin,TBil)、总胆固醇(total cholesterol,TC)、三酰甘油(triacylglycerol,TG)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)。在患者空腹状况下采集次日清晨静脉血3 mL,将采集静脉血置入干燥试管后完成血清分离,注意静脉血采集时间与血清分离时间的间隔,避免出现溶血现象;待血清分离完成后2 h 内进行血液自动化检测,如2 h 内无法完成,则将已经血清分离的血液标本置入恒温箱(环境温度设定为4℃)内保存,待下次检测时取出。
1.3.2 两组患者治疗前后体重指数(body mass index,BMI)值的比较 根据患者的体重、身高,计算BMI值,BMI=体重/身高2。
1.4 统计学方法
采用SPSS 20.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,两组间比较采用独立样本t检验,组内比较采用配对样本t检验;计数资料采用率表示,组间比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者治疗前后肝功能指标的比较
治疗前,两组患者的ALT、AST、GGT、TBil 水平比较,差异无统计学意义(P>0.05);治疗后,两组患者的ALT、AST、GGT、TBil 等肝功能指标水平均低于治疗前,差异有统计学意义(P<0.05);治疗后,观察组患者的ALT、AST、GGT 均低于对照组,差异有统计学意义(P<0.05);治疗后,两组患者的TBil 水平比较,差异无统计学意义(P>0.05)(表2)。
表2 两组患者治疗前后肝功能指标的比较(±s)
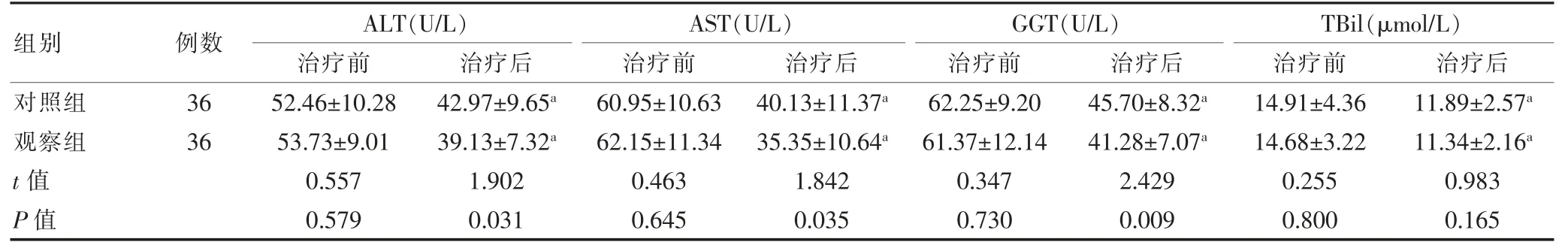
表2 两组患者治疗前后肝功能指标的比较(±s)
与同组治疗前比较,aP<0.05
组别例数ALT(U/L)治疗前治疗后AST(U/L)治疗前治疗后GGT(U/L)治疗前治疗后TBil(μmol/L)治疗前治疗后对照组观察组t 值P 值36 36 52.46±10.28 53.73±9.01 0.557 0.579 42.97±9.65a 39.13±7.32a 1.902 0.031 60.95±10.63 62.15±11.34 0.463 0.645 40.13±11.37a 35.35±10.64a 1.842 0.035 62.25±9.20 61.37±12.14 0.347 0.730 45.70±8.32a 41.28±7.07a 2.429 0.009 14.91±4.36 14.68±3.22 0.255 0.800 11.89±2.57a 11.34±2.16a 0.983 0.165
2.2 两组患者治疗前后TC、TG、BMI、TNF-α 水平的比较
治疗前,两组患者的BMI、TC、TG、TNF-α 水平比较,差异无统计学意义(P>0.05);治疗后,两组患者的BMI、TC、TG、TNF-α 水平均低于治疗前,差异有统计学意义(P<0.05);治疗后,观察组患者的TC、TG 水平均低于对照组,差异有统计学意义(P<0.05);治疗后,两组患者的BMI、TNF-α 水平比较,差异无统计学意义(P>0.05)(表3)。
表3 两组患者治疗前后TC、TG、BMI、TNF-α 水平的比较(±s)

表3 两组患者治疗前后TC、TG、BMI、TNF-α 水平的比较(±s)
与同组治疗前比较,aP<0.05
组别例数TC(mmol/L)治疗前治疗后TG(mmol/L)治疗前治疗后BMI(kg/m2)治疗前治疗后TNF-α(μg/L)治疗前治疗后对照组观察组t 值P 值36 36 5.58±1.02 5.67±0.93 0.391 0.697 4.87±0.65a 4.53±0.46a 2.562 0.006 2.18±0.94 2.08±0.87 0.468 0.641 1.75±0.83a 1.45±0.65a 1.707 0.046 25.81±3.52 26.07±3.74 0.304 0.762 24.46±3.11a 24.72±3.06a 0.358 0.639 1.02±0.35 0.98±0.31 0.513 0.609 0.61±0.27a 0.58±0.24a 0.498 0.310
3 讨论
3.1 综合比较
本研究结果显示,治疗后,两组患者的ALT、AST、GGT、TBil、TC、TG、TNF-α、BMI 均低于治疗前,差异有统计学意义(P<0.05);治疗后,观察组患者的ALT、AST、GGT、TC、TG 低于对照组,差异有统计学意义(P<0.05);两组患者的TBil、TNF-α、BMI 比较,差异无统计学意义(P>0.05)。在NAFLD 的诊断与评估中,单纯的一个检查指标如AST 或ALT,常常不能客观反映NAFLD 的病情进展,故应多因素综合考虑,如结合多个肝功能指标、年龄、BMI、血脂、腹围、肝脏彩超等综合考虑,综合评估益生菌制剂对NAFLD 的辅助治疗效果。总体来说,双歧杆菌乳杆菌三联活菌片对NAFLD 患者,尤其是服用保肝药后伴腹泻、肠功能紊乱的患者而言是获益的。
3.2 肠道菌群与NAFLD 的关系
肠道的第一道防线由肠黏膜、肠道免疫细胞、肠上皮细胞共同构成,以防止肠道内的病原微生物、细菌内毒素和其他有害物质侵入组织。肠道菌群失调,会使小肠有害菌过度生长,以削弱肠屏障功能,肠系膜淋巴系统与门静脉相连接,大量肠道致病菌移位,产生的内毒素通过门静脉进入肝脏[10],诱发促炎因子过度生产,导致炎症加剧,高水平炎症因子与宿主自身免疫系统相互作用,破坏局部免疫细胞功能,促进NAFLD 的发生、发展[11];菌群失调时,有害菌通过调节宿主脂肪存储基因,增加脂肪在肝脏的积累;还会通过有害菌过度增殖造成的慢性炎症状态,影响脂代谢[12]。NAFLD 与菌群失调的作用是相互的,NAFLD会反过来进一步加重肠道菌群的失调,因肝功能受损后,肝脏对肠道毒素的处理能力降低,肠道来源毒素的积累,进一步加重肠黏膜屏障的受损;此外,肠道毒素的积累使溶菌酶和相关抗体减少,内毒素增加,以促进肠道革兰氏阴性菌的增殖,并进一步抑制肠道益生菌的生长[13],从而陷入恶性循环。所以调节肠道菌群,是治疗NAFLD 的重要靶点。
3.3 益生菌
益生菌是一种能够定植于肠道,改善肠道菌群,并能通过调节肠道黏膜和系统免疫功能,产生对宿主健康有益的活性微生物[14]。国际权威机构已经认可了益生菌的安全性[15],本研究采用的是双歧杆菌乳杆菌三联活菌片,包含长型双歧杆菌、保加利亚乳杆菌、噬热链球菌,均为健康人肠道的正常菌群,可在人体肠道中生长与繁殖,调节肠道菌群平衡的同时,抑制并清除肠道中的有害细菌。近年来,越来越多的益生菌制剂被认为是NAFLD 的潜在治疗药物,其作用机制包括:调节肠道菌群,防止肠道有害菌的过度生长;降低肠道通透性,增强肠屏障功能;调节糖脂代谢,减少肝脏脂肪沉积; 减少炎症因子如TNF-α、IL-6 等释放,减轻氧化应激,抑制慢性肝炎症反应[16]。此外,一些需要长期服用保肝药物如多烯磷脂酰胆碱胶囊的NAFLD 患者,有时会出现胃肠道紊乱或腹泻的情况,进一步影响肠道菌群,故同时服用益生菌制剂能改善患者因腹泻而导致的肠道菌群失调。经过随访,观察组部分患者的腹泻情况得到了缓解。所以,益生菌以其应用安全、价廉的优点,在辅助治疗NAFLD 方面具有一定的临床价值。
3.4 需要改进的地方
目前,肝活检是NAFLD 的金标准[17],但由于它的有创、费用高的缺点,常不被患者接受,故本研究采用无创的血清学生物指标作为评价标准,存在着一定的局限性,研究选取了ALT、AST、GGT、TBil、TC、TG、BMI、TNF-α 等与NAFLD 相关且较为主流的、在实际工作中简便易得的检查指标进行评价。研究对象均采用血清标志物指标联合肝脏B 超进行NAFLD 的诊断,但干预后,未纳入肝脏B 超的评估结果进行组间比较。因目前通过肝脏B 超,只能进行定性比较,以评估NAFLD 的脂肪变情况,较为抽象。通过查阅文献,目前B 超定量诊断NAFLD 的新技术是受控衰减参数,能准确评估各程度NAFLD 肝脏脂肪变程度[18]。将血清学与影像学相结合,对于评估NAFLD 更为客观与准确。还可以采用质子磁共振波谱分析的影像学方法定量诊断NAFLD。此外,还有更多的炎症因子、代谢相关标志物和遗传标志物指标等可以作为NAFLD 的诊断与评估[17],其精确性及可操作性还有待临床进一步的研究与验证,有望在将来发展成为NAFLD 的诊断与评估标志。此外,由于本研究样本量有限,希望在今后进一步的研究中,通过增加样本量等方法,以期对益生菌辅助治疗NAFLD 的临床疗效做出更合理的判断。
综上所述,非酒精性脂肪性肝病患者接受肠道益生菌治疗对于改善患者的肝功能有一定积极作用,具有可行性。

