转录组测序技术在植物乳杆菌细菌素合成 研究中的应用研究进展
赵 乐,孟祥晨
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
细菌素是由核糖体合成并分泌至胞外介质的具备生物活性的蛋白质、多肽或前体多肽,当这些物质达到一定数量时可抑制亲缘关系相近的致病菌或腐败菌的生长[1]。 但细菌素的抑菌机理复杂多样,且抑菌效果易受众多因素控制,导致其在食品防腐领域的实用范围较为局限。细菌素抑制目标菌的机制主要有2 种:通过与目标菌细胞壁及被膜接触后形成膜孔道,导致菌体内容物外泄而死亡,Munch等[2]等验证了LantibioticNAI-107菌株可与细胞壁骨架的组成成分萜醇结合,进而破坏细胞膜的正常生理功能;另一类抑制机制体现在分子水平,通过抑制相关代谢基因的表达或蛋白分泌,从而破坏目标菌的正常生长代谢,如分离于开菲尔的细菌素F1可在胞内与DNA结合,阻碍其转录、翻译过程[3]。由于乳酸菌细菌素种类颇多,因此,根据生物化学特性、分子质量、热稳定性及抑菌效果将细菌素进行分类,既有利于深入研究各类细菌素的具体抑菌机制,又可通过分离纯化、质谱等方法确定细菌素所包含的二硫键及单硫键,便于改造细菌素特性,进而实现多领域的开发应用。此外,有研究表明,可通过对已知菌株的细菌素基因设计引物,根据克隆得到的相关基因对细菌素进行分类鉴别[4]。随着乳酸菌新菌种的不断发现,使得分离纯化的新型细菌素无法再次归类到最初由Klaenhammer[5]提出的细菌素类别中,因此在原来的基础上进一步更新细菌素的分类方法迫在眉睫。不同研究者对细菌素的分类标准不同,本文总结主要的细菌素分类,突出它们的理化特性,并描述某些细菌素在膜水平上起作用的机理。根据各类细菌素的生物遗传特性、乳酸菌的菌属、热稳定性、是否存在二硫键、分子质量、水解酶的敏感性及抑菌谱,可分为以下四大类(表1):1)ClassⅠ细菌素,主要包括羊毛硫细菌素及其衍生物,此类细菌素在合成前体肽时往往会经酶识别并修饰,通过作用于细胞壁骨架或使细胞膜形成孔洞,进而控制腐败微生物及致病菌,其又可分为6 个亚类,如分离自植物乳杆菌LL441的Plantaricin C、Nisin和Pep5等[6];2)ClassⅡ细菌素,是一类不包含羊毛硫氨酸的小分子肽,肽链之间仅以二硫键连接,未经酶修饰,此类细菌素又可分为4 个亚类,其中Ⅱa型细菌素多肽链的N末端序列绝大多数为“Y-G-N-G-V-N”,可显著抑制李斯特菌,如Pediocin PA-1和Sakacin P,Ⅱb型细菌素在2 种短氨基酸序列的共同作用下抑菌活性达到最大,如Lactococcin G、Plantaricins等[7];3)ClassⅢ细菌素,如热不稳定的溶菌素Enterolysin A和非溶解性细菌素Helveticin J,它们在酶催化下可裂解构成细胞壁的内酶肽;4)ClassⅣ细菌素,如对酶敏感的Plantaricin S和Leuconocin S,其抑菌活性需凭借蛋白等生物大分子协同作用才能发挥抑菌活性[8]。
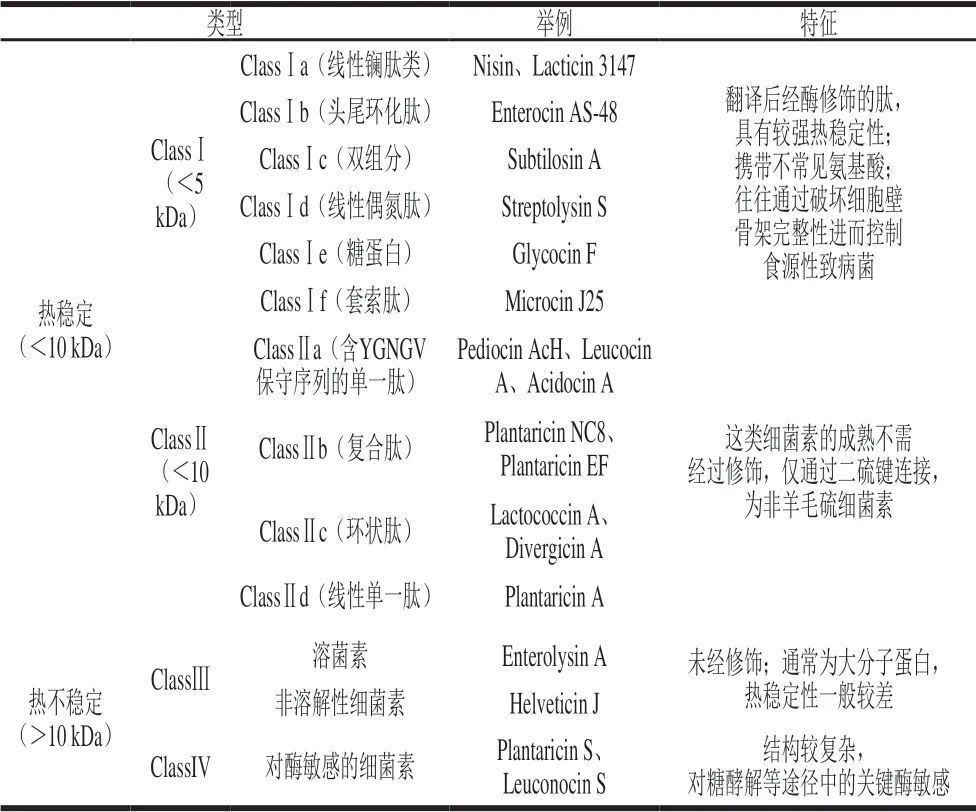
表1 乳酸菌细菌素的分类Table1 Classification of lactic acid bacterial bacteriocins
1 植物乳杆菌细菌素的应用
1988年美国食品药品监督管理局通过急慢性动物体实验操作及体内交叉耐受性实验表明,当人类每日摄入的Nisin含量低于2.9 mg/d时对人体无害[9],因此将Nisin列为公认安全级别,1990年又将其纳入GB 2760—86《食品添加剂使用卫生标准》。随着新型乳酸菌细菌素的表征及基因工程技术的完善,天然抑菌物质细菌素凭借其安全性已被广泛应用于保健食品、医疗药物、饲料添加剂、畜牧养殖等领域。广谱细菌素应用范围更广泛,而窄谱细菌素能够更具体地针对性抑制食物中的某些高风险细菌,如单核细胞增生李斯特菌,且不会影响无害微生物[10]。细菌素还可以浓缩制剂形式作为食品防腐剂或保质期延长剂,应用于食品的辅助生产[11]。此外,细菌素还可用于开发具备抑菌活性的食品包装纸或塑料薄膜。近年来,细菌素与高压处理或脉冲电场等物理方法的结合也为食品的有效保存提供了良好机会[12]。但细菌素的有效性通常取决于环境因素,如pH值、温度、食物结构组分及食物微生物群等。
1.1 在食品工业与保鲜防腐中的应用
乳酸菌细菌素在乳制品、肉制品、果蔬制品、酒品加工及食品包装纸的生产中展现出很大潜力。随着酸乳产业的蓬勃发展,研究者逐渐发现与鲜乳生产线相比,酸乳生产线受杂菌污染程度明显降低,随后多项研究证明,发酵过程中次级代谢产物类细菌素物质占据主导作用[13]。Arokiyamary等[14]从干酪中分离得到一株乳酸杆菌,其所产细菌素可抑制金黄色葡萄球菌、蜡样芽孢杆菌、伤寒杆菌等多种致病菌。Bizani等[15]发现,4 ℃时蜡样菌素8A可导致牛乳及干酪中的单核细胞增生李斯特菌生长对数期滞后。Ghalfi等[16]发现,猪肉在冷藏过程中乳酸弯曲杆菌素和精油对腐败菌的抑制起协同作用,二者均可显著抑制单核细胞增生李斯特菌生长。刘国荣等[17]比较320 AU/g细菌素与超高压处理对切片火腿的保鲜效果,对火腿的色泽、质构、理化性质等因素进行评估,发现二者联合作用防腐保鲜效果最佳,可延长切片火腿货架期。Martínez-Viedma等[18]发现,在苹果酒中添加伏尔加霉素AS-48可控制片球菌的产酸量,进一步研究发现,此类细菌素主要通过钝化目标菌的细胞膜活性进而发挥抑菌活性。除上述功能特性,细菌素还可与某些高分子物质结合,形成具备抑菌活性的食品包材。 Jin等[19]通过扫描电子显微镜和激光共聚焦显微镜发现,Nisin颗粒均匀分布在聚乳酸基体表面,Nisin可显著抑制培养基和液体蛋清中单核细胞增生李斯特菌的生长。综上,细菌素在食品领域作为生物防腐抑菌剂具有广阔的应用前景。
1.2 在生物医药领域中的应用
幽门螺杆菌侵染是导致胃肠道溃疡的主要因素,其可吸附于消化道黏膜及相应受体蛋白并释放毒性因子,引发非特异性炎症。细菌素可形成屏障保护层,占据细胞外膜吸附位点,进而阻碍致病菌侵入;还可刺激机体产生特异性与非特异性免疫物质,选择性抵御临床疾病中的靶向致病菌生长;又可作为潜在抗癌剂,针对目标癌细胞释放毒力[20];此外,其还对医疗手术后期易感染型细菌具有很强的破坏力,且通常不会产生耐药性。也有研究发现,乳酸菌素在调节肠道微生态、增强机体免疫力、预防幽门螺杆菌侵染等方面效果明显。临床上,细菌素可缓解因消化道不适引起的腹胀、腹泻等疾病,还可添加到口腔漱口液中起预防龋齿作用,医疗领域多采用基因工程技术挖掘及修饰细菌素编码基因,从而提高细菌素产量。
1.3 在畜牧养殖及饲料研发中的应用
由于抗生素及激素的不合理使用或滥用,选择乳酸菌细菌素替代传统使用的抗生素更具吸引力。动物饲料中细菌素的添加既能提高动物免疫力,还能提高精子存活率,但目前我国细菌素在动物饲料中的应用仅限于理论研究,安全性还有待考察[21]。有研究者发现,在肉鸡养殖中,投喂按合适比例混合的抗生素和细菌素可取得良好效果。Mccormick等[22]研究发现,将乳酸菌素Lacticin3147涂抹到奶牛乳头可减少革兰氏阳性菌的滋生,在一定程度上可缓解乳房炎等症状。Bhunia等[23]在研究小鼠和兔子的免疫功能时发现,细菌素Pediocin AcH对动物机体无任何不良反应。Mota-Meira等[24]发现,将细菌素分离纯化后并浓缩,通过静脉注射可有效避免动物患感染性疾病。因此研究细菌素与消化道优势菌群的关系具有重要意义。
1.4 在调节肠道菌群结构中的应用
在研究细菌素调节肠道菌群的具体机制时既要明确其对目标致病菌的抑制效果,也要关注其对肠道菌群结构的影响[25]。LÜ Xinran等[26]通过扫描电子显微镜发现,从鲫鱼肠道分离出的植物乳杆菌FGC-12所产的细菌素可使目标副溶血性弧菌胞内电导率增大,破坏胞内物质平衡。Dabour等[27]对小鼠进行体外实验时发现,片球菌素Pediocin PA-1在不影响小鼠肠道菌群结构的基础上可有效抑制单核细胞增生李斯特菌感染。由此推测,乳酸菌细菌素可靶向拮抗机体内致病菌,且不破坏宿主肠道菌群平衡。Piewngam等[28]验证了细菌素可以通过阻断金黄色葡萄球菌的agr群体感应信号传导系统,进而干扰其在肠道的定植能力。以上报道为研究乳酸菌细菌素是否通过切断靶向菌的信号传导进而介导肠道微生态提供了新思路。
2 生物信息学技术在乳酸菌代谢研究中的应用
生物信息学是以计算机科学和应用数学为基础理论,将生命科学领域测得的生物信息经搜索比对,分析相关的核酸信息和蛋白结构基因,从而定位功能基因的一门科学[29]。生物信息学在处理、整合和分析海量“组学”数据方面起着关键作用,利用数据库分析出重要的调控基因或蛋白,然后进行有针对性的实验验证,探索代谢和调控网络。目前建立了一类细菌素基因组挖掘工具,一种基于细菌素数据库和Motif数据库的网络服务器BAGEL,它可以识别DNA序列中假定的细菌素开放阅读框(open reading frame,ORF)[30]。此外,该服务器还考虑了基因组背景,即对于每种潜在的细菌素编码ORF,都会分析基因组中周围区域的序列,寻找编码参与生物合成、运输、调节或免疫相关蛋白的基因。生物信息学在食品领域的主要应用包括:功能性菌株的全基因组测序,原核转录组、比较转录组和翻译组等RNA水平上的高通量测序,靶向代谢组学测序,无标记或iTRAQ等定量蛋白组学分析。Hansen[31]基于生物信息学技术发现,在嘌呤缺失条件下,乳酸乳球菌MG1363中27 个基因的表达发生显著变化。Guillot等[32]对乳酸乳球菌1403的细胞质蛋白进行二维凝胶电泳分析,通过肽质量指纹图谱鉴定了230多个氨基酸位点,这项研究使得在蛋白质组水平上描述与重要生理过程和工艺特性相关的细胞通路(糖酵解、发酵、核苷酸代谢、蛋白质水解、脂肪酸和肽聚糖合成)成为可能。截止目前,被普遍使用的数据库主要为美国国家生物技术信息中心(NCBI)的GenBank数据库[33]。除此以外,欧洲生物信息学研究所的EMBL核酸序列数据库和日本信息生物学中心的DDBJ数据库也被大家熟知。应激性环境在乳酸菌的贮存及使用过程中经常存在,通过比较基因组学方法可以预测与胁迫相关的转录调控因子,初步猜测其结合位点和调控 基因[34]。此外,采用转录组和蛋白质组等多组学联合对差异表达基因进行功能注释已成为未来分析趋势。
3 转录组测序技术在细菌素合成研究中的应用
3.1 转录组测序技术
1995年,Velculescu等[35]提出转录组的概念,即从整体转录水平分析不同细胞或组织在特定条件下所转录的所有RNA,从而揭示生物学通路和调控分子机制 (图1)。该技术能检测到编码蛋白的RNA及非编码RNA,如rRNA、tRNA、sRNA、snoRNA等[36]。转录组学通常包含2 种研究技术:1)基于杂交的微阵列基因芯片技术;2)基于测序的转录组测序技术。前者利用样品与探针的杂交信号获取序列信息,但样品制备较复杂且特异性低,因此在应用上受限[37]。后者是目前应用分析的主要手段,又可分为第1代测序技术、第2代测序技术和第3代测序技术。其中第2代测序技术(RNA-Seq)将提取的样品mRNA经富集过滤、除去rRNA及随机的片段化处理最终反转为cDNA,构建文库再使用高通量测序仪上机测序。将测序结束后得到的海量数据与参考基因组比对,即可从基因表达水平定量分析转录本的遗传信息。通过差异表达倍数筛选出差异基因,对其进行GO(Gene Ontology)功能注释和KEGG通路富集分析,进而推测其功能特性[38]。第3代测序技术采用单分子实时测序,无需聚合酶链式反应(polymerase chain reaction,PCR) 扩增,且所需样品少。美国PacBio公司的SMRT-Seq技术在第3代测序中最具代表性,但由于技术受限且测序价格昂贵,因此还有待完善[39]。
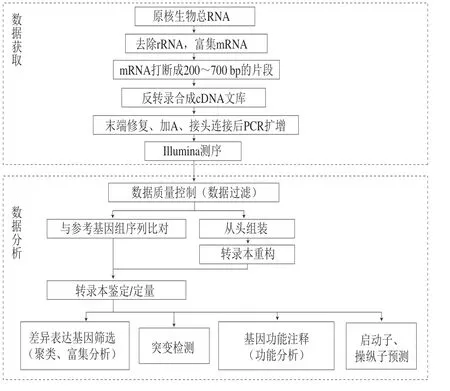
图1 转录组测序和分析流程示意图Fig. 1 Flow chart of transcriptomic sequencing and analysis
3.2 转录组学在乳酸菌生长及代谢调控研究中的应用
苯乳酸(phenyllactic acid,PLA)作为抗菌剂、药物和塑料的合成前体,被广泛添加于各种发酵食品。PLA是乳酸菌胞体中苯丙氨酸分解代谢的产物,其生物合成与乳酸脱氢酶密切相关。2019年,Sun Daqing等[40]为探究代谢产物与发酵特性之间的联系,对可产生PLA的植物乳杆菌LY-78进行全基因组及转录组测序,基因组和转录组的分析结果揭示了该菌株PLA生物合成的可能途径、操纵子和关键基因。总体而言,这项研究证明PLA可以作为乳酸菌苯丙氨酸合成代谢的副产物,同时为阐明PLA生物合成机理提供了新的依据,并为未来PLA的生物合成及应用提供了新的候选基因和研究策略。Chun等[41]通过泛基因组、转录组和代谢物分析,研究嗜盐四联球菌的基因组和代谢多样性。嗜盐四联球菌DSM 20339的转录组结果表明,高盐条件下菌株可通过异乳酸途径产生更多的乙酸盐。尽管从嗜盐四联球菌基因组中鉴定出与甜菜碱、脯氨酸、谷氨酸、谷氨酰胺、胆碱和瓜氨酸代谢相关的基因,但转录组和代谢物分析表明,甜菜碱是高盐含量下主要的相容性溶质,同时推测瓜氨酸在渗透胁迫中也起重要作用。干酪中牛乳蛋白的分解代谢是影响最终产品感官特性的一条重要途径,Pangallo等[42]采用转录组学研究乳酸菌蛋白水解相关基因在干酪成熟过程中的转录活性,研究发现,编码细胞被膜蛋白酶的基因prtP、编码二肽基氨基肽酶的基因pepX、编码氨肽酶的基因pepN和编码支链转移酶的基因bcaT均有利于牛乳蛋白产生挥发性芳香化合物。
3.3 转录组学在乳酸菌环境胁迫应激研究中的应用
Hagi等[43]利用RNA-Seq测序技术对肠球菌有氧应激反应基因进行分析,研究发现,丙酮酸脱氢酶复合物合成相关基因表达明显上调,转录调节因子spx和编码UvrABC系统蛋白的基因表达也上调。Wang Xiuwen等[44]对产乳酸菌株凝结芽孢杆菌P38进行比较转录组分析,以研究其在2-糠醛胁迫下和不胁迫时培养的表达特征。结果表明:在2-糠醛胁迫下,凝结芽孢杆菌P38的生长速率降低,其中740 个基因表达上调,540 个基因表达下调;KEGG通路富集分析显示,2-糠醛胁迫对9 条通路有极显著影响(P<0.01),其中糖酵解/糖异生途径中关键基因的下调及三羧酸循环中相关基因的上调表明, 2-糠醛胁迫对乳酸发酵有负向影响;此外,2-糠醛胁迫下7 个醇脱氢酶基因和8 个短链脱氢酶/还原酶基因的表达被诱导,推测这些基因参与调节糠醛耐受性。Diez等[45]对乳酸乳球菌的转录组结果进行分析,认为在乙醇胁迫下,精氨酸脱亚胺酶途径被激活,并阐述了乳酸乳球菌NZ9700对乙醇的分子耐受机制;通过DNA微阵列全局转录组分析发现,该菌株对培养基中2%的乙醇具有适应性,且67 个基因的表达发生显著变化,其中精氨酸脱氨酶途径中参与精氨酸降解的基因显著上调,达20~40 倍。赵山山[46]对盐耐受时植物乳杆菌ST-III的RNASeq结果进行分析,发现参与氨基酸转运、胞内离子平衡、碳水化合物代谢和DNA损伤修复等基因的转录水平发生显著变化,推测上述基因对抵御盐胁迫起重要作用。 Arnold等[47]通过转录组测序技术发现,模拟胃肠道应激下不同菌株的基因表达谱有所差异,其中鼠李糖乳杆菌AMC143暴露于碱性环境时生长受到抑制,荧光定量PCR结果显示,编码胆盐水解酶的基因bsh表达量有所下降。综上所述,将微生物学与转录组学结合可进一步阐明细菌对外界胁迫的应激机制。
4 结 语
由于调控细菌素合成基因的多样性及其调控机制的复杂性,目前关于植物乳杆菌细菌素合成机制的研究相对缺乏,利用转录组和蛋白质组等多组学技术挖掘植物乳杆菌中重要功能基因,从转录水平、蛋白水平和代谢水平多层面研究细菌素合成系统的表达差异是未来的研究方向。利用转录组学等生物信息分析手段,进而提高植物乳杆菌细菌素产量的方法必将成为食品领域的研究热点,进而更好发挥生物保护发酵剂的生物防腐作用。

