OTUB2、TAZ在食管鳞癌中的表达水平及其临床意义
刘 丽,苏丽萍,路子扬,季 敏,苏天园,蒲红伟
(新疆医科大学1基础医学院,2第一附属医院病理科,3远程医学中心,4学科建设科,乌鲁木齐 830011)
食管癌(esophageal carcinoma)在全球恶性肿瘤发病率中位居第八位,死亡率位居第六位,是我国较常见的消化道恶性肿瘤之一,主要的组织学类型有鳞癌和腺癌,其中鳞癌占90%以上[1]。由于食管癌早期临床表现不典型,多数患者就诊时已达到晚期,导致临床治疗效果欠佳。因此,肿瘤标志物与治疗靶点对于临床上食管鳞癌的诊断和治疗具有重要意义。Otubain2(OTUB2)是卵巢肿瘤结构域(OTU)家族的成员,是一种二氢泛素化酶,最早发现于果蝇的卵巢肿瘤基因中,它能够参与机体的多种生物学活动[2-3],包括抑制病毒诱导干扰素调节因子3和NF-κB的活化[4]、提高人胰岛β细胞存活率[5]及促进DNA的损伤修复[6]等。有研究表明,OTUB2能够促进非小细胞肺癌[7]、甲状腺乳头状癌[8]、肝癌[9]的发展,在多种肿瘤组织中呈现出异常活跃状态。同时OTUB2能够与TAZ中的多聚泛素化链相互作用,使TAZ被激活,进而促进肿瘤的增殖、侵袭和迁移[10]。TAZ又称为WWTR1(含有WW结构域的转录调节因子1),位于Hippo信号通路的下游发挥核心效应,在食管鳞癌[11]、头颈部鳞癌[12]、喉鳞癌[13]等肿瘤中TAZ可以作为Hippo信号通路中的核心作用靶点参与肿瘤的发生及发展[14]。此外,TAZ介导的上皮-间充质转化(EMT)[15]在食管癌的发展进程中也有着一定的促进作用。
这两种因子在肿瘤中显示出异常的高活性,说明OTUB2与TAZ与肿瘤的发展有着密切联系。本研究旨在观察食管鳞癌(esophageal squamous cell carcinoma,ESCC)中OTUB2与TAZ的表达情况及其与ESCC的临床分期转移及预后之间的关系,探讨OTUB2、TAZ参与ESCC的发生、发展的可能机制,为ESCC的诊断与治疗提供参考。
1 资料与方法
1.1 一般资料收集新疆医科大学第一附属医院病理科2008-2018年收治的272例ESCC患者病理石蜡标本及临床病理信息。纳入标准:确诊为ESCC且术前均未接受过任何针对肿瘤的放、化疗等治疗;临床病理参数信息完整且组织标本经过HE染色及镜下观察确认细胞结构无损坏。排除标准:其他肿瘤转移等病例;脱片造成的无法判断免疫组化染色结果者。资料收集已通过新疆医科大学第一附属医院医学伦理委员会审批(K201909-03)。
1.2 生物信息学分析利用TCGA(The Cancer Genome Atlas)数据库检索分析OTUB2在食管癌中的表达情况;STRING数据库检索OTUB2与TAZ之间的互作关系。
1.3 试剂与方法Anti-OTUB2购自中国Bioss试剂有限公司,货号:bs6236R;Anti-TAZ购自英国ABCM公司,货号:ab242313;两者稀释浓度为1∶50,PBS、柠檬酸抗原修复液、山羊血清、过氧化氢、通用型二抗等均购自中国Bioss试剂有限公司。石蜡标本切片3μm,烤片2 h,温度60℃,石蜡切片经二甲苯、无水乙醇梯度脱蜡,柠檬酸抗原修复,封闭后加一抗Anti-OTUB2及Anti-TAZ 4℃孵育过夜;第二日加通用型二抗,DAB显色,苏木素染色,脱水、透明、封片,显微镜下观察并采集图像。
1.4 结果评定结果采用双盲法,由两位具有诊断资质的病理医师阅片,每张切片随机选取5个高倍视野。评分由染色强度及阳性细胞百分比综合计算得出,将染色强度分为未染色(无色)、弱染色(淡黄色)、中度染色(浅棕色)和强染色(深棕色),分别以0、1、2、3计分。阳性细胞标准包括:阳性细胞占比为0%计0分,占比0%~30%计1分,占比30%~60%计2分,占比60%~90%计3分。根据染色指数(SI)将染色结果记录为阴性0~3分,阳性4~9分,其中4~5分计为低度表达,6~7分计为中度表达,8~9分计为高度表达。染色指数=阳性细胞所占百分比×染色强度。
1.5 生存分析电话随访收集患者术后生存信息,以患者死亡为终点事件,随访时间截至2019年12月31日。根据OTUB2、TAZ蛋白在食管鳞癌组织中的表达情况绘制生存分析图,患者中位总生存时间(OS)是指最初诊断为ESCC至死亡或最终随访的时间。
1.6 统计学分析所有数据采用SPSS22.0统计软件进行分析。计量资料以均数±标准差(±s)表示,计数资料采用χ2检验。采用Fisher确切概率法对单个样本例数理论值<5的数据进行分析;关联性分析采用Spearman相关分析法,生存分析采用Kaplan-Meier分析法,以P<0.05为差异具有统计学意义。
2 结果
2.1 生物信息学分析OTUB2在食管癌中的表达情况及其与TAZ的相互作用关系通过TCGA数据库检索分析发现,OTUB2在多种肿瘤中高表达,而在食管癌组织中表达显著高于正常食管癌旁组织,见图1a、b;利用STRING数据库检索OTUB2与TAZ(WWTR1)发现,两者之间存在相互作用关系,见图1c。

图1 生物信息学分析OTUB2在食管癌中的表达及其与TAZ(WWTR1)之间的关系
2.2 OTUB2在ESCC中的表达情况及其与临床病理参数之间的关系OTUB2在癌旁组织中呈阴性表达,见图2a;在ESCC的细胞质和细胞核中OTUB2均呈现高表达,主要定位于细胞质,见图2b~d;在癌旁组织中OTUB2阳性表达率为12.1%,ESCC中OTUB2阳性表达率为87.9%,差异具有统计学意义(P=0.000)。OTUB2的阳性表达与肿瘤大小(P=0.000)、分化程度(P=0.000)有关,与性别(P=0.065)、年龄(P=0.457)、浸润深度(P=0.758)、TNM分期(P=0.362)和淋巴结转移(P=0.185)无关,见表1。

表1 OTUB2在ESCC中的表达及临床相关病理参数分析
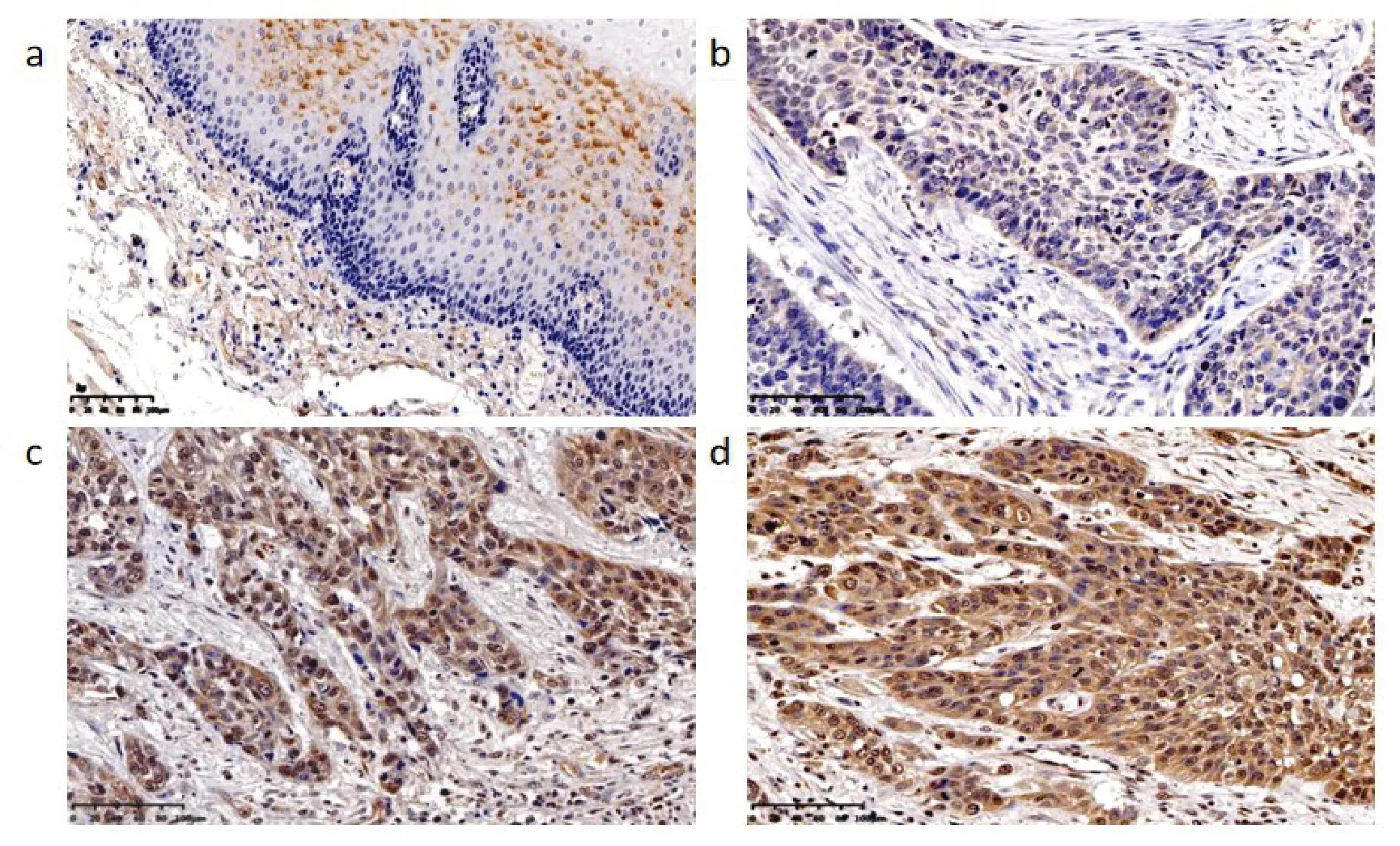
图2 OTUB2在ESCC组织及癌旁组织中的表达(×200)
2.3 TAZ在ESCC中的表达情况及其与临床病理参数之间的关系TAZ在癌旁组织中不表达,见图3a;在ESCC的细胞质和细胞核均呈阳性表达,主要定位于细胞核,见图3b~d。在癌旁组织中TAZ阳性表达率为14.1%,ESCC中TAZ阳性表达率为85.9%,差异有统计学意义(P=0.000)。TAZ的阳性表达与肿瘤大小(P=0.000)、分化程度(P=0.020)、浸润深度(P=0.000)、TNM分期(P=0.005)和淋巴结转移(P=0.023)有关,与性别(P=0.438)、年龄(P=0.795)无关,见表2。

图3 TAZ在ESCC组织及癌旁组织中的表达(×200)
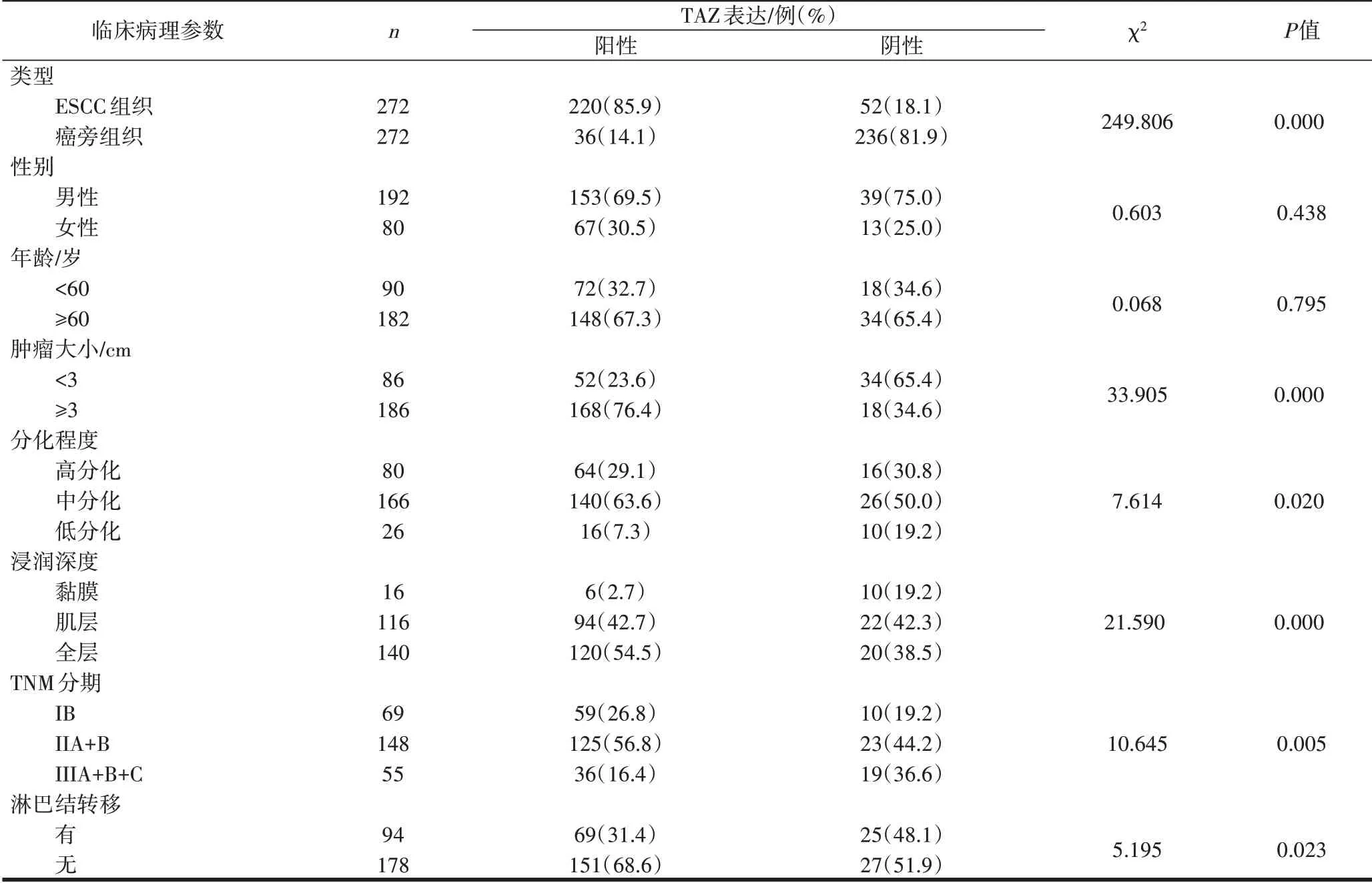
表2 TAZ在ESCC中的表达及临床相关病理参数分析
2.4 OTUB2、TAZ在ESCC发展中的相关性OTUB2、TAZ共同阳性表达的病例数为175例(64.3%),OTUB2阳性表达TAZ阴性表达29例(10.7%),OTUB2阴性表达TAZ阳性表达45例(16.5%),两者共同阴性表达23例(8.5%)。Spearman进行相关性分析显示,OTUB2与TAZ表达呈正相关(P=0.000,r=0.216)。
2.5 OTUB2、TAZ在ESCC中的表达与预后的关系生存分析结果表明,ESCC患者中OTUB2高表达组中位总生存时间(OS)为22个月,低表达组OS为30个月,差异具有统计学意义(P=0.042),见图4a;肿瘤直径≥3 cm的患者中,OTUB2高表达组OS值更短(P=0.032),见图4b。此外,分析结果发现,TAZ高表达组的OS值为23个月低于TAZ低表达组OS值28个月(P=0.033),见图4c;当肿瘤直径≥3 cm且TAZ高表达时,患者OS值较低(P=0.031),图4d,差异有统计学意义(P<0.05);在临床病理分期TNM I期和II期,TAZ的高表达在ESCC患者中倾向于较差的预后(P=0.016),见图4f;当肿瘤浸润全层以及存在淋巴结转移且TAZ高度表达时,OS值较短(P<0.05),见图4e、g。当OTUB2与TAZ同时为阴性表达时,OS值更长,患者的生存和预后最好,当两者中有一项为阳性表达或两者均为阳性表达时,OS值更短,患者生存率较低,预后较差,见图4h;当肿瘤直径≥3 cm且OTUB2与TAZ高表达时,患者生存率更低,预后亦越差,见图4i。以上结果均表明,OTUB2与TAZ的表达水平与食管鳞癌患者的预后密切相关。

图4 OTUB2、TAZ在ESCC中表达水平的Kaplan-Meier生存曲线
3 讨论
食管癌在全球恶性肿瘤的发病率及致死率中均位居前列,其恶性程度和侵袭转移能力通常与癌细胞自身增殖分化能力有着紧密联系,当抑癌基因和促癌基因表达失衡时可导致肿瘤发生、侵袭及转移等[16]。
OTUB2是一种去泛素化酶,可作为一种肿瘤干细胞和转移促进因子,有研究发现OTUB2在赖氨酸233上是聚-SUMO化的,而TAZ中可能存在一个能够与SUMO相互作用的结构域(SUMO-interacting motif,SIM),TAZ可通过该结构域与SUMO(small ubiquitinrelated modifier)化的OTUB2相结合而发挥效应[10]。OTUB2能够通过去泛素化酶的作用调控增殖细胞核抗原(PCNA)从而促进细胞生长增殖[17]。而TAZ在与细胞中的scribble(细胞极性决定因子)形成复合物抑制其原有的肿瘤相关分子生物学功能;在肿瘤细胞中由于scribble被大量破坏,或Hippo通路中上游核心激酶异常,使通路中上游因子对TAZ的抑制作用解除,从而使TAZ具有肿瘤干细胞的特征和功能[18]。其参与肿瘤发展主要机制为在正常细胞生长过程中TAZ主要以磷酸化形式存在于细胞质中,当受到某些内外环境因素刺激时,可使其磷酸化减弱,去磷酸化增强,由细胞质转移至细胞核与核内的转录因子TEAD1-4结合从而促进肿瘤的发展。有资料表明,TAZ在多种肿瘤中呈现出异常的高活性,并且与肿瘤的迁移和侵袭能力密切相关,在非小细胞肺癌中沉默TAZ后能够显著降低癌细胞的增殖和侵袭转移能力[19];在食管鳞癌组织中,TAZ呈高表达且与患者预后呈负相关[12],这与本研究结果一致。
Zhang[10]等发现,OTUB2可作为一个重要的调制器调控TAZ的表达从而调控肿瘤的发生和发展,其可通过去泛素化作用结合和稳定TAZ,对TAZ有着一定的正向调节作用,该团队的研究发现OTUB2能够不依赖Hippo信号通路直接作用于TAZ从而促进肿瘤的增殖,当OTUB2过表达时可直接通过SUMO化稳定和结合TAZ使其激活,TAZ去磷酸化作用增强并且转移至细胞核与核内TEADs结合激活相应靶基因的转录和表达,进而促进肿瘤的发展,而对于OTUB2与TAZ在ESCC中的作用机制仍需更深入的研究。本研究利用生物信息学分析OTUB2在食管癌中的表达情况以及与TAZ的相互作用关系,应用免疫组织化学法检测分析OTUB2与TAZ在ESCC组织及癌旁组织中的表达水平及其相关性。结果表明,OTUB2和TAZ在ESCC组织的阳性表达率显著高于癌旁组织,并且与患者的临床参数及预后相关,差异具有统计学意义(P<0.05)。通过相关性分析得出,OTUB2与TAZ在ESCC中表达有关联性并呈正相关。生存分析结果表明,OTUB2与TAZ高表达组的ESCC患者OS明显短于低表达组(P<0.05)。由此可推断,OTUB2与TAZ可能参与了ESCC的发生、发展并有一定的促进作用。
综上所述,OTUB2、TAZ的蛋白表达水平与ESCC的发生、发展密切相关,但对于OTUB2与TAZ在ESCC组织中的具体作用机制仍需进一步深入研究与探索,这将为ESCC的早期发现与治疗提供新的治疗靶点。

