抗菌肽LL-37对大鼠背部皮瓣存活的影响△
何志湘,王九松,许云华,宋剑刚,贺 强
(南华大学附属南华医院手足外科,湖南衡阳 421002)
随意皮瓣因其使用方便灵活,被广泛应用于临床组织缺损的修复和重建,但随意皮瓣由于不含知名血管,皮瓣血液供应主要依靠蒂部皮肤及筋膜内的血管网,易发生皮瓣血液循环障碍和缺血再灌注损伤,造成皮瓣部分或全部坏死[1,2]。因此,改善皮瓣微循环、增加血运,减少炎性反应,对提高皮瓣的成活率至关重要。抗菌肽是一类由生物免疫系统产生的活性多肽,存在于上皮和免疫组织中,具有抗菌、抗病毒、抗肿瘤活性的特性,构成了机体先天性免疫系统的第一道防线[3,4]。LL-37 是人源抗菌肽 cathelicidin家族的一员,表达分泌于人体内多种上皮细胞、免疫细胞、体液和创伤分泌物等处,能够发挥抗微生物活性,参与机体免疫调节,还可作用于血管内皮细胞和上皮细胞,刺激血管生成和促进损伤修复[5~7]。然而,LL-37是否能够促进随意皮瓣的存活目前鲜有报道。因此,本研究拟通过研究不同剂量抗菌肽LL-37干预对大鼠随意皮瓣成活的影响,探讨其作用机制。
1 材料与方法
1.1 实验动物与分组
健康雄性Sprague–Dawley(SD)大鼠75只,6~7周龄,体质量(220.35±20.06)g,由湖南嘉泰实验动物有限公司提供,动物许可证号:SCXK(湘)2019-0003。随机分为假手术组、模型组、LL-37低剂量组(0.25 mg/kg)、LL-37中剂量组(0.5 mg/kg)和 LL-37高剂量组(1.0 mg/kg),每组15只。
1.2 模型建立与药物处理
假手术组仅切开皮瓣,立即将原位缝合,不结扎知名血管;而其它4组采用改良“McFarlane flap”法制作大鼠随意皮瓣模型[8]。术后2 h,LL-37低、中、高剂量组大鼠分别给予0.25 mg/kg、0.5 mg/kg和1.0 mg/kg LL-37腹腔注射,正常对照组和模型组大鼠注射等量生理盐水,1次/d,连续7 d。
1.3 评价指标
1.3.1 大体观察
术后1~7 d每天肉眼观察各组大鼠皮瓣色泽、组织弹性、质地和坏死范围等情况。术后7 d对各组大鼠皮瓣进行摄像拍照,通过Image-Pro plus 6.0软件分析系统测定皮瓣成活面积和总面积并计算皮瓣成活率,皮瓣存活率=成活面积/总面积×100%。
1.3.2 组织学观察与计量
术后第7 d切取大鼠皮瓣距尾端3~4 cm处组织,10%多聚甲醛溶液中固定48 h,石蜡包埋;制3 μm切片,HE染色,于显微镜下观察。另组切片按照免疫组化试剂盒说明书进行CD31染色,阳性染色呈棕黄色。先将染色切片置于低倍镜下确定血管密度最高区域,再在高倍镜下选取3个密度较多视野进行微血管计数并取平均值,计算出单位面积微血管数目 (microvascular density,MVD)(个/mm2)。
1.3.3 应激与炎性产物检测
选取部分皮瓣组织称重后用超声匀浆机制成10%匀浆液,于4℃下10 000 r/min离心20 min后取上清液,按照试剂盒说明书步骤进行操作,采用比色法检测皮瓣组织中SOD活性和MDA含量。术后第7 d于皮瓣蒂部抽取腹壁浅动脉血液1.5 ml,4 000 r/min条件下离心15 min分离血清,按照ELISA试剂盒说明书进行操作,用酶标仪在450 nm波长处测定各孔的光密度(optical density,OD)值,根据标准曲线计算各组大鼠血清中TNF-α和IL-6含量。
1.3.4 VEGF-A和HIF-1α的mRNA检测
取各组大鼠皮瓣组织在冰上匀浆器中剪碎,加入Trizol研磨混匀提取样本总RNA,紫外分光光度计测定各样本总RNA浓度。取2 μg总RNA采用逆转录试剂盒合成cDNA,以cDNA为模板进行qRT-PCR扩增。反应体系为:cDNA 2 μl,引物上下游各0.4 μl,REALSYBR Mixture (×2) 10 μl,水 7.2 μl;反应条件为:95℃预变性15 s,95℃变性10 s,60℃退火20 s,72℃延伸32 s,40个循环。以GAPDH为内参,采用2-△△Ct法计算VEGF-A和HIF-1α的mRNA相对表达量。
1.3.5 VEGF-A和HIF-1α的蛋白表达水平检测
取各组大鼠皮瓣组织剪碎匀浆,加入RIPA裂解液提取总蛋白,采用BCA法测定样品浓度,取等量蛋白进行凝胶电泳分离后,转印至PVDF膜上。用脱脂奶粉封闭1 h后,4℃孵育稀释后的一抗(VEGFA、HIF-1α和GAPDH,1:1 000)12 h。次日清洗后加入相应二抗孵育2 h。洗涤后,加入显影液显影成像。使用GAPDH抗体进行内参校正,曝光图像用Image J软件对条带灰度值进行分析,用目的蛋白与GAPDH灰度值比表示目的蛋白的相对表达量。
1.4 统计学方法
2 结果
2.1 大体观察
术后第1 d,除假手术组外,其余各组皮瓣均出现不同程度的肿胀,皮瓣远端颜色变青;术后第3 d,皮瓣坏死与成活区域开始出现,远段出现面积不等的暗黑色坏死区,坏死部分颜色多为红褐色伴有瘀血;术后第7 d,皮瓣中远端坏死部分趋于融合,有黑色痂壳出现,皮瓣远段不同面积坏死痂壳形成,成活与坏死区界限清楚。模型组和LL-37低剂量组皮瓣中远端及远端颜色发黑,表面有痂壳形成,无弹性,针刺无出血不易剥离,肉膜下炎性分泌物较多;LL-37中剂量组和LL-37高剂量组皮瓣远端颜色发黑,表面有痂壳,无弹性。中远端颜色淡红,表面无痂壳形成,弹性较好,针刺皮瓣出血较多,肉膜下炎性分泌物少。皮瓣存活率如图1所示,与假手术组比较,模型组大鼠皮瓣成活率显著降低,差异具有统计学意义(P<0.05);与模型组比较,LL-37的作用呈剂量依赖型改变,中剂量组和LL-37高剂量组皮瓣成活率均显著增加,差异具有统计学意义(P<0.05),LL-37低剂量组无显著变化,差异无统计学意义(P>0.05)。
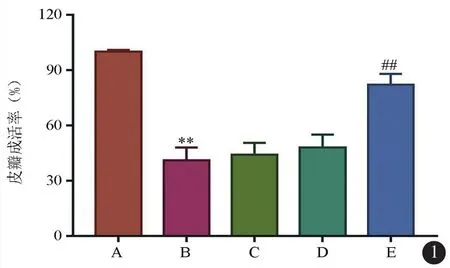
图1 5组动物皮瓣成活率比较 A:假手术组;B:模型组;C:LL-37低剂量组;D:中剂量组;E:高剂量组,与假手术组比较**P<0.001,与模型组比较##P<0.001
2.2 组织学观察与计量
组织学观察如图2所示,假手术组大鼠皮瓣组织结构正常,纤维组织排列整齐,血管通畅,未见结缔组织水肿和炎性细胞浸润;模型组皮瓣组织结构破坏,可见毛细血管增生,结缔组织明显水肿伴有大量炎性细胞浸润;LL-37低剂量组皮瓣组织结构破坏也较为严重,水肿明显伴有炎性细胞浸润;LL-37中剂量组皮瓣组织结构恢复,轻微水肿伴有部分炎性细胞浸润;LL-37高剂量组皮瓣组织结构较为完整,可见完整毛细血管,未见明显结缔组织水肿和炎性细胞浸润。MVD((个/mm2)测量结果:假手术组(42.17±3.09),模型组 (15.77±2.40),低剂量组 (17.35±3.08),中剂量组(18.49±2.73),高剂量组(31.05±2.99)。与假手术组比较,模型组大鼠MVD值显著降低(P<0.05);与模型组比较,LL-37的作用呈剂量依赖型改变,中剂量组和高剂量组MVD值显著增加(P<0.05),低剂量组无显著变化(P>0.05)。
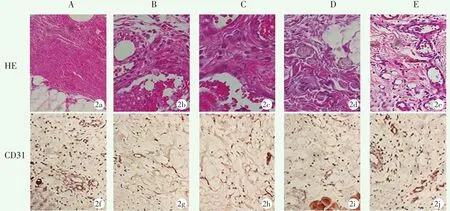
图2 各组大鼠皮瓣组织病理学观察 A:假手术组 B:模型组 C:LL-37低剂量组 D:中剂量组 E高剂量组 2a~2e:皮瓣组织HE染色(×200) 2a:大鼠皮瓣组织结构正常,纤维组织排列整齐 2b:皮瓣组织结构破坏,毛细血管增生,伴有大量炎性细胞浸润 2c:皮瓣组织结构破坏较为严重,伴有较多炎性细胞浸润 2d:皮瓣组织结构恢复,轻微水肿伴有部分炎性细胞浸润 2e:皮瓣组织结构较为完整,基本未见炎性细胞浸润 2f~2j:皮瓣组织CD31免疫组织化学染色观察(×400) 2f:棕黄色部分较多 2g:可见零散的棕黄色部分 2h:可见部分棕黄色部分 2i:可见较多棕黄色部分 2j:可见大量棕黄色部分
2.3 应激与炎性产物检测
检测结果见表1,与假手术组比较,模型组大鼠皮瓣组织中SOD活性显著降低,MDA含量显著增加,TNF-α和IL-6含量显著上升,差异有统计学意义(P<0.05)。与模型组比较,LL-37的作用呈剂量依赖型改变,中剂量组和高剂量组大鼠皮瓣组织中SOD活性显著增加,MDA含量显著降低,TNF-α和IL-6含量显著降低(P<0.05);低剂量组上述指标变化无统计学意义(P>0.05)。
表1 5组动物应激与炎性产物检测结果(±s)与比较

表1 5组动物应激与炎性产物检测结果(±s)与比较
images/BZ_53_205_885_502_951.pngimages/BZ_53_502_885_819_951.pngimages/BZ_53_819_885_1133_951.pngimages/BZ_53_1133_885_1453_951.pngimages/BZ_53_1453_885_1781_951.pngimages/BZ_53_1781_885_2102_951.pngSOD(U/mg)33.12±2.2018.57±1.3719.05±3.0330.06±2.3937.77±2.18<0.001images/BZ_53_205_752_502_818.pngimages/BZ_53_502_752_819_818.pngimages/BZ_53_819_752_1133_818.pngimages/BZ_53_1133_752_1453_818.pngimages/BZ_53_1453_752_1781_818.pngimages/BZ_53_1781_752_2102_818.pngimages/BZ_53_2102_752_2276_818.pngimages/BZ_53_2102_885_2276_951.pngimages/BZ_53_205_1017_502_1084.pngTNF-α (pg/ml)images/BZ_53_502_1017_819_1084.png44.36±5.05images/BZ_53_819_1017_1133_1084.png177.97±9.11images/BZ_53_1133_1017_1453_1084.png170.06±8.23images/BZ_53_1453_1017_1781_1084.png112.27±6.00images/BZ_53_1781_1017_2102_1084.png89.58±3.30images/BZ_53_2102_1017_2276_1084.png<0.001
2.4 VEGF-A和HIF-1α的mRNA和蛋白检测
各组VEGF-A和HIF-1α的mRNA和蛋白检测结果见表2,与假手术组比较,模型组大鼠皮瓣组织中VEGF-A和HIF-1α的mRNA与蛋白表达水平均显著降低,差异具有统计学意义(P<0.05)。与模型组比较,LL-37的作用呈剂量依赖型改变,中剂量组和高剂量组大鼠皮瓣组织中VEGF-A和HIF-1α的mRNA和蛋白表达水平均显著增加(P<0.05),低剂量组变化无统计学意义(P>0.05)。
表2 VEGF-A和HIF-1α的mRNA和蛋白检测结果(±s)与比较

表2 VEGF-A和HIF-1α的mRNA和蛋白检测结果(±s)与比较
images/BZ_53_204_1715_531_1781.pngimages/BZ_53_531_1715_843_1781.pngimages/BZ_53_843_1715_1134_1781.pngimages/BZ_53_1134_1715_1455_1781.pngimages/BZ_53_1455_1715_1776_1781.pngimages/BZ_53_1776_1715_2096_1781.pngVEGF-Aimages/BZ_53_204_1582_531_1649.pngimages/BZ_53_531_1582_843_1649.pngimages/BZ_53_843_1582_1134_1649.pngimages/BZ_53_1134_1582_1455_1649.pngimages/BZ_53_1455_1582_1776_1649.pngimages/BZ_53_1776_1582_2096_1649.pngimages/BZ_53_2096_1582_2276_1649.pngimages/BZ_53_2096_1715_2276_1781.png0.67±0.03 0.50±0.030.26±0.030.48±0.02 0.25±0.03<0.001images/BZ_53_204_1848_531_1914.pngimages/BZ_53_531_1848_843_1914.pngimages/BZ_53_843_1848_1134_1914.pngimages/BZ_53_1134_1848_1455_1914.pngimages/BZ_53_1455_1848_1776_1914.pngimages/BZ_53_1776_1848_2096_1914.pngimages/BZ_53_2096_1848_2276_1914.pngimages/BZ_53_204_1980_531_2047.png蛋白表达水平mRNA表达水平images/BZ_53_531_1980_843_2047.png1.01±0.03images/BZ_53_843_1980_1134_2047.png0.32±0.03images/BZ_53_1134_1980_1455_2047.png0.33±0.04images/BZ_53_1455_1980_1776_2047.png1.32±0.10images/BZ_53_1776_1980_2096_2047.png3.41±0.14images/BZ_53_2096_1980_2276_2047.png<0.001
3 讨论
多项研究显示,LL-37在促进组织损伤修复及诱导血管生成方面具有重要作用[9,10]。Carretero 等[11]研究发现,LL-37在体外可通过诱导皮肤表皮细胞株迁移表型改变,活化黏附相关激酶,促进细胞的迁移能力;而对创面手术后的大鼠给予外源性LL-37干预后,创面肉芽组织形成和上皮再生速度加快。Koc⁃zulla等[12]研究也发现,敲除LL-37基因的大鼠受到创伤后新生血管减少。推测LL-37可能通过促进血管内皮细胞增殖来诱导新生血管形成,说明LL-37介导的血管再生是体内皮肤创伤新生血管形成的重要环节,再次强调了LL-37在创伤修复中的巨大应用潜力。
本研究采用改良“McFarlane flap”法建立大鼠随意皮瓣模型,结果显示,模型组大鼠皮瓣成活率显著低于假手术组,提示模型构建成功。而LL-37中剂量和高剂量干预组的皮瓣成活率较模型组显著增加,同时HE病理染色结果显示,皮瓣组织结构较为完整,皮下组织炎症状况较轻,有新生血管形成,这些均有利于创面愈合[13],说明LL-37确能提高大鼠背部随意皮瓣的存活率,利于伤后上皮重建。
氧化应激是皮瓣血液供应不足、皮瓣缺血再灌注损伤的重要机制,可通过氧自由基进一步加重组织损伤[14]。组织的炎症反应和损伤修复对移植后的皮瓣存活率影响巨大,减轻组织损伤的炎性反应有利于创伤愈合,促进移植皮瓣成活[15]。本研究结果显示,模型组大鼠皮瓣组织中SOD活性降低,MDA含量增加,同时血清中TNF-α和IL-6含量均显著上升,说明皮瓣组织氧化应激损伤和炎性反应加重,与前人研究一致[16];而LL-37中剂量和高剂量干预组大鼠血清中TNF-α和IL-6含量及皮瓣组织中MDA含量明显下降,SOD活性增加,说明LL-37具有保护内源性SOD活性、促进自由基清除、抑制术后皮瓣组织炎性应激反应的作用。
VEGF-A能促进血管内皮细胞有丝分裂和增殖分化,加快皮瓣的毛细血管新生速度,是促进皮瓣成活的关键因子[17]。内环境中氧平衡是机体维持稳态的必要条件,当皮瓣缺血发生后,缺氧也会随之而来,HIF-1α是氧稳态主要的调节信号因子,也是影响低氧诱导的血管重建的重要因子,可通过激活下游信号通路,动员内皮细胞进入缺氧和无血管区,刺激内皮细胞增殖,从而实现血管再生[18]。而MVD代表单位面积内微血管数,能反映组织的血管生成活性[19]。刘焕兴等[13]研究发现,移植皮瓣的新生血管形成时,皮瓣组织中VEGF的表达水平和MVD均明显上升。本研究通过免疫组织化学染色检测并计数各组皮瓣MVD,同时检测皮瓣组织中VEGF-A和HIF-1α的表达水平,以评估新生血管情况。研究结果显示,模型组大鼠 MVD、组织中 VEGF-A、HIF-1α的mRNA和蛋白表达水平均显著降低,而LL-37中剂量和高剂量干预组相关指标均明显上调,说明LL-37能通过促进组织血管新生、改善皮瓣血运、增加皮瓣血管密度,从而提高皮瓣存活率。
综上所述,LL-37能有效刺激新生血管增生,减轻炎症反应,降低氧化应激水平和缺血皮瓣的坏死,促进随意皮瓣的成活,而LL-37的干预效果与剂量相关。

