下调LncRNA KCNQ1OT1对喉癌Hep-2细胞增殖、侵袭和上皮间质转化的影响*
徐辉聪 林振群 林智 吴育芝 熊俊成
(1.海口市第三人民医院耳鼻喉科,海南 海口 571100;2.海南省人民医院耳鼻咽喉头颈外科,海南 海口 570311;3.海南医学院基础医学与生命科学学院,海南 海口 571199)
喉癌是头颈部比较常见的恶性肿瘤,患者主要有声嘶、呼吸困难、咳嗽、吞咽困难、颈部淋巴结转移等症状[1]。近年来,喉癌患者通过手术、放射化疗及生物治疗等方式进行治疗,5年生存率得以提高。复发和转移是影响预后的主要因素,转移淋巴结数量越多,体积越大,5年生存率越低[2]。因此深入研究喉癌发生发展的分子机制能为患者的早期诊断和晚期预后提供理论基础。长链非编码RNA(Long non-coding RNA,lncRNA)是一类转录本长度超过200个核苷酸的RNA分子,不具有蛋白质编码功能。研究发现lncRNA参与基因表达的表观遗传调控、转录调控和转录后调控[3-4],还参与细胞生长、分化、凋亡等多种生物学过程[5]。有文献报道LncRNA KCNQ1OT1(KCNQ1OT1)在癌细胞中异常表达并参与了多种癌症的进展。如KCNQ1OT1在卵巢癌、结直肠癌细胞中过表达,并通过miR-217/ZEB1反馈回路促进了结直肠癌的迁移和上皮-间质转化(epithelial-mesenchymal transition,EMT)[6-7]。另有研究显示,KCNQ1OT1在鼻咽癌组织和细胞中呈低表达,过表达KCNQ1OT1可通过增加SEMA3B基因的表达,抑制鼻咽癌细胞的增殖和迁移[8]。然而,KCNQ1OT1在喉癌发展过程中的表达及作用机制尚不清楚。因此,本研究拟探究KCNQ1OT1在喉癌发展过程中的作用,为进一步阐明喉癌的进展机制提供理论基础。
1 材料与方法
1.1 主要材料 喉癌细胞Hep-2和正常喉上皮细胞HLEC购自北京清源浩生物科技有限公司;DMEM(Dulbecco's-modified Eagle′s medium)培养基、胎牛血清(FBS)购于美国Gibco公司;PrimeScriptTMRT reagent Kit with gDNA Eraser购于大连Takara公司;Goat anti-Rabbit IgG (H+L)-HRP、Goat anti-Mouse IgG (H+L)-HRP、E-cadherin、N-cadherin抗体购自美国圣克鲁斯生物科技有限公司;FAK、Src、MAPK、GAPDH抗体购自美国Abcam公司;FAK通路抑制剂Y15购自美国MCE公司;siRNA NC、KCNQ1OT1 siRNA、pcDNA-KCNQ1OT1、mimics NC、miR-138 mimics、inhibitor NC、miR-138 inhibitor质粒由北京擎科生物有限公司合成;点突变试剂盒和双荧光素酶活性检测试剂盒为中国赛默飞世尔科技公司产品。
1.2 方法
1.2.1 细胞培养 在含10% FBS的DMEM培养基中培养Hep-2细胞和HLEC细胞,于37 ℃、5% CO2培养箱中培养,细胞长满后,将细胞按相应密度接种于6孔板或12孔板中,用于后续试验。
1.2.2 细胞转染 取对数生长且状态良好的细胞,用胰酶消化,用含10% FBS的DMEM重悬细胞后,按照按1×105个/孔的密度铺于12孔板中,细胞密度汇合达65%时,更换细胞培养液为新鲜DMEM,细胞按转染质粒不同分组为:①siRNA NC组(转染50 nmol/L的阴性对照质粒)、KCNQ1OT1 siRNA组(转染50 nmol/L的KCNQ1OT1 siRNA质粒)。②Control组、Y15组(作用10 μmol/L的Y15)、inhibitor NC组(转染50 nmol/L的抑制剂对照组)、miR-138 inhibitor组(转染50 nmol/L的miR-138抑制剂)、miR-138 inhibitor+Y15组(转染50 nmol/L的miR-138抑制剂+10μmol/L的Y15)。③mimics NC组(转染50 nmol/L的模拟物对照)、miR-138 mimics组(转染50 nmol/L的miR-138模拟物)。④KCNQ1OT1 wt+mimics NC组(转染50 nmol/L的KCNQ1OT1野生型质粒+50 nmol/L的模拟物对照)、KCNQ1OT1 wt+miR-138 mimics组(转染50 nmol/L的KCNQ1OT1野生型质粒+50 nmol/L的miR-138模拟物)、KCNQ1OT1 mut+mimics NC组(转染50 nmol/L的KCNQ1OT1突变型质粒+50 nmol/L的模拟物对照)、KCNQ1OT1 mut+miR-138 mimics组(转染50 nmol/L的KCNQ1OT1突变型质粒+50 nmol/L的miR-138模拟物)。⑤pcDNA-3.1(+)+mimics NC组(转染50 nmol/L的pcDNA-3.1(+)质粒+50 nmol/L的模拟物对照)、pcDNA-KCNQ1OT1+mimics NC组(转染50 nmol/L的pcDNA-KCNQ1OT1质粒+50 nmol/L的模拟物对照)、miR-138 mimics+pcDNA-3.1(+)组(转染50 nmol/L的miR-138模拟物+50 nmol/L的pcDNA-3.1(+)质粒)、pcDNA-KCNQ1OT1+miR-138 mimics组(转染50 nmol/L的pcDNA-KCNQ1OT1质粒+50 nmol/L的miR-138模拟物)。⑥FAK wt+mimics NC组(转染50 nmol/L的FAK野生型质粒+50 nmol/L的模拟物对照)、FAK wt+miR-138 mimics组(转染50 nmol/L的FAK野生型质粒+50 nmol/L的miR-138模拟物)、FAK mut+mimics NC组(转染50 nmol/L的FAK突变型质粒+50 nmol/L的模拟物对照)、FAK mut+miR-138 mimics组(转染50 nmol/L的FAK突变型质粒+50 nmol/L的miR-138模拟物)。采用Tubfect转染试剂转染各组质粒,在37 ℃、5% CO2培养箱中继续培养48 h后收集各组细胞RNA样和蛋白样进行后续检测。
1.2.3 细胞增殖测定 取对数生长且状态良好的细胞,当细胞密度达95%时,用含10% FBS DMEM培养基重悬细胞,根据1×105个/mL的密度铺于96孔板中,细胞长到70%~80%时,采用Tubfect试剂转染质粒,每组重复8个,培养不同时间点后弃上清,PBS洗2次,每孔加10 μL CCK-8工作液,孵育4 h,使用酶标仪上读取各孔在450 nm处的吸光值(OD),并计算细胞活性。
1.2.4 细胞侵袭实验 将-20 ℃保存的matrigel取出,放在4 ℃条件下融化,用无FBS DMEM培养基稀释matrigel,使浓度为1 mg/mL,添加100 μL稀释后的matrigel于每个上室中,继续孵育5 h凝成胶状。细胞长满后,PBS洗两次,使用胰酶消化,用无FBS的DMEM培养基重悬细胞,将细胞悬液调整密度为5×105/mL,加入适量细胞悬液于Transwell小室中,下室中为10% FBS的DMEM,37 ℃、5% CO2培养箱继续培养36 h后,取出小室,PBS洗2次,多聚甲醛固定20 min,0.1%结晶紫染色15 min,随机选取5个视野细胞放在显微镜下观察并记数。
1.2.5 双荧光素酶报告基因活性检测 用miRanda和TargetScan分别预测KCNQ1OT1和FAK潜在靶基因,PCR扩增KCNQ1OT1 3′UTR片段及FAK 3′UTR片段,构建KCNQ1OT1 wt和FAK wt载体,再使用点突变试剂盒构建KCNQ1OT1和FAK突变体。使用Tubfect试剂转染各组重组质粒,通过双荧光素酶活性检测试剂盒检测细胞的荧光素酶活性。
1.2.6 实时荧光定量PCR(RT-qPCR) 采用Trizol试剂从细胞中提取总RNA,测定RNA浓度及纯度后,采用Takara反转录试剂盒将RNA反转成cDNA,按照42 ℃,2 min;37 ℃ 15 min,85 ℃ 5 s的程序进行,反转录得到的cDNA为模板,进行RT-qPCR,实验结果使用2-ΔΔCt法进行分析。
1.2.7 蛋白免疫印迹(Western blot)检测 按实验要求培养细胞一定时间后,将收取的蛋白样中加入RIPA裂解液,采用BCA试剂盒测定蛋白浓度,点样后进行SDS-PAGE凝胶电泳,按照80 V 30 min、110 V 2 h的程序进行,结束电泳后使用湿转仪器转移蛋白到PVDF膜上。结束转膜后,PVDF膜与50 g/L脱脂奶粉配制的封闭液在室温共孵育2 h,孵育结束后PVDF膜与特异性一抗(Ecadherin 1∶200、Ncadherin 1∶200、FAK 1∶1000、p-FAK 1∶2000、Src 1∶1500、p-Src 1∶2000、MAPK 1∶1000、p-MAPK 1∶1500、GAPDH 1∶3000)在4 ℃过夜孵育,TBST洗5次,PVDF膜与相应二抗在室温孵育2 h,TBST洗5次,每次5min,滴加ECL反应液后即可进行目的蛋白曝光。分析LncRNA KCNQ1OT1通过miR-138对Hep-2细胞内EMT相关蛋白Ecadherin、Ncadherin表达及其FAk/Src/MAPK通路的影响。
1.3 统计学分析 采用SPSS 19.0软件进行数据统计分析,至少取3次独立实验结果。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 沉默KCNQ1OT1抑制Hep-2细胞的增殖、侵袭和EMT Hep-2细胞中KCNQ1OT1的表达量明显高于HLEC细胞(P<0.01)(图1A);与siRNA NC组相比,KCNQ1OT1 siRNA组的KCNQ1OT1表达量明显降低(P<0.01)(图1B);KCNQ1OT1 siRNA组的细胞增殖能力低于siRNA NC组(P<0.05)(图1C);KCNQ1OT1 siRNA组细胞的侵袭数目明显低于siRNA NC组(P<0.01)(图1D、1E);与siRNA NC组相比,KCNQ1OT1 siRNA组E-cadherin蛋白表达量明显上升(P<0.01),N-cadherin蛋白表达量明显下降(P<0.01)(图1F、1G)。结果表明沉默KCNQ1OT1能够抑制Hep-2细胞的增殖、侵袭和EMT。
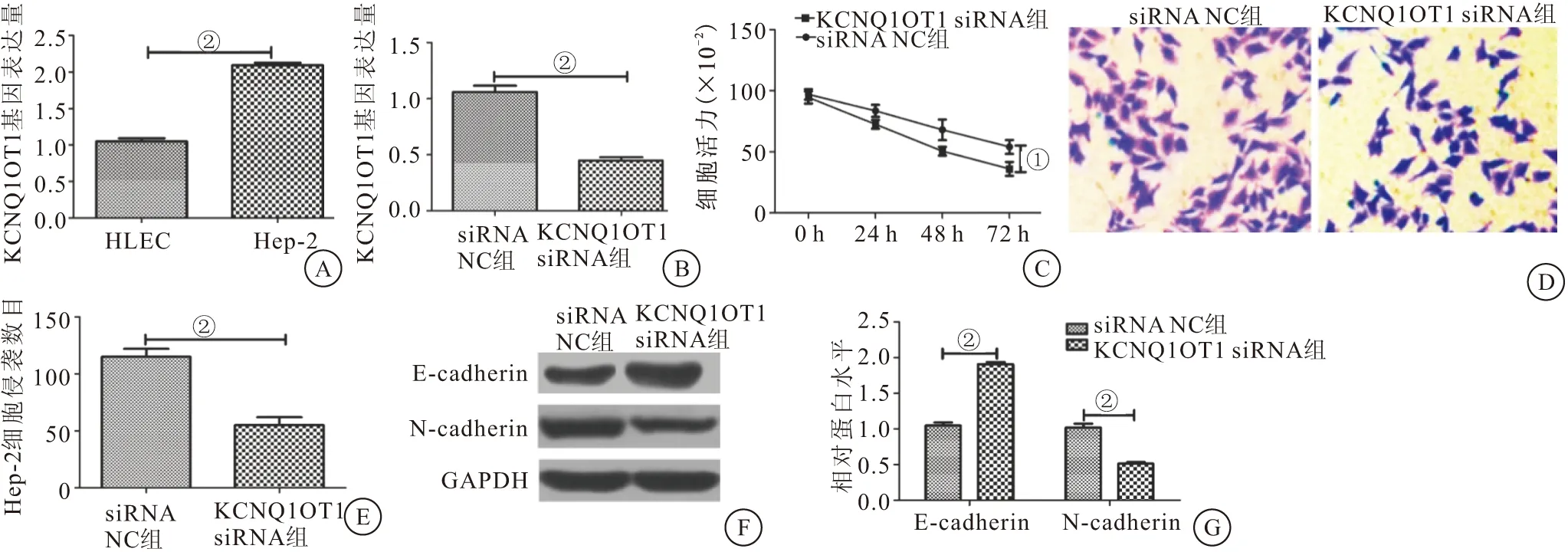
图1 沉默KCNQ1OT1抑制Hep-2细胞的增殖、侵袭和EMT(n=3)Figure 1 Silencing KCNQ1OT1 inhibited the proliferation,invasion and EMT of Hep-2 cells注:A.RT-qPCR检测KCNQ1OT1在Hep-2和HLEC细胞中的表达量;B.RT-qPCR检测干扰KCNQ1OT1后细胞中的KCNQ1OT1的表达量;C.CCK-8检测KCNQ1OT1对Hep-2细胞增殖的影响;D.细胞侵袭实验检测KCNQ1OT1对Hep-2细胞侵袭的影响;E.Hep-2细胞的侵袭数目;F.Western blot检测KCNQ1OT1对Hep-2细胞EMT的影响;G.E-cadherin、N-cadherin蛋白的相对表达量。两组比较,①P<0.05;②P<0.01
2.2 KCNQ1OT1和miR-138之间的靶向和调控关系 miRanda预测KCNQ1OT1和miR-138之间的结合位点(图2A)。当质粒携带KCNQ1OT1 3′UTR wt时,miR-138的荧光素酶活性显著降低(P<0.01),当质粒携带KCNQ1OT1 3′UTR mut时,miR-138的荧光素酶活性无变化(P>0.05)(图2B)。与siRNA NC组相比,KCNQ1OT1 siRNA组miR-138的表达量明显上升(P<0.01)(图2C)。结果表明KCNQ1OT1和miR-138之间存在负调控关系。
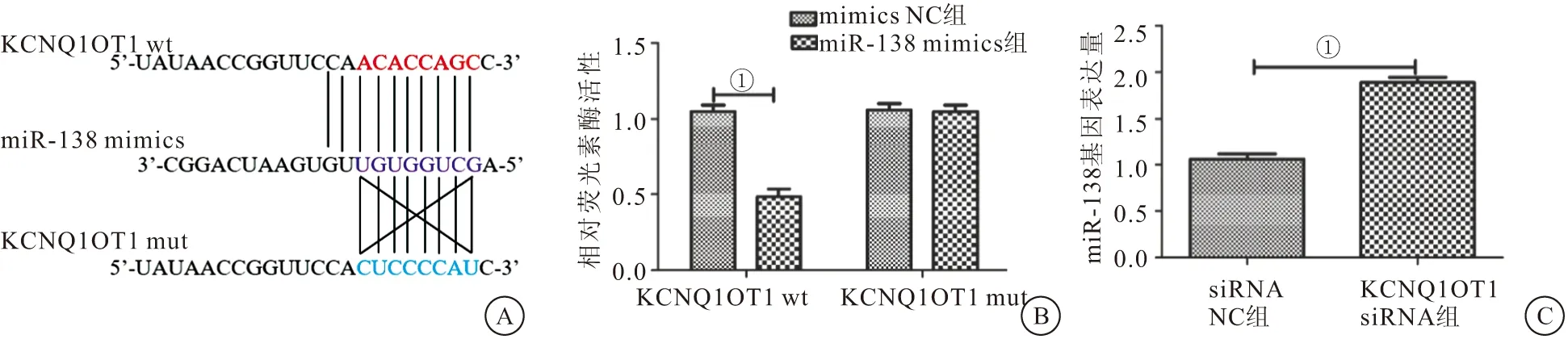
图2 KCNQ1OT1和miR-138之间的靶向和调控关系(n=3)Figure 2 Targeting and regulatory relationship between KCNQ1OT1 and miR-138注:A.miRanda预测KCNQ1OT1和miR-138之间的结合位点;B.荧光素酶表达量的定;C.RT-qPCR检测miR-138的表达量。两组比较,①P<0.01
2.3 沉默miR-138促进Hep-2细胞的增殖、侵袭和EMT Hep-2细胞中miR-138的表达量明显低于HLEC细胞(P<0.01)(图3A)。和inhibitor NC组相比,miR-138 inhibitor组的miR-138表达量明显下降(P<0.01)(图3B)。miR-138 inhibitor组的细胞增殖能力高于inhibitor NC组(P<0.05)(图3C)。miR-138 inhibitor组细胞的侵袭数目明显高于inhibitor NC组(P<0.01)(图3D、3E)。和inhibitor NC组相比,miR-138 inhibitor组的E-cadherin蛋白表达量下降(P<0.05),N-cadherin蛋白表达量明显上升(P<0.01)(图3F、3G)。结果表明沉默miR-138能够促进Hep-2细胞的增殖、侵袭和EMT。
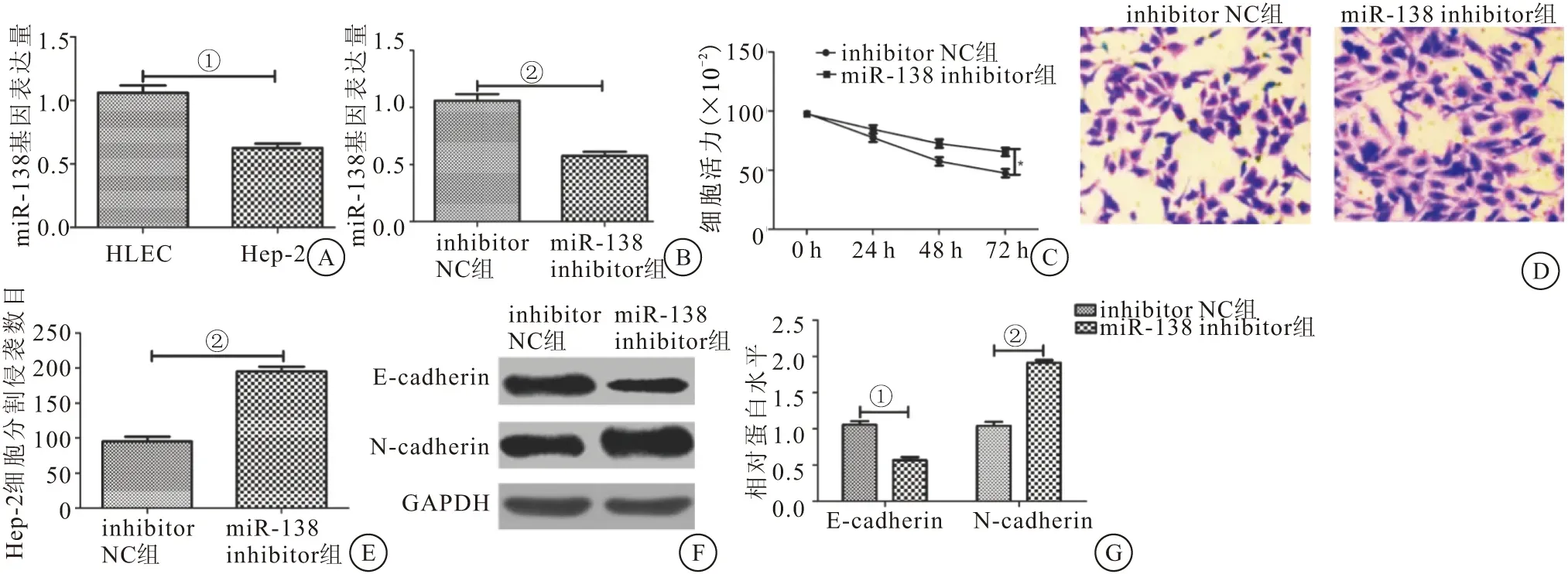
图3 沉默miR-138促进Hep-2细胞的增殖、侵袭和EMT(n=3)Figure 3 Silencing miR-138 promoted the proliferation,invasion and EMT of Hep-2 cells注:A.RT-qPCR检测miR-138在Hep-2和HLEC细胞中的表达量;B.RT-qPCR检测干扰miR-138后细胞中miR-138的表达量;C.CCK-8检测miR-138对Hep-2细胞增殖的影响;D.细胞侵袭实验检测miR-138对Hep-2细胞侵袭的影响;E.Hep-2细胞的侵袭数目;F.Western blot检测 miR-138对Hep-2细胞EMT的影响;G.E-cadherin、N-cadherin蛋白的相对表达量。两组比较,①P<0.05;②P<0.01
2.4 KCNQ1OT1通过miR-138调控Hep-2细胞的增殖、侵袭和EMT 与mimics NC组相比,miR-138 mimics组miR-138的表达量明显增加(P<0.01)(图4A)。与pcDNA-3.1(+)+mimics NC组相比,pcDNA-KCNQ1OT1+mimics NC组细胞增殖能力增加(P<0.05),细胞侵袭数目明显增加(P<0.01),E-cadherin蛋白表达量明显下降(P<0.01),N-cadherin蛋白表达量明显上升(P<0.01);与pcDNA-3.1(+)+mimics NC组相比,miR-138 mimics+pcDNA-3.1(+)组的细胞增殖能力下降(P<0.05),细胞侵袭数目减少(P<0.05),E-cadherin蛋白表达量明显上升(P<0.01),N-cadherin蛋白表达量明显下降(P<0.01);与miR-138 mimics+pcDNA-3.1(+)组相比,pcDNA-KCNQ1OT1+miR-138 mimics组的细胞增殖能力上升(P<0.05),细胞侵袭数目增加(P<0.05),E-cadherin蛋白表达量明显下降(P<0.01),N-cadherin蛋白表达量明显上升(P<0.01)(图4B~4G)。结果表明KCNQ1OT1通过miR-138调控Hep-2细胞增殖、侵袭和EMT。
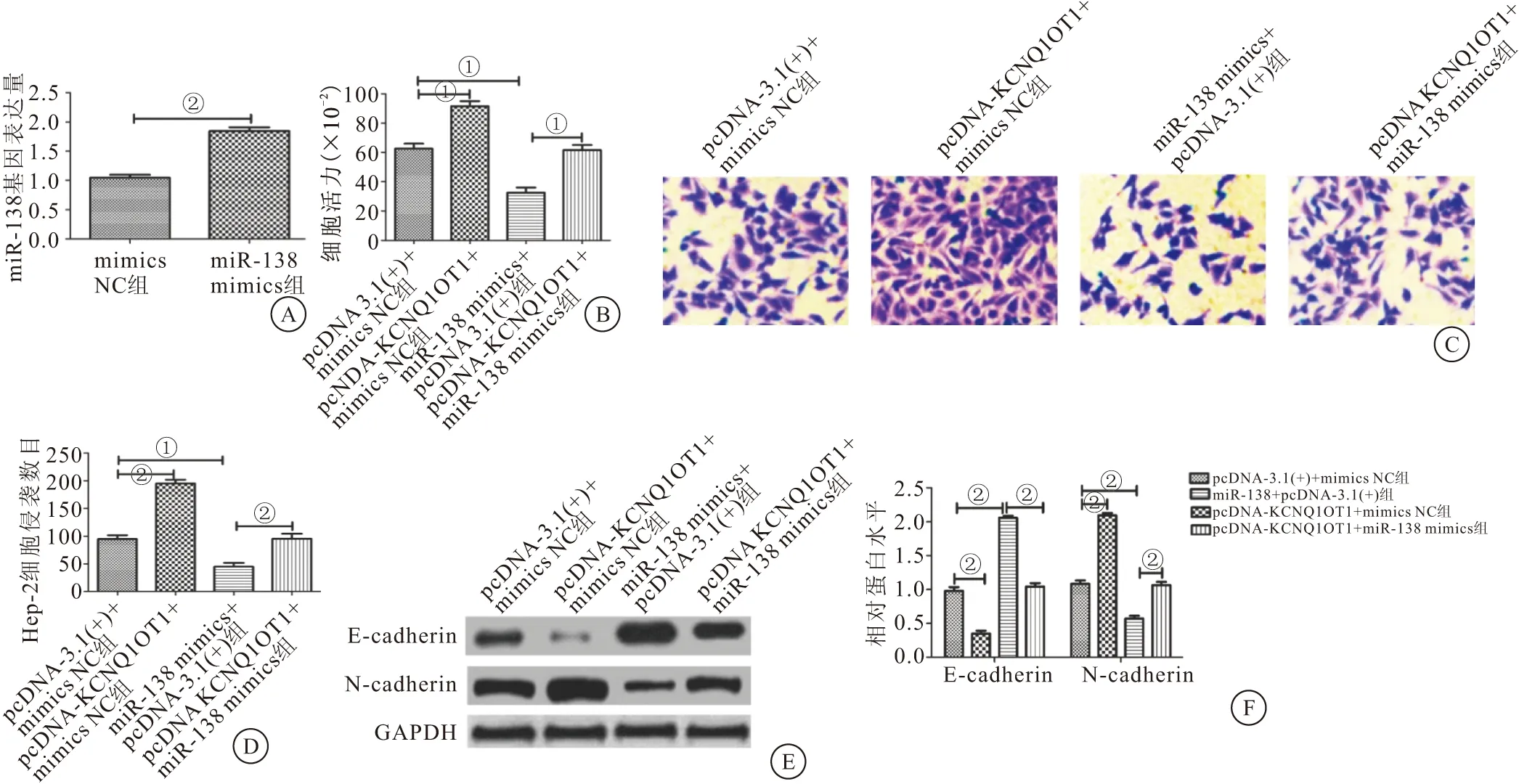
图4 KCNQ1OT1通过miR-138调控Hep-2细胞的增殖、侵袭和EMT(n=3)Figure 4 KCNQ1OT1 regulated the proliferation,invasion and EMT of Hep-2 cells through miR-138注:A.RT-qPCR检测过表达miR-138后细胞中的miR-138表达量;B.CCK-8检测KCNQ1OT1通过miR-138对Hep-2细胞增殖的影响;C.细胞侵袭实验检测KCNQ1OT1通过miR-138对Hep-2细胞侵袭的影响;D.Hep-2细胞的侵袭数目;E.Western blot检测KCNQ1OT1通过miR-138对Hep-2细胞EMT的影响;F.E-cadherin、N-cadherin蛋白的相对表达量。两组比较,①P<0.05;②P<0.01
2.5 miR-138和FAK之间的靶向和调控关系 预测miR-138和FAK之间的结合位点(图5A)。当质粒携带FAK 3′UTR wt时,miR-138的荧光素酶活性下降(P<0.01);当质粒携带FAK 3′UTR mut时,miR-138的荧光素酶活性无变化(P>0.05)(图5B)。与inhibitor NC相比,miR-138 inhibitor促进FAK的基因表达(图5C)。结果表明FAK和miR-138之间存在负调控关系。
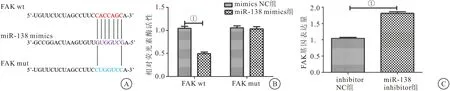
图5 miR-138和FAK之间的靶向和调控关系(n=3)Figure 5 Targeting and regulatory relationships between miR-138 and FAK注:A.TargetScan预测miR-138和FAK之间的结合位点;B.荧光素酶表达量的测定;C.RT-qPCR检测FAK的表达量。两组比较,①P<0.01
2.6 沉默miR-138激活Hep-2细胞中FAK/Src/MAPK信号通路 与inhibitor NC组相比,miR-138 inhibitor组FAK、Src、MAPK蛋白的磷酸化水平升高,p-FAK/FAK、p-Src/Src和p-MAPK/MAPK比值升高(P<0.01);与mimics NC组相比,miR-138 mimics组FAK、Src、MAPK蛋白的磷酸化水平下降,p-FAK/FAK、p-Src/Src和p-MAPK/MAPK比值降低(P<0.01)。结果表明沉默miR-138能够激活Hep-2细胞中FAK/Src/MAPK信号通路。见图6。
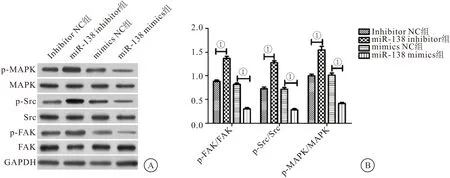
图6 沉默miR-138激活Hep-2细胞中FAK/Src/MAPK信号通路(n=3)Figure 6 Silencing miR-138 activated the FAK/Src/MAPK signaling pathway in Hep-2 cells注:A.Western blot检测过表达及干扰miR-138后Hep-2细胞中FAK、Src、MAPK蛋白磷酸化水平;B.p-FAK/FAK、p-Src/Src和p-MAPK/MAPK比值。两组比较,①P<0.01
2.7 沉默miR-138激活FAK/Src/MAPK信号通路促进Hep-2细胞增殖、侵袭和EMT 和inhibitor NC组相比,miR-138 inhibitor组的细胞增殖能力升高(P<0.05),侵袭数目明显增加(P<0.01),E-cadherin蛋白表达量明显下降(P<0.01),N-cadherin蛋白表达量明显上升(P<0.01);和Control组相比,Y15组的细胞增殖能力明显下降(P<0.01),侵袭数目明显减少(P<0.01),E-cadherin蛋白表达量明显升高(P<0.01),N-cadherin蛋白表达量明显下降(P<0.01);和miR-138 inhibitor组相比,miR-138 inhibitor+Y15组的细胞增殖能力下降(P<0.01),侵袭数目明显减少(P<0.01),E-cadherin蛋白表达量明显升高(P<0.01),N-cadherin蛋白表达量明显下降(P<0.01)。结果表明沉默miR-138激活FAK/Src/MAPK信号通路促进Hep-2细胞增殖、侵袭和EMT。见图7。
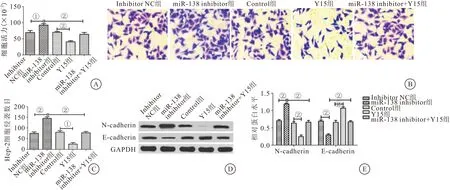
图7 沉默miR-138激活FAK/Src/MAPK信号通路促进Hep-2细胞增殖、侵袭和EMT(n=3)Figure 7 Silencing miR-138 activated the FAK/Src/MAPK signaling pathway to promote proliferation,invasion and EMT of Hep-2 cells注:A.CCK-8法检测沉默miR-138激活FAK/Src/MAPK通路对Hep-2细胞增殖的影响;B.细胞侵袭实验检测沉默miR-138激活FAK/Src/MAPK通路对Hep-2细胞侵袭的影响;C.Hep-2细胞的侵袭数目;D.Western blot检测沉默miR-138激活FAK/Src/MAPK通路对Hep-2细胞EMT的影响;E.E-cadherin、N-cadherin蛋白的相对表达量。两组比较,①P<0.05;②P<0.01
3 讨论
lncRNA介导的表观遗传调控转录在多生物学功能中发挥重要的作用。研究表明,lncRNA通过与染色质相互作用,从遗传学上调节染色体域的多个基因的转录。lncRNA KCNQ1OT1作为一种印迹基因,是一种与染色质相互作用的长链非编码RNA。近年来,越来越多的证据表明lncRNA KCNQ1OT1的异常表达可能作为癌基因或抑癌基因,参与癌症的发生发展,可作为癌症的诊断和预后标志物。例如,lncRNA KCNQ1OT1通过miR-211-5p介导的Ezrin/Fak/Src信号通路调控舌癌细胞增殖和顺铂耐药[9];异常表达的lncRNA KCNQ1OT1是诊断早期胃癌的生物标志物[10];lncRNA KCNQ1OT1在NSCLC组织中高表达,与患者的预后相关,可作为潜在的肺癌预后预测分子标志物[11]。有文献报道lncRNA KCNQ1OT1通过靶向miR-34a/ATG4B途径增强奥沙利铂在结肠癌中的耐药[12]。本研究发现与正常细胞相比,KCNQ1OT1在喉癌细胞中表达上调,KCNQ1OT1的异常表达提示分子与喉癌发展密切相关,这与KCNQ1OT1在舌癌、结直肠癌和肺癌中的研究结果一致。另外本研究发现干扰KCNQ1OT1的表达抑制了Hep-2细胞的增殖、侵袭和EMT进程,表明KCNQ1OT1能够作为癌基因在喉癌发展过程中发挥作用。
lncRNA作为竞争内源性RNA或miRNA海绵,参与调控多种细胞生物学活动[13-14]。本研究探讨了lncRNA KCNQ1OT1是否通过与miRNA相互作用而发挥功能。通过生物学信息软件预测和双荧光素酶报告基因实验分析发现KCNQ1OT1和miR-138具有靶向和负调控关系。有研究表明miR-138参与各种癌症的发生发展。miR-138可直接靶向FAK激酶,抑制细胞侵袭,增加癌细胞对化疗的敏感性[15],在前列腺癌中可以通过CTNNB1的转录诱导间接上调AMACR表达[16],通过靶向PI3K/AKT自噬信号通路中的PDK1抑制恶性黑色素瘤发展[17],可抑制人SGC-7901细胞的增殖能力,机制可能是通过抑制靶基因hTERT蛋白的表达[18],上调miR-138表达可抑制脑胶质瘤细胞侵袭转移,可能与负向调节Sema4C表达有关[19]。考虑到miR-138在各种癌症发展过程中的关键作用,本研究深入探讨miR-138在喉癌中的临床意义,发现miR-138在喉癌细胞中的表达明显低于正常细胞。本研究将miR-138干扰质粒转染至Hep-2细胞后,发现Hep-2细胞增殖能力升高,侵袭数目明显增加,E-cadherin蛋白表达量下降,N-cadherin蛋白表达量明显上升,而过表达miR-138后,明显抑制了Hep-2细胞的增殖、侵袭和EMT,这与miR-138在肾细胞癌、鼻咽癌、胆囊癌等多种癌症中发挥的作用一致,说明在Hep-2细胞发展过程中,miR-138发挥了明显的抑癌功能。此外还发现KCNQ1OT1能够通过miR-138促进喉癌的增殖、侵袭和EMT,沉默miR-138通过激活FAK/Src/MAPK通路促进癌细胞增殖、侵袭和EMT,提示我们FAK/Src/MAPK通路可能是喉癌患者靶向治疗的一个新方向,值得进一步深入探讨。
4 结论
下调LncRNA KCNQ1OT1通过miR-138/FAK/Src/MAPK轴可抑制喉癌Hep-2细胞的增殖、侵袭和EMT。本研究结果为进一步了解喉癌发展的分子机制提供了理论基础,同时也为喉癌患者的临床诊断和治疗提供了试验依据。

