维格列汀对糖尿病足溃疡大鼠创面修复的影响*
王晓娟 曹海泉 袁宁 何明海
(南充市中心医院·川北医学院第二临床医学院 1.内分泌科;2.重症医学科,四川 南充 637000)
创面是由于有害因素导致活体组织功能连续性中断所致的最常见的临床情况[1]。糖尿病足溃疡(diabetic foot ulcer,DFU)是糖尿病患者的严重并发症之一,与神经病变、肾病、心肌病变、血管病变、酮症酸中毒并列[2]。一份统计报告表明DFU的年发病率约为2%,在糖尿病人群中患病率约为4.5%~10%,66%的DFU患者需要住院治疗[3-4]。由于糖尿病患者发生DFU的风险增加,导致患者生活质量下降,同时也给医疗系统带来了巨大的经济负担,患有DFU的2型糖尿病患者每年的直接和间接医疗费用约为13561美元[3]。证据表明导致伤口愈合延迟的各种因素包括血糖水平升高、胰岛素抵抗增加、血管生成和胶原沉积减少[5]。此外,创面的炎性浸润及炎性因子的平衡在DFU的发生发展中也起着重要作用[6]。有报道指出,维格列汀在治疗糖尿病方面具有较好的效果[7],但关于其对DFU创面修复的研究还尚未清晰。基于此,本研究观察维格列汀对DFU大鼠创面修复的影响,为其治疗DFU提供理论依据。
1 材料与方法
1.1 实验动物及分组 成年雌性健康、清洁级SD大鼠90只,体质量(210±10)g,购于成都达硕实验动物有限公司,使用许可证号:SCXK(川)2019-031。饲养于恒温(20~25 ℃)、恒湿(50%±5%)环境中,自然采光,自由饮水。大鼠适应性饲养1周后随机分为9组:空白组(3、6、9 d组)、模型组(糖尿病鼠足溃疡)(3、6、9 d组)、维格列汀组(给药3、6、9 d组),每组各10只。本实验大鼠的处理符合动物伦理要求,并经医院伦理委员会审核、同意。
1.2 主要试剂及设备 维格列汀购自诺华公司(批号:H20160037);白细胞介素-6(IL-6,货号:ZC-36404)、肿瘤坏死因子α(TNF-α,货号:ZC-37624)ELISA 试剂盒购自上海茁彩生物科技有限公司;苏木素染液(批号:C200301)、伊红染液(批号:C200403)购自珠海贝索生物技术有限公司。血管内皮细胞生长因子(VEGF,货号:ab32152)、表皮细胞生长因子(EGF,货号:ab184265)、E-钙黏蛋白(E-cadherin,货号:ab40772)、碱性成纤维细胞生长因子(bFGF,货号:ab208687)一抗抗体购自英国Abcam;过氧化物酶标记羊抗兔IgG(上海晶天生物)、BMJ-A型包埋机购自常州郊区中威电子仪器厂;SpectraMAX Plus384酶标仪购自美谷分子仪器有限公司。
1.3 方法
1.3.1 DFU大鼠模型的建立及给药 大鼠适应喂养1 w后,进行模型制备,除空白组外,其余大鼠造模,造模前大鼠禁食12 h,但可饮水,造模大鼠采用高糖高脂饲料喂养4~6 w,大鼠腹腔注射链脲佐菌(STZ)30 mg/kg诱发罹患糖尿病,用药72 h后,自尾静脉微量采血检测随机血糖,当血糖值超过16.7 mmol/L,即为糖尿病大鼠造模成功。随后造模大鼠用10%戊巴比妥钠麻醉,背部剃毛、消毒,大鼠背侧后足上形成单个圆形全层皮肤溃疡创面伤口,2~3 d后伤口局部皮肤坏死,形成DFU,造模完成。空白组大鼠正常饲料饲喂,大鼠创面造模成功后24 h,空白组和模型组灌胃双蒸水(10 mg/kg),维格列汀组灌胃维格列汀(57 mg/kg),1次/d,分别于给药后的3、6、9 d,剪取创面部位溃疡皮肤标本。
1.3.2 大鼠创面组织病理学观察 采集创面组织标本,4%多聚甲醛溶液固定,固定的创面组织经全自动脱水机脱水,包埋,切片,放入苏木精中染色约10 min,自来水冲洗使切片颜色变蓝,1%盐酸酒精分化数秒钟,使细胞核呈紫蓝色,1%氨水中数秒,至返蓝,1%伊红染色3 min左右,脱水,透明,中性树胶封存,镜检观察组织病理变化。
1.3.3 酶联免疫吸附法(ELISA)检测血清炎性因子表达 按照ELISA试剂盒说明操作,检测血清中TNF-α、IL-6表达水平。
1.3.4 免疫组织化学法检测创面组织VEGF、EGF、E-cadherin、bFGF表达 创面组织切片,脱腊后3% H2O2室温孵育30 min,滴加正常山羊血清后37 ℃孵育30 min,滴加一抗(VEGF、EGF、E-cadherin、bFGF),37 ℃孵育1 h,滴加相应二抗,继续孵育30 min。然后DAB显色、苏木精复染、酒精盐酸分化、脱水、中性树胶封片,观片,以Image-pro plus 6.0 软件处理和分析图像,统计IOD值。
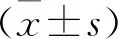
2 结果
2.1 维格列汀对DFU大鼠创面组织病理学变化的影响 空白组大鼠在灌胃3、6、9 d时皮肤组织表皮结构完整清晰,细胞排列整齐紧密,胞质红染、均匀,细胞核形态正常,未见明显病理变化。模型组大鼠在造模成功3 d时创面组织内表皮、真皮、皮下脂肪层大面积坏死脱落,细胞形态基本消失;于6 d时创面组织内表皮中复层扁平上皮层明显增厚,表皮层细胞坏死,胞核崩解,胞核固缩崩解;于9 d时创面组织复层扁平上皮层明显增厚,嗜酸性增强,毛囊和皮脂腺等皮肤附属器基本坏死消失,表皮表面覆有由变性坏死细胞及出血混合而成的痂皮,真皮层较多大量胶原纤维坏死,坏死区域可见较多炎症细胞浸润。维格列汀治疗3 d时创面组织内表皮中复层扁平上皮层明显增厚,表皮层细胞坏死,胞核崩解,见表皮表面覆有由变性坏死细胞及出血混合而成的痂皮;于6 d时表皮层细胞坏死,表皮表面覆有由变性坏死细胞及出血混合而成的痂皮,真皮层较多胶原纤维坏死,出血;治疗9 d时真皮层胶原纤维坏死区域可见淋巴细胞浸润及纤维细胞增生,亦可见新生毛细血管形成,皮下肌层清晰可见,胞核形态正常,其他未见明显病理变化;与模型组9 d时相比,病理损伤明显改变,见图1。
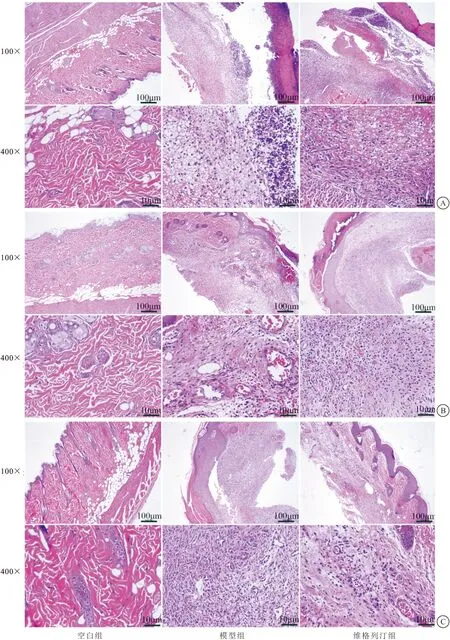
图1 各组大鼠创面组织病理学变化(HE,100×,400×)Figure 1 Histopathological changes in wounds of rats in each group 注:A.3 d处理组;B.6 d处理组;C.9 d处理组
2.2 对DFU大鼠血清炎性因子表达的影响 与空白组比较,模型组大鼠血清IL-6、TNF-α水平在3、6、9 d时均明显升高 (P<0.05);与模型组比较,维格列汀治疗3、6、9 d可明显降低IL-6、TNF-α水平 (P<0.05),见表1。
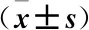
表1 各组大鼠血清炎性因子表达Table 1 The expression of serum inflammatory factors in each group of rats
2.3 维格列汀对DFU大鼠创面血管再生的影响 与空白组比较,模型组EGF、VEGF表达在3、6、9 d时均明显降低 (P<0.05);与模型组比较,维格列汀治疗3、6、9 d可明显升高EGF、VEGF表达 (P<0.05)。见表2、表3。
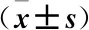
表2 各组大鼠创面组织EGF表达Table 2 Expression of EGF in wound tissue of rats in each group
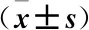
表3 各组大鼠创面组织VEGF表达比较Table 3 Expression of VEGF in wound tissue of rats in each group
2.4 维格列汀对糖尿病足溃疡大鼠创面再上皮化的影响 与空白组比较,模型组bFGF、E-cadherin表达在3、6、9 d时均明显降低 (P<0.05);与模型组比较,维格列汀治疗3、6、9 d可明显升高bFGF、E-cadherin表达 (P<0.05)。见表4、表5。
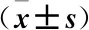
表4 各组大鼠创面组织bFGF表达Table 4 Expression of bFGF in wound tissues of rats in each group
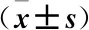
表5 各组大鼠创面组织E-cadherin表达Table 5 Expression of E-cadherin in wound tissue of rats in each group
3 讨论
DFU是一种慢性难治性临床疾病,主要受炎症反应受损和血糖升高的影响导致伤口延迟愈合。目前治疗DFU的方法包括神经治疗药物(抗生素、生长因子、粒细胞集落刺激因子)、物理疗法(如高压氧、电物理和负压疗法)以及先进的生物工程皮肤替代物等[8]。然而,较高的费用和无应答率限制了其在DFU治疗中的临床应用。王邦琼等[9]研究证明维格列汀在治疗糖尿病方面具有较好的效果,可能是治疗DFU的一种有前途的选择。在各种动物模型中,STZ诱导的模型重复性较高,可模拟大多数延迟伤口愈合的临床病理条件,包括再上皮化、伤口闭合和生长因子形成[10]。本研究结果显示,维格列汀干预后大鼠创面组织内表皮中复层扁平上皮层有所增厚,皮下肌层清晰可见,胞核形态正常,较模型组病理组织学明显改善,提示维格列汀对DFU具有改善作用,可成为治疗DFU的潜在药物。
研究报道炎症反应在伤口愈合过程中起着中心作用,血糖水平升高会导致过氧化物产生过多,从而刺激炎性因子的释放,临床上糖尿病患者与局部伤口中TNF-α、IL-1β和IL-6水平升高有关[11]。且支持TNF-α和延迟愈合过程之间存在直接联系[12]。此外,TNF-α可以抑制TGF-β的激活,从而抑制胶原-1的增殖和合成,而IL-6的增加对血管生成有负面影响[13]。本研究检测了炎性因子TNF-α、IL-6的表达,结果表明伤口愈合延迟与伤口区域炎症反应加重有关,与Lin等[14]的研究结果一致。而维格列汀的应用显著减少了伤口处的炎性渗出,表明其具有抗炎的潜力,创面组织的病理学结果进一步支持了这一观点。Bandyk[15]指出改善创面愈合可以洞察疾病状况。在本研究中,维格列汀可明显增加STZ引起的伤口收缩率,改善了伤口延迟愈合。表明维格列汀具有抗炎症作用,进而可以改善创面愈合。
VEGF被认为是最重要的血管生成因子,可以激活成纤维细胞的增殖,通过增加胶原蛋白的产生来促进伤口愈合[16]。然而,在糖尿病条件下,创面不良的血管系统增加了炎性因子的合成,从而抑制依赖VEGF的胶原合成,延迟伤口的愈合。此外,一系列病理生理因素可导致内皮功能障碍,从而导致血管生成障碍[17]。有学者认为糖尿病在伤口愈合过程中会诱导有缺陷的血管生成反应,VEGF可与Ang-1/Tie-2相互作用通过诱导小管形成、内皮细胞存活和血管退化在血管生成中发挥重要作用[18]。EGF是由血小板、巨噬细胞、成纤维细胞和骨髓间充质干细胞分泌,其可激活内皮细胞增殖、迁移及层粘连蛋白的沉积[19]。而bFGF是一种有效的促分裂原,因其可诱导成纤维细胞的增殖能力而被命名,bFGF的一种糖蛋白可促进血管再生,下调胶原Ⅰ和弹性蛋白表达,并上调皮肤成纤维细胞中的透明质酸合成来促进伤口愈合[20]。研究显示EGF和bFGF在慢性溃疡创面中水平降低,EGF和bFGF水平的上调可以促进溃疡创面细胞增殖进而加速创面愈合[21]。此外,细胞间黏附分子在调节皮肤再生性修复过程中起关键调节作用,E-cadherin可与β-catenin相互作用参与传导核内信号影响细胞的黏附性调节,同时参与角化形成细胞的黏着和成熟化,提示其可能参与调控创伤愈合再上皮化过程[22]。本研究结果显示,腹腔注射STZ可显著下调VEGF、EGF、bFGF、E-cadherin的表达,而维格列汀治疗明显提高了VEGF、EGF、bFGF、E-cadherin的表达,进一步证实了维格列汀在促进伤口愈合方面的作用。
4 结论
维格列汀对糖尿病足溃疡创面愈合具有潜在作用,其通过抑制炎性因子(TNF-α、IL-6)、增加血管再生因子(VEGF、EGF)、再上皮化因子(bFGF、E-cadherin)发挥其潜能,促进创面愈合。但维格列汀对创面愈合的影响具体通过哪些信号通路发挥作用,还有待后续深入研究。

