黄芩苷对人牙周膜干细胞生物学特性的影响及作用机制
黄琼 李婧 李长宏
(1.西宁市口腔医院牙周科,青海 西宁 810000;2.青海大学附属医院口腔颌面外科,青海 西宁 810000)
牙周病是指发生在牙周组织的疾病,也是导致成年人牙齿脱落的主要原因之一。包括牙龈炎和牙周炎在内的牙周疾病影响全世界多达90%的人[1]。牙周膜内的多能干细胞即牙周膜干细胞(Periodontal Ligament Stem Cells,PDLSCs)已被认为是牙周组织修复和再生的理想细胞来源[2]。PDLSCs在体外诱导培养条件下显示出成骨、成脂和成软骨的特性。此外,PDLSCs移植疗法在动物模型受损的牙周组织中具有促进新骨,新牙骨质和功能性牙周膜形成的潜力[3-4]。尽管有这种潜力,但受损的牙周组织中所含的干细胞相对较少,要获得足够数量的干细胞用于移植,就需要有效的分离和体外扩增。并且,干细胞必须迁移到缺损区域并分化为适当的功能表型,以参与伤口愈合、组织修复和再生[5]。因此,有效促进PDLSCs的增殖和成骨作用对牙周组织、牙龈和牙槽骨的再生和重塑具有至关重要的作用。黄芩苷是一种黄酮类化合物,是从传统中药黄芩的根中分离的有效活性成分,具有广泛的药理学功能,如抑菌、抗炎、抗肿瘤和抗变态反应等[6-7]。以往研究显示,黄芩苷能够通过抑制人牙周膜细胞的炎症反应发挥抗牙周炎的作用[8]。然而,其对PDLSCs是否存在影响及可能的机制鲜有报道。因此,本研究旨在探究黄芩苷对PDLSCs生物学特性的影响及机制。
1 材料与方法
1.1 细胞和主要试剂 人牙周膜干细胞(PDLSCs)购于美国菌种保藏中心ATCC;黄芩苷购于中国药品生物制品检定所;DMEM培养基购于美国Gibco公司;青-链霉素双抗、胎牛血清、胰蛋白酶购于武汉博士德生物工程有限公司;Wnt/β-catenin信号通路特异性抑制剂XAV939购于美国Prospec公司;细胞计数法(CCK-8)检测试剂购于日本同仁化学研究所;RNA提取试剂盒、逆转录试剂盒和实时荧光定量PCR(RT-PCR)检测试剂盒购于赛默飞世尔科技有限公司;Transwell小室购于美国BD公司;引物购于上海生工生物工程股份有限公司;β-catenin、Cyclin D1和c-myc单克隆抗体购于美国CST公司;HRP标记的IgG二抗购于美国Santa Cruz公司;蛋白免疫印迹(Western blot)相关检测试剂购于上海碧云天生物技术研究所。本研究经西宁市口腔医院伦理委员会审核、同意。
1.2 细胞培养和分组 将冻存的PDLSCs从液氮中取出,融化复苏后接种到细胞培养瓶中,内含10%胎牛血清的DMEM培养基,将培养瓶放置在37 ℃培养箱,设置条件为5% CO2、饱和湿度,观察细胞生长状态,及时更换培养液并进行传代,取第3代的细胞用于后续实验。取生长状态良好的PDLSCs种植在96孔板中,将细胞随机分为3组:control组、baicalin组和baicalin+XAV939组。control组PDLSCs以正常DMEM培养液进行培养,baicalin组PDLSCs以浓度为1.0 μmol/L baicalin(根据前期预实验结果筛选黄芩苷的作用浓度)的DMEM培养液进行培养,baicalin+XAV939组PDLSCs以浓度为1.0 μmol/L baicalin和4 μmol/L Wnt/β-catenin信号通路特异性抑制剂XAV939的DMEM培养液进行培养。
1.3 CCK-8检测 对数期的PDLSCs接种到96孔板中,接种密度为2×104个/孔,待细胞贴壁后以1.2分组处理,分别在24、48和72 h时在各孔中加入10 μL CCK-8试剂,37 ℃培养4 h,使用酶标仪测定450 nm波长每孔细胞的吸光度(OD)值,以OD值的高低反映PDLSCs增殖能力的大小。
1.4 黏附实验 在6孔板中加入PBS稀释的Fibronectin,于4 ℃静置16 h,吸去Fibronectin,以PBS洗涤3次,再加入0.2%的BSA封闭,室温静置2 h,以DMEM培养液洗涤3次,备用。分组处理48 h的PDLSCs以胰蛋白酶消化,计数后稀释呈1×103个/mL的细胞悬液,取100 μL均匀接种到6孔板中,加入相应处理的培养液,放置在37 ℃培养箱继续培养4 h,取出后以PBS洗去未黏附的细胞,固定,计数各组PDLSCs黏附细胞数。
1.5 Transwell迁移实验 PDLSCs以1.2分组处理48 h,胰酶消化细胞,以不含血清的培养液重悬细胞,将Transwell小室放入24孔板,上室均匀接种约1×104个细胞/孔,下室加入500 μL含10%胎牛血清的DMEM培养液,放置在37 ℃培养箱继续培养24 h,取出小室,用棉签除去上室残余细胞,固定后以1%结晶紫染色,倒置显微镜下(随机选取5个视野)观察并计数迁移细胞数。
1.6 酶联免疫检测仪检测碱性磷酸酶(ALP)活性 PDLSCs以1×104个/mL接种到96孔板中,生长汇合达60%时以1.2分组处理,分别在24、48和72 h按照ALP检测试剂盒说明进行操作,采用酶联免疫检测仪测定ALP活性。
1.7 RT-PCR检测 PDLSCs以1.2分组处理48 h,分别收集各组细胞,使用RNA提取试剂盒抽提总RNA,采用逆转录试剂盒将RNA合成cDNA,严格参照RT-PCR检测试剂盒说明书进行配液和扩增。配制20 μL反应体系,反应条件为:94 ℃预变性3 min;随后94 ℃变性30 s、60℃退火30 s、72 ℃延伸20 s,循环40次。以GAPDH为内参,使用2-ΔΔCt法计算各组PDLSC中骨钙蛋白(OCN)、成骨细胞转录因子2(RUNX2)和骨桥蛋白(OPN)基因的相对表达量。使用的引物如下:OCN 上游引物:5′-TCACACTCC TCGCCCTATT-3′,下游引物:5′-GATGAGGTCAG CCAACTCG-3′;RUNX2上游引物:5′-GCAGTTCCC AAGCATTTCAT-3′,下游引物:5′-CACTCTGGCT TTGGGAAGAG-3′;OPN上游引物:5′-ATGATGGC CGAGGTGATAGT-3′,下游引物:5′-ACCATTCAA CTCCTCGCTTT-3′;GAPDH上游引物:5′-GCACC GTCAAGGCTGAGAAC-3′,下游引物:5′-TGGTGA AGCACGCCAGTGGA-3′。
1.8 Western blot实验 收集各组处理48 h的PDLSCs,加入细胞裂解液,冰上裂解30 min,提取总蛋白,以BCA法对蛋白定量,行10%的SDS-PAGE电泳,蛋白分离后电转至PVDF膜上,封闭,加入相应稀释的一抗(β-catenin、Cyclin D1和c-myc一抗均为1∶500稀释),4 ℃过夜,次日加入1∶3000稀释的HRP标记的IgG二抗,室温反应2 h,滴加ECL进行显色,以GAPDH为内参,使用Image J软件计算各条带灰度值。
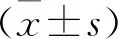
2 结果
2.1 三组PDLSCs增殖能力比较 CCK-8实验结果显示,与control组相比,baicalin组PDLSCs的OD值从48 h开始明显升高 (P<0.05);与baicalin组相比,baicalin+XAV939组细胞OD值从48 h开始明显降低 (P<0.05)。见图1。
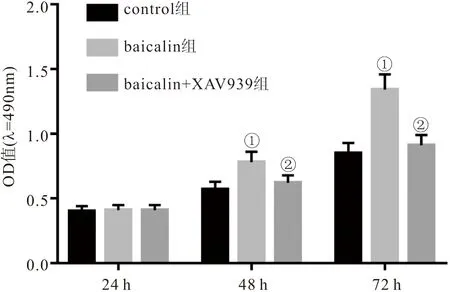
图1 三组PDLSCs在24、48和72 h时OD值比较Figure 1 Comparison of OD values of three groups of PDLSCs at 24,48 and 72 h注:与control组相比,①P<0.05;与baicalin组相比,②P<0.05
2.2 三组PDLSCs黏附能力比较 与control组相比,baicalin组PDLSCs贴壁数明显增加 (P<0.05);与baicalin组相比,baicalin+XAV939组贴壁细胞数明显降低 (P<0.05)。见图2。
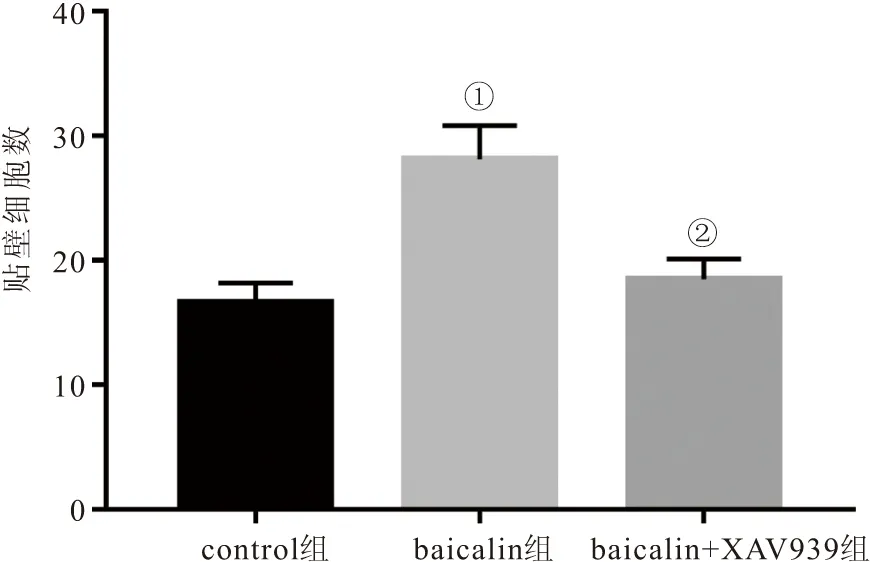
图2 三组PDLSCs黏附能力比较Figure 2 Comparison of adhesion ability of three groups of PDLSCs注:与control组相比,①P<0.05;与baicalin组相比,②P<0.05
2.3 三组PDLSCs迁移能力比较 与control组相比,baicalin组PDLSCs迁移细胞数明显增加 (P<0.05);与baicalin组相比,baicalin+XAV939组迁移细胞数明显减少 (P<0.05)。见图3。
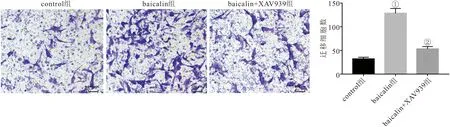
图3 Transwell迁移实验检测三组PDLSCs迁移能力Figure 3 Transwell migration experiment detects the migration ability of three groups of PDLSCs注:与control组相比,①P<0.05;与baicalin组相比,②P<0.05
2.4 各组PDLSCs中ALP活性比较 酶联免疫检测仪检测结果显示,与control组相比,baicalin组ALP活性明显升高 (P<0.05);与baicalin组相比,baicalin+XAV939组ALP活性明显降低 (P<0.05)。见图4。
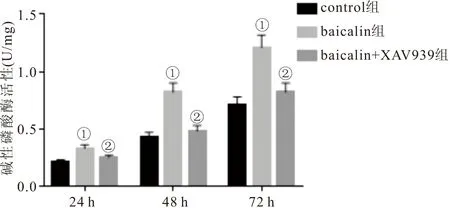
图4 三组PDLSCs中ALP活性比较Figure 4 Comparison of ALP activity in three groups of PDLSCs注:与control组相比,①P<0.05;与baicalin组相比,②P<0.05
2.5 各组PDLSCs中OCN、RUNX2和OPN表达量比较 RT-PCR检测结果显示,与control组相比,baicalin组PDLSCs中OCN、RUNX2和OPN相对表达量均明显升高 (P<0.05);与baicalin组相比,baicalin+XAV939组PDLSCs中OCN、RUNX2和OPN相对表达量均明显降低 (P<0.05)。见图5。
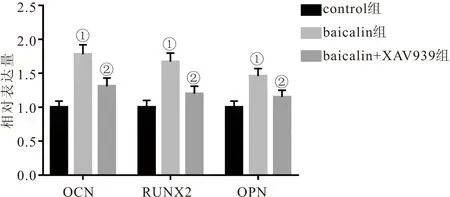
图5 各组PDLSCs中OCN、RUNX2和OPN相对表达量比较Figure 5 Comparison of relative expression levels of OCN,RUNX2 and OPN in each group of PDLSCs注:与control组相比,①P<0.05;与baicalin组相比,②P<0.05
2.6 各组PDLSCs中β-catenin、Cyclin D1和c-myc表达水平比较 与control组相比,baicalin组PDLSCs中β-catenin、Cyclin D1和c-myc表达水平均明显升高 (P<0.05),与baicalin组相比,baicalin+XAV939组PDLSCs中β-catenin、Cyclin D1和c-myc表达水平均明显降低 (P<0.05)。见图6。
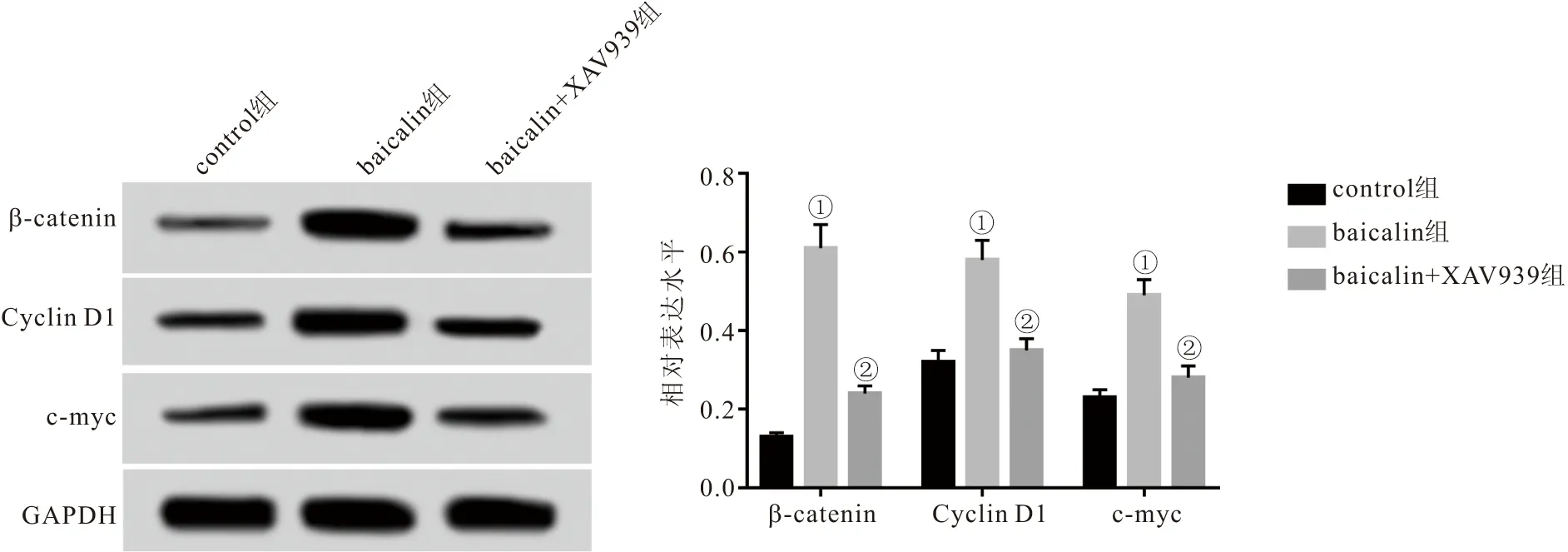
图6 Western blot检测PDLSCs中β-catenin、Cyclin D1和c-myc的表达水平Figure 6 Western blot detection of β-catenin,Cyclin D1 and c-myc expression levels in PDLSCs注:与control组相比,①P<0.05;与baicalin组相比,②P<0.05
3 讨论
黄芩苷作为中药黄芩的主要活性成分,具有抗炎、抗肿瘤和抑菌等多种药理活性[9]。有研究表明,黄芩苷能够促进骨细胞增殖和分化,在治疗骨质疏松、骨性关节炎等方面发挥一定的作用[10-11]。李晨睿等[12]研究显示,黄芩苷能够通过调控Wnt/β-catenin信号通路促进大鼠骨髓间充质干细胞向成骨细胞分化。间充质干细胞能够分化为其他细胞系,例如骨骼、脂肪、软骨和肌肉,从而使基于细胞疗法的组织再生成为可能[13]。PDLSCs这种组织特异性干细胞系在一定的培养条件下可以分化为成骨细胞、成软骨细胞和脂肪细胞,因此PDLSCs是用于牙周组织再生的有前途的方法。
近年来,研究者在如何提高PDLSCs增殖和分化能力方面做了大量的研究[14]。PDLSCs活性和数量的增加对于损伤的牙周组织重建具有十分重要的作用[15]。本研究显示,黄芩苷能够促进PDLSCs的增殖能力。细胞迁移在诸如发育,炎症和伤口愈合的生物学过程中是必不可少的。在修复和再生过程中,干细胞的迁移是关键事件。PDLSCs作为牙周组织中的功能性干细胞,可以迁移到损伤部位,并分化为成纤维细胞,成骨细胞和成软骨细胞,并参与牙周再生[16]。本研究结果显示,黄芩苷促进了PDLSCs黏附和迁移。提示黄芩苷可能通过促进PDLSCs增殖、黏附和迁移抑制牙周病的进展。此外,本研究结果还显示,黄芩苷上调了ALP活性,同时促进了人PDLSCs的成骨相关基因OCN、RUNX2和OPN的表达。大量研究显示,ALP活性在一定程度上反映骨活性,也是骨矿化和骨形成的标志物之一。当具有成骨分化特性的细胞开始向成骨分化时,ALP活性逐渐升高[17]。事实证明OCN参与控制矿化过程,出现在成骨分化的后期。RUNX2是成骨过程中最重要的转录因子,并负责激活成骨细胞分化标记基因。OPN是一种调节蛋白,对成骨细胞的分化、增殖和骨形成至关重要。OCN、RUNX2和OPN与PDLSCs成骨分化的多个步骤密切相关[18]。本实验结果表明,使用黄芩苷可能会诱导PDLSCs的成骨分化,提示黄芩苷在牙周组织形成和重组中能够发挥促进作用。
既往研究表明,Wnt/β-catenin信号通路参与了PDLSCs的增殖和成骨分化[19]。提示该信号通路可能在黄芩苷诱导的PDLSCs的成骨标志物表达中起作用。在本研究中,黄芩苷干预的PDLSCs中β-catenin、Cyclin D1和c-myc的表达显著上调,表明黄芩苷可能通过激活Wnt/β-catenin信号通路提高PDLSCs的增殖活性及成骨分化能力。本研究在黄芩苷干预的PDLSCs中添加Wnt/β-catenin信号通路特异性抑制剂XAV939,结果发现,XAV939能够部分逆转黄芩苷对PDLSCs增殖和成骨分化的促进作用。证实了黄芩苷可通过激活Wnt/β-catenin信号通路发挥调控PDLSCs生物学特性的作用。
4 结论
黄芩苷可有效促进PDLSCs的增殖、黏附和迁移,同时促进成骨分化,该机制可通过Wnt/β-catenin信号传导途径介导。了解黄芩苷对PDLSCs生物学特性的影响和分子调节机制可能有助于阐明黄芩苷在牙周发育和牙周疾病中的作用,为牙周组织修复的临床研究提供了实验依据。

