右心衰、结核及肿瘤性患者胸腔积液中性粒细胞内p38蛋白对IFN-γ及TNF-α表达的影响及意义
陈 乾,杨 静,张建银,沈 乐,李 萍,耑 冰,董 辉
胸腔积液(PE)是呼吸内科常见病和多发病症,临床根据PE的理化指标区分渗出液和漏出液,然后推测PE的病因并给予相应的治疗。对于不同病因的PE,其内细胞成分差异很大,而造成这种差异的原因至今不明[1-2]。本研究通过观察右心衰、结核以及肿瘤性PE内中性粒细胞中p38蛋白对IFN-γ和TNF-α表达的潜在影响,探寻中性粒细胞在不同病因所致PE内分布差异的可能原因。
1 资料与方法
1.1 一般资料:收集2016年1月-2017年12月我院呼吸内科首诊、病因明确、单一病因导致的PE住院患者71例为研究对象,其中男性30例,女性41例。采集其外周静脉血样5 mL/人,收集血样内的中性粒细胞。第一时间通过胸腔闭式引流术抽取PE 20 mL,经特定步骤收集中性粒细胞(NEU),根据NEU来源患者的病因不同,将其分为心衰组(HF组)12例,患者平均年龄(62.91±6.20)岁;结核组(TB组)18例,患者平均年龄(40.05±7.33)岁;恶性组(CA组)15例,患者平均年龄(54.07±7.29)岁。收集另外一个TB组患者的NEU,向其中加入p38蛋白抑制剂SB203580孵育2 h(SB203580浓度为10 μmol/L),该组记为TB+SB203580组,患者15例,平均年龄(42.93±9.07)岁;收集另外一个CA组患者的NEU,向其中加入SB203580孵育2 h(SB203580浓度为10 μmol/L),记为CA+SB203580组,患者11例,平均年龄(61.27±6.40)岁;同期选择我院体检中心健康体检者20人(对照组),平均年龄(44.30±11.42)岁。以上患者一经入院,经患者同意,签署“知情同意书”。本研究的实验方案、患者“知情同意书”等相关资料在实施之前,上报宁夏回族自治区人民医院伦理委员会批准后实施。
1.2 纳入标准:①年龄>18岁;②能正确表达自己意愿;③慢性肺源性心脏病所致的心衰源性PE的患者;④结核性胸膜炎导致的结核性PE患者;⑤恶性肺部病灶胸膜转移导致的恶性胸水患者;⑥患者临床资料齐全,自愿参与本研究并签署知情同意书。
1.3 排除标准:①复杂病因导致的PE(合并其他重要脏器疾病,如冠心病、结构性心脏病、先天性心脏病、血液系统疾病、风湿免疫系统疾病、肝肾功能不全、各种传染性疾病导致的PE等);②合并高血压、糖尿病、左心功能不全的患者;③存在类肺炎旁胸水的患者;④拒绝签署知情同意书的患者。
1.4 诊断标准:渗出性PE和漏出性PE诊断标准符合第八版《内科学》胸腔积液一节中的相关实验室指标。
1.4.1 右心衰所致PE临床认定 :①符合漏出液的诊断标准;②患者可明确诊断为慢性肺源性心脏病,本文所指的心衰均系指右心衰;③胸膜活检排除结核及恶性肿瘤;④普通PE培养结果阴性。
1.4.2 结核性PE临床认定:①符合渗出液的诊断标准,胸水腺苷脱氨酶>30 U/L;②胸膜病理活检发现朗汉氏巨细胞;③普通胸水培养结果阴性,结核分枝杆菌培养阴性或阳性。
1.4.3 恶性PE临床认定:①符合渗出液的诊断标准;②患者胸膜活检确认为肺部恶性病灶或在胸水中找到恶性细胞;③普通胸水培养结果阴性,结核分枝杆菌培养阴性。
1.5 主要检测试剂:中性粒细胞分离试剂盒(天津灏洋),全血及组织稀释液(天津灏洋),红细胞裂解液(天津灏洋),细胞洗涤液(天津灏洋)、Trizol试剂(南京凯基),总RNA提取试剂盒(南京凯基),反转录试剂盒(大连宝生物)、全蛋白提取试剂盒(南京凯基),磷酸化蛋白提取试剂盒(南京凯基),BCA蛋白定量试剂盒(南京凯基);兔抗人p38一抗(北京博奥森),兔抗人IFN-γ一抗(北京博奥森)、兔抗人TNF-α一抗(北京博奥森)、β-actin一抗(北京博奥森)、山羊抗兔二抗(北京博奥森),p38蛋白抑制剂SB203580(Selleck生物)。
1.6 研究方法
1.6.1 血液样本NEU提取:取5 mL全血标本,加入组织稀释液2 mL混匀,加入中性粒细胞分离液,500 g离心25 min,此时离心管从上至下分为四层,弃去第一、第二层细胞,收集第三层和第四层细胞,染色并放入显微镜下观察。随后加入细胞洗涤液10 mL,混匀后200 g离心30 min,沉淀1次,洗涤后用红细胞裂解液裂解红细胞,再经3次洗涤祛除红细胞及碎片后,吸取沉淀细胞即为所需NEU。
1.6.2 胸水内NEU提取:取10 mLPE,离心弃上清液,全部细胞沉淀,PBS重悬,冲洗两次,制成单细胞悬液。然后参照1.6.1的步骤提取PE内中性粒细胞。
1.6.3 各组NEU内p38蛋白及p-p38的表达:分别将各组获取的NEU裂解,提取NEU内全蛋白,BCA蛋白定量,取样,经上样(上样量40 μg)、电泳、转膜、封闭、滴加兔抗人p38一抗(一抗稀释度1∶3 000)4 ℃摇晃12 h,PBST转膜15min,共3次;滴加生物素标记二抗,4 ℃摇晃3 h,PBST洗膜后行ECL发光,胶片曝光,使用凝胶成像系统进行灰度分析,Western-blot法测定各组p38蛋白条带光密度值及β-actin条带光密度值,两者之比作为p38蛋白表达的相对值;使用同样的方法获得磷酸化的p38蛋白(p-p38蛋白表示磷酸化的p38蛋白)表达相对值。
1.6.4 各组NEU内IFN-γ mRNA、TNF-α mRNA表达:分别以各组获取的NEU为研究对象。裂解NEU,Trizol试剂提取NEU内总RNA,逆转录合成cDNA,用特异性扩增IFN-γ的引物(F:5′ -GATGAAACCCTCAGAAGC -3′; R:5′-ATCTCCCAGGCACAGTCA-3′,117 bp)和TNF-α的引物(F:5′-CGAGTGACAAGCCTGTAGCC-3′;R:5-TGAAGAGGACCTGGGAGTAGAT-3′,171 bp),以β-actin(F:5′-TTAGTTGCGTTACACCCTTTC-3′;R: 5′-CCTTCACCGTTCCAGTTTT-3′,149 bp)作为内参进行Realtime PCR(PCR扩增参数:预变性95 ℃ 3 min;变性95 ℃ 20 s,退火57 ℃ 20 s,延伸72 ℃ 20 s,40个循环;最后延伸65 ℃ 10 min),Realtime PCR检测得到数据,根据2-△△Ct法分析IFN-γ mRNA、TNF-α mRNA表达水平。
1.6.5 各组NEU内IFN-γ和TNF-α的表达:以各组获取的NEU为研究对象,使用类似1.6.3中的方法,Western-blot法分别检测NEU内IFN-γ蛋白、TNF-α蛋白表达的相对值。

2 结果
2.1 患者一般资料:各组平均年龄比较差异有统计学意义(F=18.84,P<0.05),HF组年龄(62.91±6.20)岁,TB组年龄(40.05±7.33)岁,各组患者一般资料见表1。
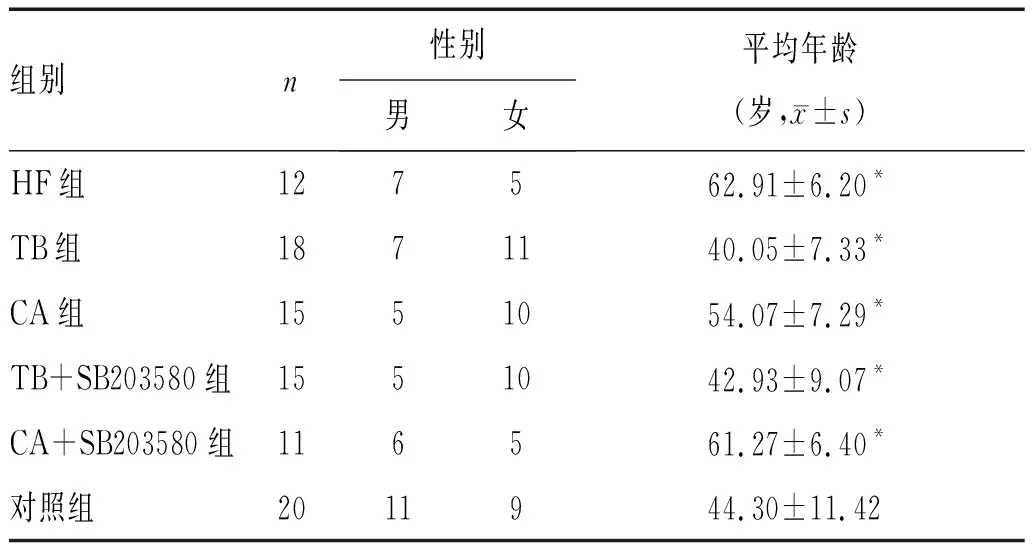
表1 各组一般资料比较
2.2 各组NEU内p38蛋白、p-p38蛋白的表达:与对照组相比,其他各组p38蛋白表达差异无统计学意义(P>0.05);与对照组相比,其他各组p-p38蛋白表达差异有统计学意义(P<0.05),其中,HF组p-p38蛋白表达水平高于对照组;组间比较发现,各组p-p38蛋白表达水平差异有统计学意义(P<0.05),TB组及CA组p-p38蛋白表达水平高于其他各组,而TB+SB203580组、CA+SB203580组p-p38蛋白表达水平分别低于TB组和CA组;结果见表2、图1(目录后)。
2.3 各组NEU内IFN-γ mRNA、TNF-α mRNA、IFN-γ及TNF-α表达:与对照组相比,各组IFN-γ mRNA、TNF-α mRNA的表达水平差异均有统计学意义(P<0.05),HF组IFN-γ mRNA、TNF-α mRNA的表达水平均高于对照组;组间比较发现,各组IFN-γ mRNA、TNF-α mRNA的表达水平差异均有统计学意义(P<0.05),其中TB组、CA组IFN-γ mRNA、TNF-α mRNA表达水平高于其他各组;而TB+SB203580组、CA+SB203580组IFN-γ mRNA、TNF-α mRNA表达水平分别低于对应的TB组、CA组,见表3。
与对照组相比,各组IFN-γ、TNF-α蛋白表达水平差异均有统计学意义(P<0.05),HF组IFN-γ、TNF-α表达水平均高于对照组;组间相比发现,各组IFN-γ、TNF-α的表达水平差异均有统计学意义(P<0.05),其中TB组、CA组IFN-γ、TNF-α表达水平高于其他各组;TB+SB203580组、CA+SB203580组IFN-γ、TNF-α表达水平分别低于对应的TB组、CA组,见表3与图2-图3(目录后)。
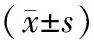
表3 各组INF-γ mRNA、TNF-α mRNA、INF-γ、TNF-α的表达相对值
3 讨论
众所周知,PE的形成原因众多。其内细胞及蛋白成分极其复杂。目前,对于PE内细胞成分差异的原因缺乏研究[1]。但可以断言的是PE细胞成分的差异,必定与细胞间极其复杂的信号转导密切相关,而这也将为判断PE性质提供了重要的线索信息。
本研究以临床中常见的右心衰、结核以及恶性PE内NEU为研究对象,观察了NEU内p38蛋白及p38蛋白抑制剂SB203580对IFN-γ和TNF-α转录及蛋白表达的影响。我们发现各组NEU内p38蛋白表达无差异,而p-p38蛋白表达存在差异,这再次印证了我们前期的研究:p38蛋白通过p-p38蛋白参与信号传递作用[3]。本研究发现,TB组及CA组p-p38蛋白表达水平高于其他各组,HF组p-p38蛋白表达高于对照组,这提示右心衰、结核及肿瘤性因素均可增加PE中NEU内p38蛋白的磷酸化水平(即p-p38升高)。这种变化趋势与Tiegang Liu等人[4]的研究一致,Tiegang Liu等人在炭毒素导致大鼠PE的研究中认为炭疽毒素可提高p-p38蛋白的水平。而本研究中,无论哪种因素(右心衰、结核及肿瘤)均可以推高机体炎症水平,从而诱发PE产生。
本研究发现TB组、CA组NEU内IFN-γ mRNA、IFN-γ的表达水平均升高,HF组IFN-γ mRNA、IFN-γ表达水平高于对照组。提示右心衰、结核以及肿瘤因素均可提高NEU内IFN-γ mRNA及IFN-γ表达水平;该结果与Carolyn R等人[5]的结果类似,中性粒细胞在受到炎症等因素刺激后,可不依赖白介素12(IL-12)独立产生IFN-γ,而IL-12诱导产生IFN-γ[6]。国内彭伟等人[7,8]研究结果亦与我们的结果类似,他们发现p-p38蛋白可促进CD4+T细胞(Jurkat细胞)表达IFN-γ。另外,本研究中使用p38蛋白抑制剂SB203580,通过对p-p38蛋白的抑制,可以观察到TB+ SB203580组、CA+ SB203580组中IFN-γ mRNA相对值、IFN-γ表达相对值明显减低,这就间接证明了IFN-γ的转录和表达与p38蛋白密切相关,但凡可影响到p-p38蛋白的表达量,即可提高IFN-γ的转录和表达水平。
本研究发现TB组、CA组TNF-α mRNA、TNF-α表达水平均升高,HF组TNF-α mRNA、TNF-α表达水平亦高于对照组。该结果提示右心衰、结核以及肿瘤因素亦可提高胸水NEU内TNF-α的转录及表达水平;类似的,TB+SB203580组、CA+SB203580组TNF-α mRNA、TNF-α表达水平分别低于TB组和CA组,提示TNF-α的转录与表达与p38蛋白密切相关。p38蛋白不仅可以调控TNF-α基因翻译的起始阶段,还参与TNF-α mRNA稳定性的维持。而生成的TNF-α还可以通过多途径激活更多的p-p38蛋白;这也从侧面印证了我们的研究中出现的情况:p-p38蛋白升高,TNF-α mRNA及TNF-α表达亦升高的趋势,抑制p-p38蛋白后,TNF-α mRNA及TNF-α的表达亦降低。Carolyn R等人的[5]研究指出,炎症刺激后的中性粒细胞,其产生IFN-γ可以不依赖IL-12,但是需要TNF-α及IL-1β的调节。所以文献[9]报道称将IFN-γ与TNF-α联合检测可提高结核性胸水诊断的灵敏度和特异度,确有其分子生物学基础。
综上所述,我们认为右心衰性PE、结核性PE以及恶性PE内NEU中的p-p38升高,将导致IFN-γ和TNF-α在转录及蛋白表达的水平升高。p38蛋白抑制剂SB203580可通过抑制p38蛋白的磷酸化而降低结核组及肿瘤组中性粒细胞内IFN-γ和TNF-α在转录和蛋白表达的水平,这种机制参与了中性粒细胞在不同病因的PE内的分布差异。而对于IFN-γ和TNF-α的其他来源(比如来源于T细胞的IFN-γ和来源于巨噬细胞的TNF-α)如何影响NEU内IFN-γ和TNF-α表达及调控,目前仍缺乏研究[10-11],仍有待于进一步深入研究。

