旺盛期烟草对镉富集敏感性研究
孔祥方,魏树和,赵继蓉,代惠萍**,贾根良
旺盛期烟草对镉富集敏感性研究
孔祥方1,魏树和2*,赵继蓉1,代惠萍1**,贾根良3
(1.陕西理工大学生物科学与工程学院,陕西 汉中 723001;2.中国科学院沈阳应用生态研究所污染生态与环境工程重点实验室,辽宁 沈阳 110016;3.西北农林科技大学理学院,陕西 杨凌 712100)
采用盆栽试验方法,揭示了旺盛期烟草(云烟99)对镉的富集特点以及光合等生理指标对镉胁迫的响应.结果表明:当土壤镉含量分别为4.43, 7.94, 17.33和49.79mg/kg时,烟草茎、叶及地上部镉的富集系数(植物镉含量与土壤镉含量的比值)均大于1,转移系数(地上部镉含量与根镉含量的比值)也大于1,但镉含量未达到镉超富集植物的临界含量标准100mg/kg.当土壤镉含量为4.43mg/kg时,烟草的耐性较强.当土壤镉含量大于7.94mg/kg时,烟草的生物量、叶片光合色素含量、净光合速率、蒸腾速率、气孔导度和SOD活性均显著下降(0.05),胞间CO2浓度和MDA含量显著提高(0.05).旺盛期烟草对镉富集比较敏感,建议烟草的种植要远离镉污染土壤或镉背景值较高的土壤.
镉;烟草;旺盛期;敏感性
土壤重金属污染对人类健康和环境造成的危害越来越大,其中,镉(Cd)因具有较高的转移风险和较强的生物毒性而被认为是最重要的污染物之一[1-2].在农田土壤中,过量的镉主要是因人类活动造成的,如工业活动、运输、肥料和废物的不当处置[3-5].镉的水溶性、流动性和毒性很强,很容易被植物吸收,从而改变植物的结构和功能特性, 如抑制种子萌发、根系伸长,导致黄萎病等[6].镉对植物的胁迫也体现在代谢方面,如抑制叶绿素合成、光合作用[7]和抗氧化酶活性[8],从而减少生物量积累.
关于镉污染农田土壤的修复问题,普遍认为以超富集植物为核心的植物修复具有较广阔的应用前景.但由于报道的超富集植物大多数生长缓慢且生物量较低,特别是气候或地理条件也限制了其在植物修复中的应用[4,9].烟草(L.)是世界著名的经济作物,具有生长快、生物量大、环境适应性较强等突出的植物修复特性,对土壤中镉的吸收积累能力也较强,具有较强的修复能力[8.10-11].研究表明[12],烟草对重金属的富集程度相对较高,田间烟叶中镉的含量通常在0.5~5mg/kg之间,有时会更高.此外,烟草是人们日常吸食量很大的作物,烟叶中积累的镉可通过吸烟途径进入人体,而对人类健康构成威胁[13].因此,烟草对镉富集敏感性方面的研究具有一定的理论与实践意义.
关于镉在烟草中富集方面的研究已有报道,有的研究选择在烟草的苗期[7],但多数选择在成熟期,在旺盛期的研究较少[12-13].通常,烟草在苗期阶段由种子向营养生长期生长的时间较短,适应能力相对较弱,对重金属抵抗能力较差,对镉敏感性反应可能不太真实.成熟期,烟草各项生理指标进入衰老阶段,也很难反应出对镉敏感的真实状态.而在旺盛期,烟草经过了苗期阶段对镉逐渐适应,各项生理指标也基本达到最旺盛的状态,选择这一时期能更恰当地反应烟草植物对镉的敏感性.特别是在旺盛期,烟草叶片基本上与成熟期大小相当,而叶片是人们吸食烟草的主要部位,测定这一时期叶片中镉含量也具有较重要的指标意义.本试验在土壤不同镉污染条件下,通过测定旺盛期烟草的生物量、光合特性、镉含量和MDA含量以及SOD活性等指标来揭示其对镉的敏感性.
1 材料与方法
1.1 土壤盆栽试验
烟草品种为云烟99,由陕西省烟草研究所提供.试验在陕西理工大学网室进行.供试土壤为黄褐土,采自陕西理工大学试验地的耕层土壤(0~20cm).土壤pH值为6.5,全氮含量1.71g/kg,有机质含量26.8g/kg,有效钾含量为17.3mg/kg,有效磷含量16.8mg/kg,土壤Cd含量为0.18mg/kg,与国家土壤环境质量标准农用地土壤污染风险管控标准(试行)(GB15618-2018)相比是镉的非污染土壤[14].将供试土壤风干后过2mm筛备用.
每盆装2.5kg土壤.试验共设置5个处理,每个处理重复3次.对照,即未投加镉处理(CK).Cd污染处理,添加镉后土壤镉含量分别为4.43 (S1),7.94 (S2), 17.33 (S3)和49.79mg/kg (S4).加入镉的形态为CdCl2×2.5H2O,为优级纯试剂.每盆加入3g(NH4)2SO4作为肥料,平衡2个月后进行试验.选取饱满、无病虫害烟草种子,用0.1%的HgCl2消毒10min,用水清冼后,每盆播种10粒.在自然光照条件下培养,出苗15d后间苗,每盆留6株长势均匀的幼苗.根据盆栽土壤缺水情况,不定期浇自来水(水中未测出镉),使土壤含水量为田间最大持水量的75%左右,未喷农药.在烟草的旺盛期,即生长60d后收获.
1.2 测定项目及方法
1.2.1 生物量 收获时用自来水将植株根系冲洗干净,植株的根、茎和叶使用白纸分开包装,105℃杀青15min,70℃烘干至恒重,用天秤称取其根、茎和叶的干重[15].
1.2.2 镉含量测定 镉含量采用原子吸收分光光度计(Hitachi180-80)测定.将烟草根、茎和叶样品,以及茎和叶混合样品(用于测定地上部镉含量)研磨成粉末,称取1.000g,放入100mL烧杯中,分别加入浓硝酸和高氯酸(9mL:3mL)后,摇匀放置过夜.第2d在电热板上加热消煮,待样品消煮至白色结晶,冷却后加入5%的硝酸定容至25mL待测定.土壤样品中Cd全量采用同样的方法测定[16].标准物质GBW07405 (GSS-5)用于质量控制与评价[16].
1.2.3 叶绿素含量测定 采用紫外分光光度计法进行测定.取长势一致的完全展开的第5叶,0.200g新鲜叶片研磨后加入80% (/)的丙酮定容, 3000r/ min离心5min后,以80%丙酮作为空白调零,于665,649和470nm处分别测定吸光度并计算叶绿素a (Chl),叶绿素b (Chl)和类胡萝卜(Car)的含量[15].
1.2.4 光合参数测定 光合参数采用美国CID公司生产的CI-340便携式光合仪进行测定.于早8:00~10:00测定烟草第6~8完全展开叶片的净光合速率(P),蒸腾速率(),气孔导度(),胞间CO2浓度(C).测定时,叶室配备LED光源,设定红蓝光源叶室,测定烟草叶片气体交换参数,每次测定重复3~4次,辐射强度设定为1000μmol/(m2×s),测定条件CO2浓度定为400μmol/mol,叶室温度设为27℃,相对湿度设为65%[15].
1.2.5 超氧化物歧化酶(SOD)活性测定 取0.500g剪碎的新鲜样品,置预冷研钵中,加8mL含1% PVP 的50mmol/L, pH 7.8的冷磷酸缓冲液及少量石英砂,在冰浴中研磨成匀浆,于2℃ 20000×g冷冻离心20min,上清液即为酶提取液.参照Dai等[17]方法测定此酶液SOD活性.
1.2.6 丙二醛(MDA)测定 以Wu等[18]的硫代巴比妥酸(TBA)法测定MDA含量,取酶液2.0mL,加入2.0mL 0.5%的硫代巴比妥酸(溶于20%的三氯乙酸)溶液.上清液即为酶提取液在532,600和450nm波长下测定吸光值.
1.3 数据处理与统计分析
数据用EXCEL2010计算3次重复的平均值和标准差,用统计软件SPSS12.0通过LSD法进行方差分析和多重比较(<0.05).
2 结果与分析
2.1 烟草对不同浓度镉的富集特征
表1表明,随着土壤中镉含量的增加,烟草根、茎、叶及地上部镉含量也显著提高(S1~S4).在土壤中镉含量最高时(S4),烟草各部位镉含量均达到最大值.但在所有镉处理中,烟草茎或叶的镉含量均未达到镉超富集植物应达到的临界含量标准100mg/kg[4].施加镉的处理S1~S4中,烟草茎、叶及地上部镉的富集系数均大于1,烟草对镉的转移系数也大于1,表现出镉超富集植物的部分富集特征,如超富集植物龙葵对镉的富集系数和转移系数均大于1[4].
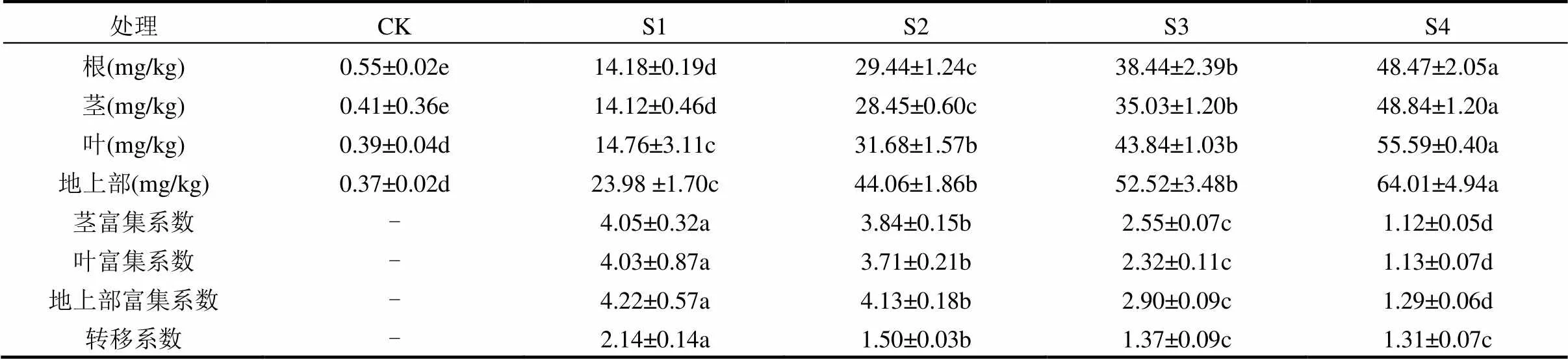
表1 烟草不同部位的镉含量及富集系数和转移系数
注:同行数据后不同字母表示处理间差异显著(<0.05),下同.“-”没有意义.
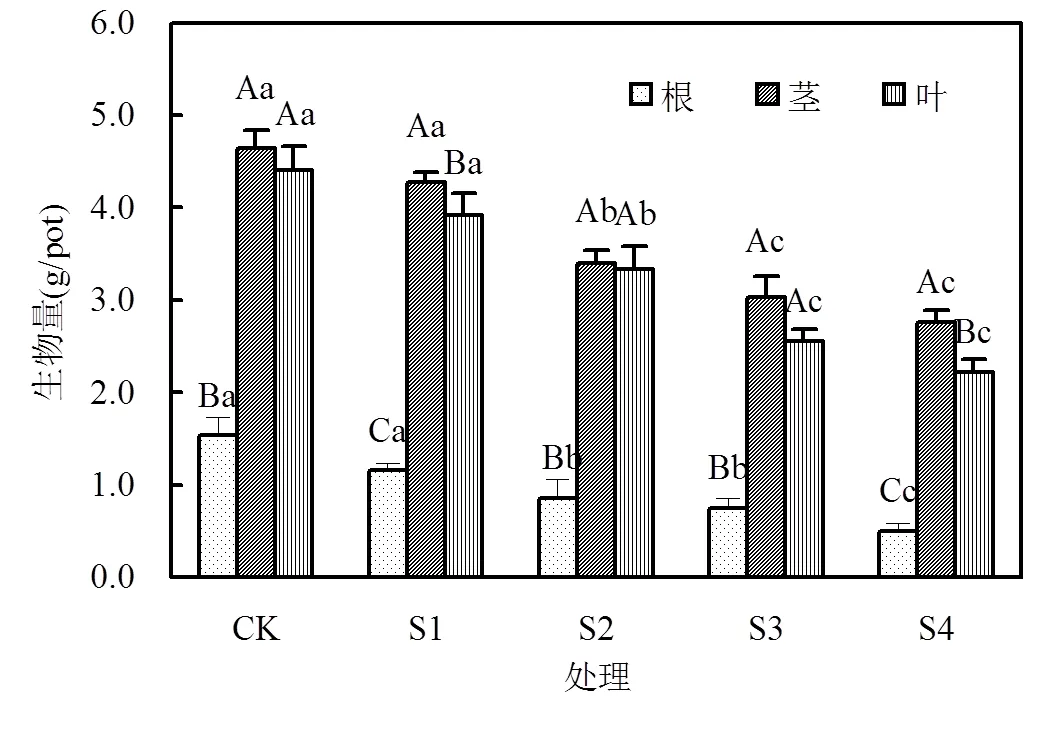
图1 镉对烟草生物量的影响
不同大写字母表示不同器官之间有显著差异(<0.05),不同小写字母表示不同浓度之间有显著差异(<0.05),下同
在烟草生长的旺盛期,所有处理的烟草均能正常生长,植株未出现肉眼可见的中毒症状,表明烟草对镉具有较强的耐受能力.如图1所示,在S1处理下,根、茎和叶的生物量与对照相比均未显著下降;在S2~S4处理中,烟草根、茎和叶片生物量出现显著下降,较对照分别减少了67.4%、40.6%和49.6%.说明高浓度镉污染对烟草生长有明显的抑制作用,这与镉超富集植物对镉具有较强的耐性有较明显的区别,如超富集植物龙葵积累的镉含量超过100mg/kg时其生物量仍然没有下降[4].
2.2 镉对烟草生理生化指标的影响
2.2.1 镉对烟草叶片光合色素含量的影响 表2可见,与CK相比,处理S1烟草叶片中叶绿素a、b和胡萝卜素含量无显著差异,处理S2~S4的叶绿素a、b和类胡萝卜素含量则逐渐降低(<0.05).这一结果与镉对烟草生物量的影响相一致.

表2 烟草叶片光合色素含量(mg/kg FW)
2.2.2 镉对烟草光合性能的影响 当土壤中镉含量未超过4.43mg/kg (S1)时(表3),烟草叶片净光合速率、蒸腾速率、气孔导度和胞间CO2浓度与对照(CK)相比,均未显著下降.但当土壤中镉含量大于7.94mg/kg (S2)时,烟草叶片净光合速率、蒸腾速率和气孔导度分别比对照降低了43.4%~76.5%、67.7%~82.6%和50.6%~76.9%,而胞间CO2浓度则显著增加84.8%~2.17倍(<0.05).

表3 烟草的光合参数
2.2.3 镉对烟草SOD活性的影响 当土壤中镉含量为4.43mg/kg (S1)时(图2),烟草根、茎和叶的SOD活性与对照(CK)相比均未显著下降;但当土壤中Cd含量大于7.94mg/kg (S2)时,烟草根、茎和叶的SOD活性比对照分别降低了43.2%~72.5%, 44.5%~ 62.5%和27.8%~45.2%.
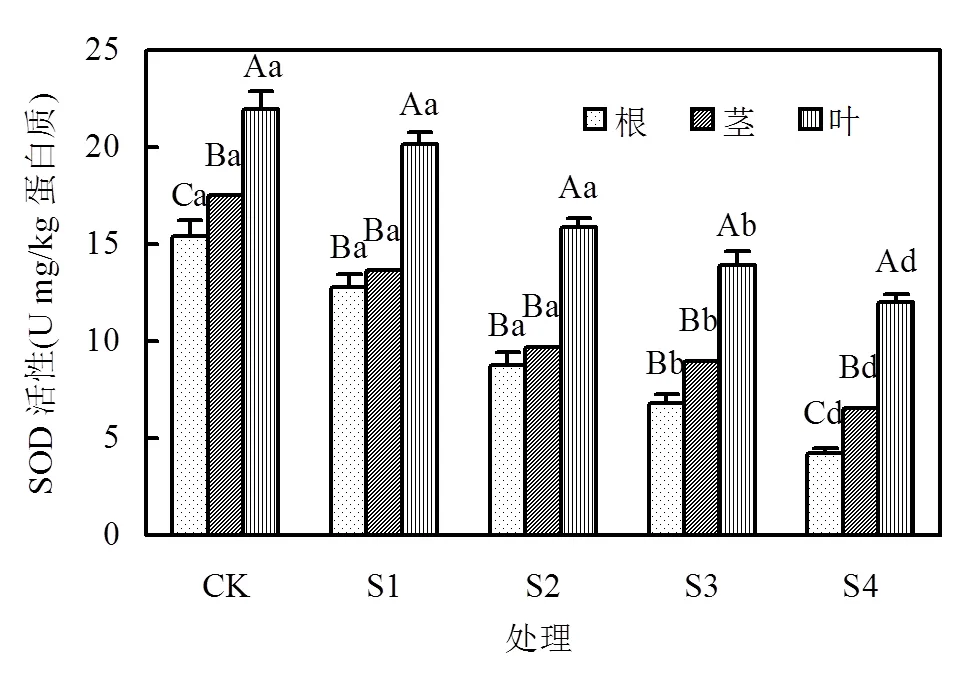
图2 烟草各部位SOD活性
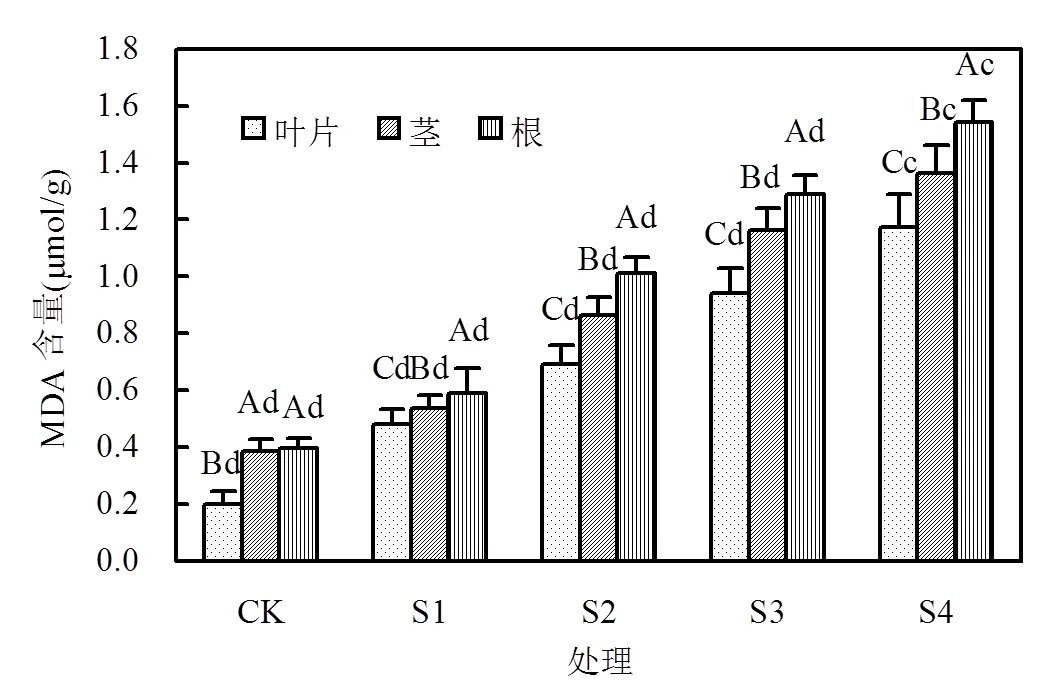
图3 烟草各部位MDA含量
2.2.4 镉对烟草丙二醛(MDA)含量的影响 图3表明,当土壤中镉含量为4.43mg/kg (S1)时,烟草根、茎和叶MDA含量与对照(CK)相比均未显著增加;但当土壤中镉含量大于7.94mg/kg (S2)时,烟草根、茎和叶MDA含量分别比对照增加了1.44~3.14倍、1.25~2.54和1.55~2.88倍.
3 讨论
通常认为,镉超富集植物具有的4个基本特征是植物的茎或叶的镉含量大于100mg/kg,富集系数和转移系数大于1,且有较强的耐性,即与对照相比,生物量未显著下降[4].当土壤中镉含量为25mg/kg时,龙葵茎及叶的镉含量大于100mg/kg,富集系数和转移系数大于1,且生物量没有下降,是镉的超富集植物[4].本文中,烟草的富集系数和转移系数虽都大于1,但茎及叶的镉含量均小于100mg/kg,且当土壤镉含量大于7.94mg/kg时,生物量显著下降.说明烟草仅具有镉超富集植物的部分特征,即对镉的富集能力和转移能力均较强.但烟草对镉的耐性较弱.这些结果说明烟草对镉的富集较为敏感.
叶绿素含量的高低可以在一定程度上反映光合作用水平.叶绿素含量降低,光合作用减弱,会导致植物生长受抑制,生物量下降[15-16,20].高浓度镉污染使烟草叶片叶绿素含量显著降低,可能是由于镉抑制了相关酶的活性,进而抑制了叶绿素前体的合成,促进叶绿素分解,或直接破坏叶绿体结构,从而降低叶绿素含量[15].这与镉胁迫下番茄[15]和三叶鬼针草[16]等植物的研究结果相一致.此外,烟草的光合参数净光合速率、蒸腾速率、气孔导度和胞间CO2浓度在镉胁迫下也都发生显著变化,与赖秋羽[15]报道番茄对大于8mg/kg的土壤镉产生敏感相比,烟草是土壤镉的敏感作物.其在17.33~49.79mg/kg镉胁迫下,旺盛期烟草的生长受到了显著抑制作用,原因可能是镉抑制了烟草的正常生理代谢,产生光抑制现象,使旺盛期烟草生物量下降.相同处理中,SOD活性与MDA 含量的变化也从植物对镉的抗氧化作用侧面反应了这一影响机制[18-24].总的来看,镉对烟草生理生化指标的影响与其对生物量的影响基本一致,这也从生理生化指标方面揭示了烟草对镉富集的敏感性.本研究与番茄中研究结果相一致,可能与番茄和烟草同是茄科植物有关.
本研究的结果表明,旺盛期烟草对镉的富集能力较强(富集系数大于1),对镉的转移能力也较强(转移系数大于1),说明烟草可能较容易地从镉污染土壤或镉背景值较高的土壤吸收富集镉,并将镉由根转移到地上部茎和叶.又由于烟草对镉的耐性较低,土壤中镉可能会对烟草的生长产生抑制作用.烟草对镉富集的这种敏感性,除了可能会影响其烟叶产量,还可能因积累了过多的镉而使吸烟的人的身体健康受到进一步的伤害.因此,在种植烟草时,应远离镉污染土壤或镉背景值较高的土壤.
4 结论
烟草云烟99在旺盛期对镉具有较强的富集能力,富集系数和转移系数均大于1,但镉含量未达到镉超富集植物的临界含量标准,其对镉的去除率与龙葵相比仍然较低.说明这个烟草品种对镉的敏感性较高.
[1] 李 元,祖艳群.重金属污染生态与生态修复 [M]. 北京:科学出版社, 2016.
Li Y, Zu YQ. Heavy metal pollution ecology and ecological remediation [M]. Beijing: Science Press, 2016.
[2] 环境保护部,国土资源部.全国土壤污染状况调查公报 [R]. 北京:环境保护部,国土资源部, 2014.
Ministry of environmental protection, Ministry of land and resources. National investigation bulletin on soil pollution [R]. Beijing: Ministry of environmental protection, Ministry of land and resources, 2014.
[3] Yang W, Dai H P, Skuza L, et al. The front-heavy and back-light nitrogen application mode to increase stem and leaf biomass significantly improved cadmium accumulation inL. [J]. Journal of Hazardous Materials, 2020,393:122482.
[4] 魏树和,周启星,王 新,等.一种新发现的镉超积累植物龙葵(L.) [J]. 科学通报, 2004,(24):2568-2573.
Wei S H, Zhou Q X, Wang X, et al. A newly-discovered Cd-hyperaccumulatorL. [J]. Chinese Science Bulletin, 2004,(24):2568-2573.
[5] Yang QQ, Li ZY, Lu XN, et al. A review of soil heavymetal pollution from industrial and agricultural regions in China: Pollution and risk assessment [J]. Science of The Total Environment, 2018,642:690-700.
[6] Ali H, Khan E, Sajad MA, et al. Phytoremediation of heavy metalsdconcepts and applications [J]. Chemosphere 2013,91(7):869- 881.
[7] Feng X, Liu WX, Sehar S, et al. Application of sulfur fertilizer reduces cadmium accumulation and toxicity in tobacco seedlings () [J].Plant Growth Regulation, 2018,85:165-170.
[8] Liu L, Li YF, Tang JJ, et al. Plant coexistence can enhance phytoextraction of cadmium by tobacco (L.) in contaminated soil [J]. Journal of Environmental Sciences, 2011, 23(3):453–460.
[9] 李文学,陈同斌.超富集植物吸收富集重金属的生理和分子生物学机制 [J]. 应用生态学报, 2003,14(4):627-631.
Chen W X, Chen T B. Physiological and molecular biological mechanisms of heavy metal absorption and accumulation in hyperaccumualtors [J].Chinese Journal of Applied Ecology, 2003, 14(4):627-631.
[10] 罗 勇,焦桂珍,刘胜波,等.不同浓度镉对烟草幼苗生长发育及生长素相关基因表达的影响 [J]. 中国农业科技导报, 2021,23(1):58-65.
Luo Y, Jiao G Z, Liu S B, et al. Effects of cadmium with different concentrations on seeding growth and auxin-related gene expression of tobacco [J]. Journal of Agricultural Science and Technology, 2021, 23(1):58-65.
[11] Duan Q, Lee J, Liu Y, et al. Distribution of heavy metal pollution in surface soil samples in China: a graphical review [J]. Bulletin of Environmental Contamination and Toxicology. 2016,97(3):303-309.
[12] Keller C, Marchetti M, Rossi L, et al. Reduction of cadmium availability to tobacco () plants using soil amendments in low cadmium-contaminated agricultural soils: a pot experiment [J]. Plant and Soil, 2005,276:69-84.
[13] Lu JZ, Lu HW. Enhanced Cd transport in the soil-plant-atmosphere continuum (SPAC) system by tobacco (L.) [J]. Chemosphere, 2019,225:395-405.
[14] GB15618-2018 国家土壤环境质量标准农用地土壤污染风险管控标准(试行) [S]. 2018.
GB15618-2018 National standard for soil environmental quality and risk control of soil pollution in agricultural land (Trial implementation) [S]. 2018.
[15] 赖秋羽,魏树和,代惠萍,等.番茄光合荧光特性及其镉吸收对土壤镉污染的响应 [J]. 中国环境科学, 2019,39(11):4737-4742.
Lai Q Y, Wei S H, Dai H P, et al. Response of photosynthetic characteristics and fluorescence parameters of tomato to Cd in soil [J]. China Environmental Science, 2019,39(11):4737-4742.
[16] Dai H P, Wei S H, Skuza L, et al. Phytoremediation of two ecotypes cadmium hyperaccumulatorL. sourced from clean soils [J]. Chemosphere, 2021,273:129652.
[17] Dai H P, Shan C J, Zhao H, et al. The difference in antioxidant capacity of four alfalfa species in response to Zn [J]. Ecotoxicology and Environmental Safety, 2015,114:312-317.
[18] 孟 楠,王 萌,陈 莉,等.不同草本植物间作对Cd污染土壤的修复效果[J]. 中国环境科学, 2018,38(7):2618-2624.
Meng N, Wwang M, Chen L, et al. Remediation efficiency of Cd polluted soil by intercropping with herbaceous plants [J]. China Environmental Science, 2018,38(7):2618-2624.
[19] 李 洋,张乃明,魏复盛.滇东镉高背景区菜地土壤健康风险评价与基准[J]. 中国环境科学, 2020,40(10):4522-4530.
Li Y, Zhang N M, Wei F S.A benchmark study on soil health risks of vegetable fields in a high-cadmium background area in eastern Yunnan [J]. China Environmental Science, 2020,40(10):4522-4530.
[20] Sun X L, Xu Y, Zhang Q Q, et al. Combined effect of water inundation and heavy metals on the photosynthesis and physiology of[J].Ecotoxicology and Environmental Safety, 2018,153:248-258.
[21] Anna A, Wojciech P, Agnieszka B R, et al. Time-dependent changes in antioxidative enzyme expression and photosynthetic activity ofcells under acute exposure to cadmium and anthracene [J]. Ecotoxicology and Environmental Safety, 2014, 110:31-40.
[22] Szopiński M, Sitko K, Rusinowski S, et al. Different strategies of Cd tolerance and accumulation inand[J]. Plant, Cell & Environment, 2020,43(12):3002-3019.
[23] 崔祥芬,张 琴,王晋昆,等.中国稻田土壤镉污染及务农性镉暴露概率风险评估[J]. 中国环境科学, 2021,DOI:10.19674/j.cnki. issn1000-6923.20210312.00.
Cui X F, Zhang Q, Wang J K, et al. Status of cadmium in Chinese paddy soil: pollution and probabilistic health risk via agricultural contact [J]. China Environmental Science, 2021.DOI:10.19674/j.cnki. issn1000-6923.20210312.00.
[24] Zhang H H, Li X, Xu Z S, et al. Toxic effects of heavy metals Pb and Cd on mulberry (L.) seedling leaves: Photosynthetic function and reactive oxygen species (ROS) metabolism responses[J]. Ecotoxicology and Environmental Safety, 2020,195:110469.
Sensitivity ofL. accumulating cadmium at its vigorous growth stage.
KONG Xiang-fang1, WEI Shu-he2*, ZHAO Ji-rong1, DAI Hui-ping1**, JIA Gen-liang3
(1.College of Biological Science & Engineering, Shaanxi University of Technology, Hanzhong 723001, China;2.Key Laboratory of Pollution Ecology and Environment Engineering, Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, China;3.College of Science, Northwest A & F University, Yangling 712100, China)., 2021,41(10):4872~4877
Pot experiments were conducted to reveal the characteristics of cadmium (Cd) accumulation inL. (Yunyan 99) at vigorous stage and the response of physiological indexes like photosynthesis to Cd stress. The results showed that the enrichment factor (ratio of Cd concentration in plant to soil) and translocation factor (ratio of Cd concentration in shoot to root) of Cd in tobacco stems, leaves and shoots were all greater than 1, but the Cd concentration of them did not reach the critical content standard of 100mg/kg in the treatments of 4.43mg/kg, 7.94mg/kg, 17.33mg/kg or 49.79mg/kg Cd in soils. When the Cd concentration in soil was 4.43mg/kg, the tolerance of tobacco was stronger. When soil Cd content was higher than 7.94mg/kg, tobacco biomass, photosynthetic pigment content, net photosynthetic rate, transpiration rate, stomatal conductance and SOD activity were significantly decreased (<0.05), while intercellular CO2and MDA content was significantly increased (<0.05). It is suggested that tobaccois sensitive to Cd accumulation in vigorous period, and should be planted far away from Cd contaminated soil or soil with high Cd background value.
cadmium;L.;vigorous growth stage;sensitivity
X53
A
1000-6923(2021)10-4872-06
孔祥方(1998-),女,黑龙江哈尔滨人,陕西理工大学硕士研究生,研究方向为植物对重金属的富集机理.
2021-02-22
国家自然科学基金资助项目(31870488,41571300);国家高端外国专家项目(G20200241015);秦巴生物资源与生态环境国培重点实验室开放课题(SLGPT2019KF04-02)
* 责任作者, 研究员, shuhewei@iae.ac.cn; ** 教授,daihp72@snut.edu.cn

