链球菌毒性噬菌体的分离与生物学特性研究
徐凤宇,邱子怡,孙 亮,马红霞,高云航,么乃全
(1.吉林农业大学动物科学技术学院,吉林 长春 130118;2.动物生产及产品质量安全教育部重点实验室,吉林 长春 130118)
链球菌分布广泛,有些可致人或动物败血症、乳腺炎、肺炎、化脓性疾病及脑脓肿等[1]。随着抗生素广泛应用,链球菌对抗生素的耐药性逐渐增强,关琳等[2]报道15株猪链球菌9型对大环内酯类及林可胺类耐药率为100%,对四环素及链霉素耐药率为93.3%,所有菌株达七重耐药。主动外排机制和靶位修饰、核糖体保护蛋白、钝化或灭活抗生素、产生生物被膜等是链球菌耐药的原因[3];猪链球菌对杆菌肽的抗性与包含SstF、SstE、SstG的ABC 转运系统有关[4]。为防治链球菌病,研究者不懈开发新生物防治剂,内溶素、噬菌体及其裂解酶[5-6]等成为研究目标。
除直接防治链球菌病外,噬菌体在链球菌群体形成、遗传变异、致病性、抗生素抗性等方面也扮演重要角色[7];研究噬菌体可帮助了解细菌生态学和进化,如含噬菌体SMP的溶原性猪链球菌SS2-4(SMP)毒力明显强于野生株、生长更快、菌链变短[8];噬菌体也被添加于选择培养基,抑制杂菌生长,降低分离培养假阴性率[9]。本研究以分离自牛子宫内膜炎的致病性链球菌为宿主,分离链球菌毒性噬菌体,研究其主要生物学特性,为更深入研究和应用链球菌噬菌体提供资料。
1 材料与方法
1.1 菌株 宿主菌链球菌48株,由本实验室分离自患子宫内膜炎的奶牛子宫;指示菌S-1株、S-2株、S-3株、S-4株、S-5株、S-6株、S-7株、S-8株、S-9株、S-10株链球菌,由本实验室分离鉴定并保存。
1.2 主要试剂与仪器 DNaseI、RNaseA,均购自北京鼎国昌盛生物技术有限责任公司;限制性内切酶,购自宝生物工程(大连)有限公司;TSA、TSB培养基,购自青岛高科技工业园海博生物技术有限公司;上层TSB培养基(含0.75%琼脂)、下层TSA培养基、2×TSB培养液按说明书配制;SM液按《分子克隆实验指南》(第3版)[10]附录1配制。Himac CP100MX超速离心机由日立公司生产;TEM-100CX透射电镜由TEOLLTD公司生产。
1.3 方法
1.3.1 宿主菌的准备 取冻存的宿主菌在TSA平板上划线培养,次日取单菌落于5 mL TSB培养基中,37 ℃、150 r/min 振摇培养。
1.3.2 噬菌体的分离、纯化 以链球菌悬液为宿主,用2×TSB作浓缩培养基,以从长春市某处新采集的污水为样品,参考文献[11]中材料与方法3,37 ℃ 分离噬菌体,重复增殖5次,12 000 r/min离心15 min,细菌滤器过滤得拟含链球菌噬菌体的原液。
点滴法验证:将100 μL过夜培养的链球菌(浓度约1.0×106CFU/mL)于TSA平板上涂匀,静置20 min,滴加噬菌体原液5 μL,阴性对照组滴加等量生理盐水,37 ℃培养12 h后观察。
双层平板法纯化噬菌体:参考文献[11]中材料与方法5进行,略有改动。
1.3.3 噬菌体的电镜观察 取适当稀释噬菌体,经双层平板培养成噬菌斑网,加入3 mL SM液,4 ℃冰箱中振荡10 h,吸出噬菌体液,12 000 r/min离心20 min,取上清30 μL滴于铜网上,静置30 s,2%磷钨酸负染90 s,晾干,透射电镜观察。
1.3.4 噬菌体基因组酶切分析 参考文献[10]中从大规模培养物提取λ噬菌体基因组方法得噬菌体核酸,分别用BlnⅠ、EcoR Ⅰ、BamH Ⅰ、NcoI和Xhol I将核酸在适宜温度下酶切10 h,1%琼脂糖凝胶电泳检测酶切片段。
1.3.5 噬菌体效价测定及裂解谱分析 用TSB培养基将噬菌体原液10倍梯度稀释,将100 μL宿主菌液、氯化钙和100 μL适当稀释的噬菌体混匀,静置,移入50 ℃保温的半固体培养基,铺双层平板,37 ℃培养12 h,记噬菌斑数。噬菌体效价(PFU/mL)=平均噬菌斑数×稀释倍数×10。
点滴法分析噬菌体裂解谱:将10株指示菌(106CFU/mL)各100 μL分别均匀涂于TSA培养基表面,室温静置30 min后,滴加5 μL纯化噬菌体液,吸收5 min,37 ℃培养过夜,观察细菌、噬菌体生长情况。
1.3.6 氯仿、乙醚敏感性测定 (1)氯仿敏感性测定:将50 μL氯仿与950 μL噬菌体液(6.2×108PFU/mL)混匀,对照组不加氯仿,4 ℃冰箱孵育过夜,测噬菌体效价。(2)乙醚敏感性测定:将200 μL 乙醚与800 μL噬菌体液(6.2×108PFU/mL)混匀,对照组不加乙醚,冰浴振荡1 h,3 000 r/min离心15 min,测噬菌体效价。
1.3.7 噬菌体的热稳定性与酸碱稳定性测定 设8个不同水浴温度,在每个温度下放1支装有1 mL新扩增噬菌体液的1.5 mL EP管,分别作用20、40 min 和60 min,取出冷却至室温,测效价。
用1.5 mL灭菌EP管分装900 μL pH 2~13的TSB培养基,37 ℃水浴预热30 min,在各离心管中分别加入100 μL噬菌体液,混匀,继续放置3 h,取出置室温下测效价。
1.3.8 最佳感染复数测定 取对数期宿主菌,适当稀释噬菌体和宿主菌悬液,按表1加入等量噬菌体和宿主菌,37 ℃ 50 r/min振荡培养5 h,4 ℃下12 000 r/min 离心30 min,取上清液,用双层平板测各组效价,筛选最佳感染复数(Multiplicity of infection,MOI)。
1.3.9 一步生长曲线绘制 按最佳MOI将宿主菌与噬菌体混匀,37 ℃水浴中孵育15 min,4 ℃、12 000 r/min 离心60 s,弃上清,用TSB洗涤沉淀2次,加入37 ℃预热TSB培养基,37 ℃ 50 r/min振摇培养,每隔10 min取500 μL培养物,4 ℃、12 000 r/min离心20 min,取上清测噬菌体效价。以效价对数为纵坐标,以感染时间为横坐标绘制一步生长曲线。
2 结果
2.1 噬菌体分离纯化 富集5次后,点滴法验证结果表明,链球菌48株生长的TSA平板上滴加噬菌体原液处呈明显噬菌现象,对照处菌苔正常,说明原液中含链球菌毒性噬菌体。经反复纯化,得空斑一致、清晰透亮、边缘整齐的纯化噬菌体(培养12 h),命名为SP48。
2.2 噬菌体电镜观察 透射电镜观察到SP48呈蝌蚪状复合对称,头部大小(79.0±0.33)nm×(73.0±0.38)nm,尾长(354±0.25)nm,属于长尾噬菌体科(图1)。
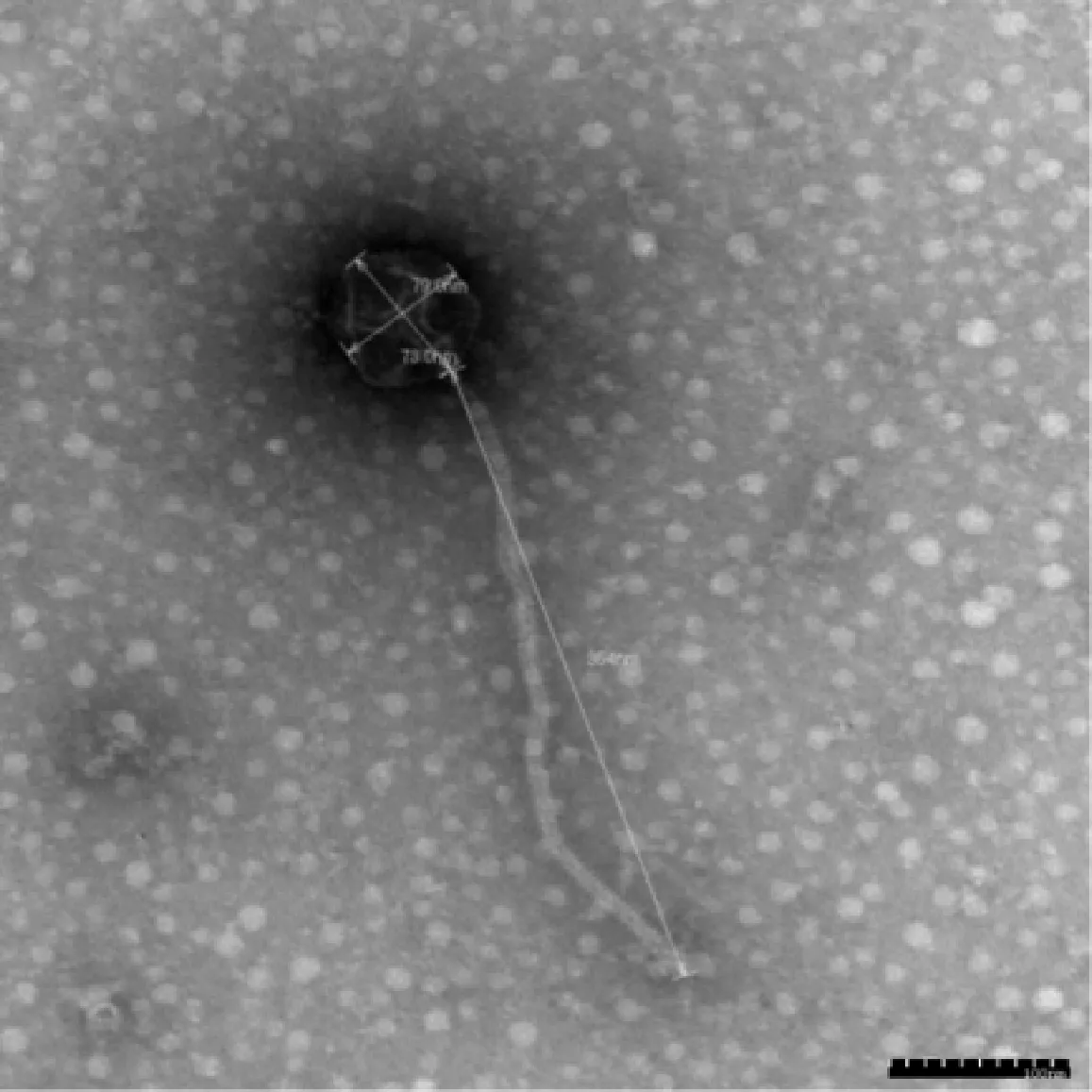
图1 噬菌体SP48电镜图Fig.1 Electron micrograph of phage SP48
2.3 噬菌体基因组酶切分析 分别用BlnⅠ、EcoR Ⅰ、BamH Ⅰ、NcoⅠ、XholⅠ酶切,电泳发现,SP48含有EcoR Ⅰ、XholⅠ和BlnⅠ的酶切位点,表明噬菌体SP48核酸为双链DNA。经EcoR Ⅰ酶切可见7个条带,经XholⅠ酶切可见5个条带,经BlnI酶切可见3个条带(图2),与Marker比对、计算可知噬菌体SP48的基因组大于60 kb。
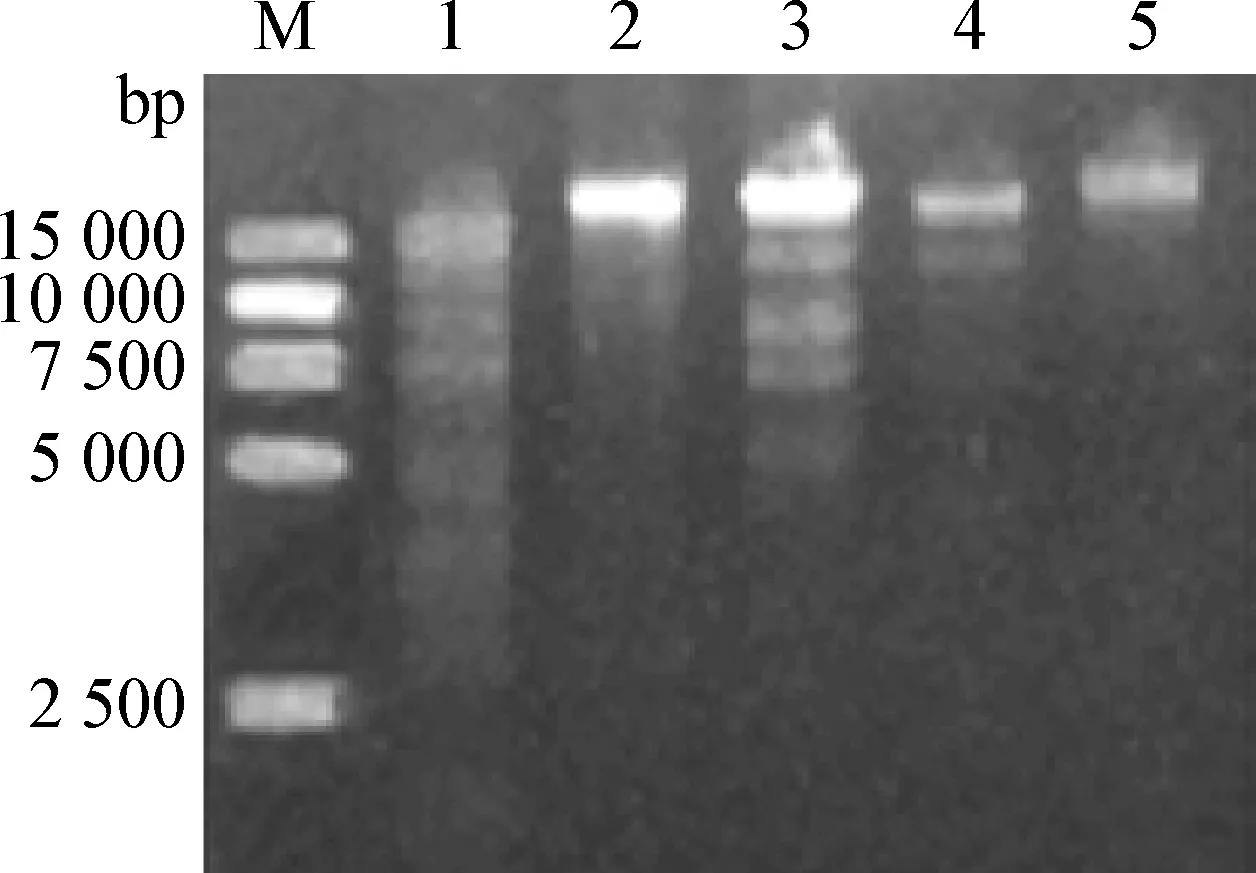
图2 噬菌体SP48基因组酶切电泳图Fig.2 Enzyme digestion of phage SP48 genomeM:DL-15 000 marker;1:EcoR Ⅰ的酶切产物;2:BamH I的酶切产物;3:XholⅠ的酶切产物;4:BlnⅠ的酶切产物;5:NcoⅠ的酶切产物M:DL-15 000 marker;1:Products of EcoR Ⅰ digestion;2:Products of BamH I digestion;3:Products of XholⅠ digestion;4:Products of Bln Ⅰ digestion;5:Products of Nco Ⅰ digestion
2.4 噬菌体的效价测定及裂解谱分析 经双层平板法测得噬菌体SP48的效价为6.2×108PFU/mL。点滴法测定SP48的宿主谱,发现其仅裂解宿主菌链球菌48株,说明其特异性很强。
2.5 氯仿、乙醚敏感性试验 乙醚、氯仿分别与噬菌体SP48作用后,测得效价分别为5.8×108PFU/mL和4.3×108PFU/mL,说明噬菌体SP48对乙醚和氯仿不敏感,推测其无囊膜。
2.6 噬菌体的热稳定性与酸碱稳定性 SP48的热稳定性结果见中插彩版图3,在40~45 ℃作用60 min 后的效价低于作用20 min和40 min的效价;50 ℃以下作用时间短于40 min时,对噬菌体感染性几乎无影响;高于50 ℃作用60 min时,噬菌体效价明显降低;60 ℃作用20 min噬菌体SP48完全失活。
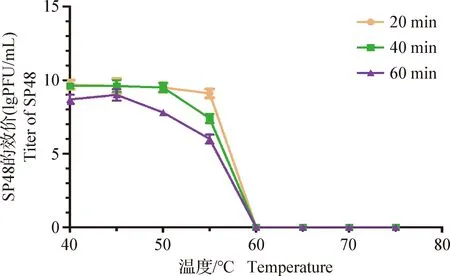
图3 噬菌体SP48的热稳定性Fig.3 Thermal stability of phage SP48
噬菌体SP48在pH 5~10的条件下效价变化不大(图4),在强酸或强碱环境下(pH≤4或≥12时)失活。
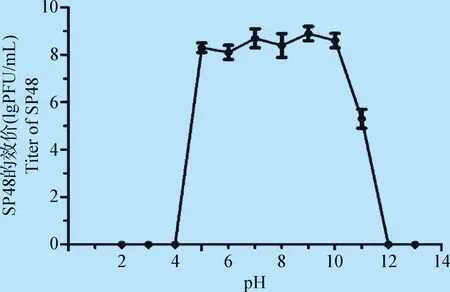
图4 噬菌体SP48的pH稳定性Fig.4 Stability of phage SP48 in different pH conditions
2.7 噬菌体的最佳MOI测定 当MOI为10时,噬菌体SP48的效价为2.6×109PFU/mL,在7个MOI中最高,为最佳MOI(表1)。

表1 噬菌体SP48最佳感染复数测定结果Table 1 Determination results of optimal multiplicity of infection of phage SP48
2.8 噬菌体的一步生长曲线 绘制噬菌体SP48的一步生长曲线(图5),发现SP48感染宿主菌后30 min 内,噬菌体的效价变化不明显,此时处于潜伏期;在感染后的30~110 min,噬菌体效价逐渐升高,为爆发期;随后的40 min,噬菌体效价稳定;根据公式爆发量=爆发结束时噬菌体效价/感染初期宿主菌浓度,得SP48爆发量约45 PFU/cell。

图5 噬菌体SP48的一步生长曲线Fig.5 One-step growth curve of phage SP48
3 讨论
已报道的链球菌噬菌体基因组均为dsDNA,大多属长尾病毒科,一些属短尾病毒科,罕见肌尾病毒科成员[12]。Harhala等[13]分离到2株化脓链球菌溶原性噬菌体Str01和Str03,尾长分别为186 nm、162 nm,基因组分别为37 030 bp和32 296 bp;柏琴琴等[14]以无乳链球菌为宿主从乳腺炎奶样中分离出LYGO9、HZ04,从牛源无乳链球菌中诱导出溶原性噬菌体pA11,与该实验室前期分离的JX01均为长尾噬菌体,推算4株噬菌体的基因组约38~45 kb。本研究从污水中分离到的链球菌噬菌体SP48也属长尾噬菌体,基因组较前述链球菌噬菌体更大,尾更长。
关于链球菌噬菌体对环境抵抗力,Luo等[15]分离的无乳链球菌长尾噬菌体HN4对60~80 ℃和pH 3~5敏感;Harhala等[13]报道Str01、Str03在40 ℃下作用60 min 的存活率(88%、96%)低于作用15 min 的存活率(98%、100%),在60 ℃下作用15 min 可保持15%、23%的存活率,作用60 min全被灭活;本研究分离到的SP48在40~60 ℃时随作用时间延长和温度升高,存活率也降低。Str01、Str03在pH=7时最稳定,1 h存活率为92%、99%,5 h 存活率为83%、90%,在pH≤4或≥12环境下存活不超过1 h[13];SP48在pH≤4或≥12时存活3 h以下。无乳链球菌噬菌体LYGO9的潜伏期仅5 min,爆发期25 min,平均爆发量30 PFU/细胞[14];SP48较LYGO9的潜伏期、爆发期长,爆发量约为LYGO9的1.5倍,二者的杀菌能力有待试验确定。
噬菌体有一定裂解谱,能跨种裂解的噬菌体较少,也是用噬菌体用于细菌性疾病治疗的优势之一。链球菌噬菌体的裂解谱可能与宿主分型有关,Str01、Str03对37株A群链球菌的裂解率分别为13.5%、51%,对34株B群链球菌的裂解率分别为3%和0[13];噬菌体LYGO9、HZ04、pA11、JX01可裂解的链球菌荚膜多糖分型以Ⅰa居多,但并非所有Ⅰa型无乳链球菌均被裂解,8株荚膜多糖Ⅱ型菌均不被裂解[14]。查涛等[16]发现,噬菌体phiYe-F10对O∶3小肠结肠炎耶尔森菌的裂解率为84.5%,不裂解O∶5、O∶9血清型和其他菌株,而O抗原位于细胞壁脂多糖(LPS)外侧,推测与噬菌体phiYe-F10的受体相关。本研究获得的噬菌体SP48仅裂解宿主链球菌,不裂解10株指示菌,推测可能的原因为指示菌与宿主48株链球菌非同种或者非同型。

