整合素α5β1在苯妥英钠促进大鼠PDLSCs和BMMSCs黏附于牙骨质中的作用
赵俪月,巴晓晔,王宝彦
(1.广州市第一人民医院口腔科,广东 广州 510180;2.西安高新医院口腔科,陕西 西安 710075;3.西安交通大学附属口腔医院牙周黏膜科,陕西 西安 710004)
牙周炎作为一种慢性感染性疾病,是天然牙丧失的重要原因。治疗的难点是如何使已被破坏的牙周组织得到再生。牙周再生有两项基本要素,包括病损区存在未分化的干细胞[1],以及它们需要首先黏附于病损区的牙根表面[2-3]。牙周膜干细胞(Periodontal ligament stem cells,PDLSCs)和骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMMSCs)是两种具有牙周再生能力的干细胞[4-7],常在牙周组织需要修复时迁移到受损区帮助修复[4,6]。它们通常会表达多种整合素,后者在细胞的黏附行为中起到关键作用[3、8],在整合素家族中,α5β1可能与PDSLCs和BMMSCs的黏附过程最为相关[9-10]。苯妥英钠(Phenytoin,PHT)已被证实具有促进rPDLSCs迁移到牙周缺损区及黏附于牙根表面的功能[11-12],但具体的机制尚不清楚。本项研究的目的旨在观察并对比PHT对rBMMSCs和rPDSLCs黏附于牙骨质的影响,并探究整合素α5β1在该过程中的作用。
1 材料与方法
1.1 rBMMSCs、rPDLSCs的分离及鉴定
1.1.1 rBMMSCs的原代培养 脱颈法处死6周龄SD大鼠,取股骨,用含20%FBS(Hyclone,美国)的DMEM-F12培养液(Hyclone,美国)反复冲洗骨髓腔。密度梯度离心法获得rBMMSCs。有限稀释法纯化细胞。
1.1.2 rPDLSCs原代培养 脱颈法处死6周龄SD大鼠;分离上下颌切牙,刮取根中1/3的牙周膜,采用常规酶消化法+组织块法获取rPDLSCs。有限稀释法纯化细胞。
1.1.3 rBMMSCs、rPDLSCs的鉴定 鉴定rBMMSCs、rPDLSCs的方法如下:①形态学观察、生长特性观察;②成骨、成脂诱导分化;③流式细胞术分析细胞表面标记物。
1.2 黏附实验
1.2.1 实验分组 将每个制好的相同大小牙骨质片置于96孔板内1孔内,使rBMMSCs、rPDLSCs分别与牙骨质片共同培养,并各分为4个处理组,A组:PBS(沃尔森,中国)处理,作为空白对照;B组:40 mg/L PHT(沃尔森,中国)处理;C组:40 mg/L PHT+整合素α5抗体(Millipore,美国)处理,D组:40 mg/L PHT+整合素β1抗体(Abcam,英国)处理,每组设6个重复孔。细胞密度为105个/mL,37℃、5%CO2条件下处理4 h。
1.2.2 黏附细胞计数 处理结束后,用DMEM-F12培养基冲洗牙骨质片两遍,再将它们放入新鲜的DMEM-F12培养基中,在旋转振荡仪上振荡3 min(75 rpm),以去除未黏附的或黏附力较弱的细胞。处理后的牙骨质片放于新的96孔板中,每孔加入100 μL DMEM-F12培养基和10 μL WST-8溶液(碧云天,中国),37℃、5%CO2条件下孵育2 h。之后将96孔板放入酶标仪,在450 nm波长条件下检测吸光度。用Image-ProPlus软件算得各牙骨质片的面积,算出16 mm2面积牙骨质片上的细胞的OD值。
1.3 PHT对rBMMSCs、rPDLSCs表达整合素α5、β1的影响
1.3.1 实时定量PCR测定细胞整合素α5β1的表达从GenBank(Pubmed)选取靶基因mRNA的全长序列,使用引物和探针设计软件Primer Express设计引物序列如下(见表1),所用引物序列乃由上海生工公司合成。

表1 引物序列
rBMMSCs、rPDLSCs分别在使用不含PHT、含PHT(40 mg/L)的DMEM-F12培养液(10%FBS,1%双抗)培养4 h后,收集细胞,提取RNA,经过浓度及纯度测定后,用反转录试剂盒(Takara,日本)反转录为cDNA,进行PCR扩增。qRT-PCR反应体系如下:cDNA溶液2 μL、上下游引物(10μM)各1 μL、dH2O 8.5 μL、SYBRPremixExTaqII(2×)12.5 μl,所用PCR试剂盒购于日本Takara。
具体反应条件:95℃30 s,1个循环;95℃5 s,60℃30 s,40个循环;95℃15 s,60℃30 s,95℃15 s,1个循环。以GAPDH作为内参,根据2-△△Ct算法,求出目的基因的相对表达量。
1.3.2 Western blot检测细胞整合素α5β1的表达rBMMSCs、rPDLSCs在使用不含PHT、含PHT(40 mg/L)的DMEM-F12培养液(10%血清,1%双抗)中各培养4 h后,收集细胞。用蛋白裂解液(沃尔森,中国)提取总蛋白,PAGE-SDS电泳分离蛋白,然后把蛋白凝胶转移到PVDF膜上,行转膜反应,放封闭液后,分别加入一抗【兔抗大鼠integrinα5单克隆抗体(Millipore,美国)、兔抗大鼠integrin-β1单克隆抗体(Abcam,英国)】,4℃振荡过夜。清洗后加入二抗,室温下孵育2 h,用凝胶成像仪对蛋白表达结果进行分析。
1.4 统计学方法
2 结果
2.1 rBMMSCs、rPDLSCs的鉴定
2.1.1 rBMMSCs、rPDLSCs的形态观察 rBMMSCs刚接种时为悬浮的圆形细胞。2 d换液后可见贴壁细胞,呈现出少量分散的梭性或不规则多突起的初始贴壁细胞。培养至第6~7 d,可见有细胞克隆形成,细胞由克隆中心向外扩散生长,并相互融合。细胞贴壁牢固,不易消化。筛选并传代以后的细胞渐向多角形细胞转化,不呈克隆样生长,为均匀分布于培养皿底部的生长状态(见图1A)。
图1 rBMMSCs和rPDLSCs(×100)
原代rPDLSCs细胞克隆形成平均在第7~14天,克隆内的细胞呈梭型、紧密相邻,中央细胞边界不清,形态为不规则或圆形,周边细胞为梭型、多角形。传代后细胞贴壁快、生长旺盛而均匀,呈长梭形,类似成纤维样细胞(见图1B)。
2.1.2 rBMMSCs、rPDLSCs体外诱导分化 ①成骨诱导 rBMMSCs、rPDLSCs在成骨诱导培养8 d后体积增大、生长旺盛,12 d左右细胞形态逐渐变为类似方形或多角形。21 d后可见矿化结节产生,茜素红染色阳性,对照组染色阴性(见图2-1、图2-2)。②成脂诱导 rBMMSCs、rPDLSCs成脂诱导5 d后,可见部分细胞变为多角形,第10天镜下观察见细胞体积增大,油红O染色见细胞内出现染色阳性的脂滴,对照组未见胞内有阳性染色的脂滴(见图3-1、图3-2)。成脂、成骨诱导结果说明本实验分离的细胞具有干细胞多向诱导分化潜能。

图2-1 rBMMSC的成骨诱导茜素红染色(×100)

图2-2 rPDLSCs的成骨诱导茜素红染色(×100)

图3-1 rBMMSC的成脂诱导油红O染色(×200)

图3-2 rPDLSCs的成脂诱导油红O染色(×200)
2.1.3 流式细胞仪检测rBMMSCs、rPDLSCs的表型流式细胞术检测结果显示rBMMSCs细胞表面分子CD90、CD44阳性表达率分别为96.3%和97.1%,CD45、CD34阳性表达率分别是1.9%和8.4%(见图4-1),rPDLSCs细胞表面分子CD29阳性表达率为97.8%、CD44阳性表达率为94.1%,CD45、CD34则分别为1.2%和9.3%(见图4-2)。均符合rBMMSCs、rPDLSCs表面特异性标志物特征。

图4-1 流式细胞仪鉴定rBMMSC表面标记物

图4-2 流式细胞仪鉴定rPDLSCs表面标记物
2.2 PHT对rBMMSCs、rPDLSCs黏附的影响与整合素α5β1的关系
经过PHT处理后,黏附于牙骨质片的rBMMSCs、rPDLSCs细胞数量多于对照组,但在干预过程中加入整合素α5或整合素β1抗体(C、D组),均使黏附于牙骨质片上的细胞数目减少,且C、D组的黏附细胞数量少于对照组(P<0.05)。各实验组内,将rBMMSCs与rPDLSCs的黏附数目对比,差异无统计学意义(P>0.05,见图5)。
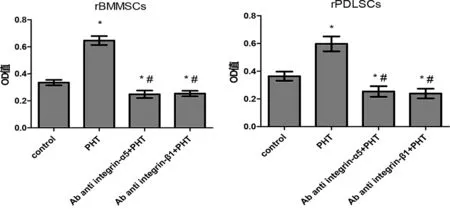
图5 整合素α5、β1抗体对PHT促进rBMMSCs、rPDLSCs黏附作用的影响
2.3 实时定量PCR检测PHT对rBMMSCs、rPDLSCs的整合素α5、β1表达的影响
与对照组相比,PHT处理后的rBMMSCs、rPDLSCs的整合素α5、整合素β1的基因表达量显著升高(P<0.01)。另外,无论在实验组还是对照组,将rBMMSCs与rPDLSCs的整合素α5、整合素β1mRNA表达量相比,差异均无统计学意义(见图6)。

图6 PHT对rBMMSCs、rPDLSCs表达整合素α5、β1mRNA的影响
2.4 Western blot检测PHT对rBMMSCs、rPDLSCs的整合素α5、β1表达的影响
与对照组相比,PHT处理后,rBMMSCs、rPDLSCs中整合素α5、整合素β1表达均增加(P<0.05)。在实验组内和对照组内,将rBMMSCs与rPDLSCs的整合素α5、整合素β1蛋白表达量相比,差异均无统计学意义(P>0.05,见图7)。
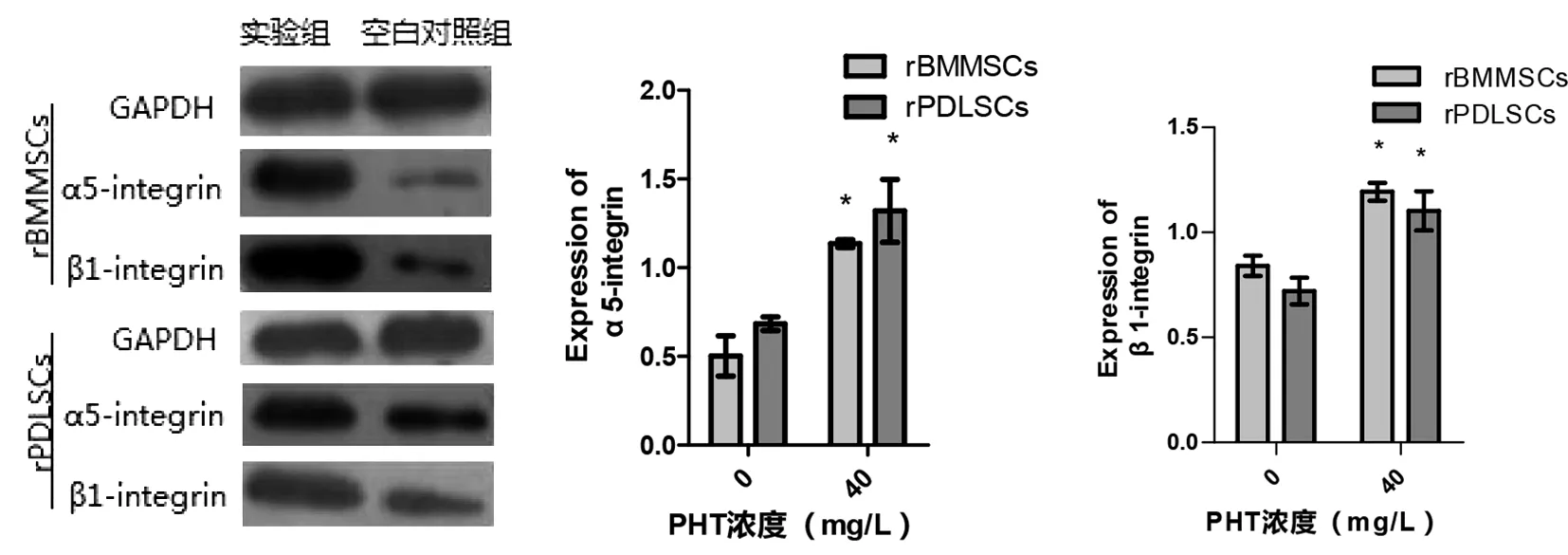
图7 PHT对rBMMSCs、rPDLSCs表达整合素α5、β1蛋白的影响
注:*:与对照组相比,P<0.05
3 讨论
牙周组织再生的基础是缺损区必须存在具有分化潜能的干细胞[1]。PDLSCs、BMMSCs具有间充质干细胞的特性,能够在组织受损后迁移到病损区,且在合适的理化条件下分化为成骨细胞、成牙骨质细胞、成纤维细胞从而形成牙周软硬组织,是重要的牙周再生的细胞来源。将它们植入牙周缺损中,可以减少探诊出血、增加临床附着水平和修复牙槽骨缺损[4-6,13]。因此,上述两种细胞均为有牙周再生潜能的干细胞。在组织工程学中,将干细胞移植到目标区域或器官时,移植细胞的黏附效率会影响再生效果[7]。同时,牙周组织破坏后能否形成理想的愈合形式,也取决于破坏区的根面会被什么细胞优先黏附及占据[2]。所以,为了发挥PDLSCs和BMMSCs重要的牙周再生作用,关键是研究如何使它们加速黏附到根面上。
目前,关于干细胞黏附的促进剂,研究较多的对象为生长因子[14-16]。生长因子可以调节细胞的多种行为,包括促进细胞迁移和黏附等[15-16]。但有学者指出,将其直接应用于机体时,存在代谢清除快、牙周再生效果有限且不可预测、使用成本较高等缺点[6]。
本研究选择了PHT作为干细胞黏附、牙周再生的促进剂,具有价格低廉、性能稳定等优点。在课题组前期的研究中,已经证实PHT可以促进rPDLSCs黏附于牙骨质片,在PHT浓度低于40 mg/L时,促进作用随浓度增高逐渐增强,但在40~100 mg/L浓度范围时,该作用与药物浓度呈负相关[12]。因此,在本实验中笔者选择的PHT浓度为40 mg/L,结果提示该浓度的PHT同样可以提高rBMMSCs在牙骨质片上的黏附数目。证明合适浓度的PHT能够促进rBMMSCs、rPDLSCs黏附于牙根面上。
整合素是一种介导细胞黏附的跨膜蛋白,它在牙周组织愈合过程中起重要作用。动物研究证实,整合素α5β1参与调节成骨细胞黏附到种植体-骨界面并成骨的过程[17]。Ivanovski,等[9]研究结果显示,整合素α5β1可以介导牙龈和牙周膜来源的成纤维细胞黏附在牙骨质上。由此,本课题组认为:PHT促进rBMMSCs、rPDLSCs黏附的作用可能与整合素α5β1的表达相关。
结果发现,PHT对rBMMSCs、rPDLSCs黏附的增强作用在加入整合素α5、β1亚基抗体后,被明显减抑制。说明整合素α5β1在rBMMSCs、rPDLSCs黏附于牙根面的过程中起到关键作用。PHT增强rBMMSCs、rPDLSCs黏附的作用也与整合素α5β1的表达密切相关。
在后续试验中,通过实时定量PCR和Western-blot方法对PHT处理前后的rBMMSCs、rPDLSCs进行分析,检测了两种细胞整合素α5β1的表达水平。实验结果表明,无论从mRNA水平还是蛋白水平,实验组rBMMSCs、rPDLSCs表达整合素α5、β1水平均高于空白对照组。这进一步解释了黏附实验的结果:rBMMSCs、rPDLSCs均表达整合素α5β1,PHT促进rBMMSCs、rPDLSCs黏附于牙骨质的作用与它上调了整合素α5β1的表达有关。
这个结果提示,PHT可以帮助有牙周再生潜能的rBMMSCs、rPDLSCs尽早黏附在牙根面,为形成与天然牙更相似的牙周组织带来可能。另外,PHT增加rBMMSCs的黏附数量与增加rPDLSCs黏附的数量相比,差异没有统计学意义。同时,PHT促进上述两种细胞间的整合素α5β1表达量相比,差异也没有统计学意义。说明PHT对rBMMSCs、rPDLSCs的促黏附作用是相似的。由于PDLCSs仅来源于牙周膜,其数量相对较少,本研究结果提示,牙周治疗中,也许可以用BMMSCs补充或替代PDLSCs的可能性。
综上所述,本研究的结果表明整合素α5β1在rBMMSCs、rPDLSCs黏附于牙骨质的过程中起着重要作用,40 mg/L PHT促进rBMMSCs、rPDLSCs黏附于牙骨质片的作用与整合素α5β1的表达上调密切相关。然而PHT是通过什么信号通路与整合素α5β1发生作用,其中的发生机制如何仍然未知,还需要做进一步研究。

