Y-box结合蛋白1通过Gli2调控肝祖细胞增殖
李飞 李兵航 郭悦承 沈波 顾天翊 曲颖 张启迪 蔡晓波 陆伦根
Y-box结合蛋白(YB-1)是一种广泛存在于细菌和人类的高度保守的转录因子,能特异性结合目的基因启动子和增强子内部Y-box序列(CTGATTGGCCAA),发挥多种重要的生物学功能,包括胚胎发育、细胞增殖、肿瘤的发生和转移等[1-4]。Didier等[5]发现,YB-1可以与人MHC II基因启动子区内含有CCAAT序列的顺式作用原件Y-box特异性结合,并抑制MHC II的转录,发挥负调控转录因子的作用。现已发现,YB-1可以与多种基因启动子或增强子结合,调控相应靶基因的转录,进而调控各种生物学功能[1]。Okamota等[6]发现,YB-1能与p53直接结合,并且在人表皮癌细胞中降低YB-1的表达促进p53的转录。因此,YB-1能通过调控多种基因启动子的转录活性抑制或促进相应蛋白的表达,进而调控细胞增殖。
研究发现,慢加急性暴发型肝炎患者的YB-1主要在肝脏胆管细胞、肝癌细胞(HPC)细胞和肝细胞中高表达。在诱导HPC增殖的小鼠模型中也发现YB-1主要在肝脏HPC中表达。因此,YB-1可能参与调控HPC增殖和肝再生。本研究拟在体外细胞实验中探索YB-1对HPC增殖的影响及其作用机制。
资料与方法
一、实验动物与材料
(一)动物 雄性C57BL/6J 小鼠,4周龄,体质量20~25 g,购自上海必凯实验动物中心,饲养于上海市第一人民医院SPF级实验动物中心。
(二)试剂 William′s E培养基、胎牛血清、L-谷氨酰胺、胰蛋白酶购自美国Gibco公司;胰岛素样生长因子-II、表皮生长因子、胰岛素购自美国Peprotech公司;Trizol购自日本Takara公司;抗YB-1、抗Gli1、抗Gli2、抗Shh、抗C-myc、抗GAPDH抗体均购自美国Abcam公司;抗Cyclin D1抗体购自美国CST公司;GANT61购自美国Selleck公司。
二、实验方法
(一)肝祖细胞分离与培养 4周龄雄性野生型C57BL/6J小鼠予50%胆碱缺乏饲料+0.1%乙硫氨酸喂养3周,制备肝损伤模型,采用胶原酶两步灌注法分离HPC,分离方法见文献[7]。采用William′s E完全培养基(含10%胎牛血清、20 ng/mL表皮生长因子、10 μg/mL胰岛素和30 ng/mL胰岛素样生长因子-II),在37℃、体积分数为0.05的CO2环境中培养。
(二)慢病毒载体系统构建和细胞转染 携带有特异性干扰YB-1表达的慢病毒载体系统由上海吉玛生物技术有限公司构建制备。对照组和实验组干扰序列如下:对照组:5′-TTCTCCGAACGTGTCACGT-3′、shYB-1#1:5′-GAGAGCAAGGTAGACCAGTG-A-3′、shYB-1#2:5′- GTCAAATGGTTCAATGTA-AGG -3′。转染前,用完全培养基重悬肝祖细胞,调整密度至2×104cell/mL,取0.5 mL接种于24孔板,共3孔,培养过夜;待细胞汇合至50%,更换培养基,分别加入20 μL病毒液,继续培养24 h,1∶5传代培养。通常在转染后第9天观察到YB-1干扰组细胞数显著减少,然后收集细胞提取蛋白和RNA进行后续实验。
(三)细胞增殖检测 CCK-8实验:采用细胞计数试剂盒(cell counting kit-8,CCK-8)检测细胞增殖情况,在96孔板加入100 μL HPC细胞悬液(2×104/mL),每组6个复孔,37℃、体积分数为0.05的CO2细胞培养箱孵育72 h;每孔加入10 μL CCK-8试剂,孵育2 h后应用酶标仪测定450 nm处的吸光度值(A)。

(四)流式细胞术 按照美国BD公司细胞周期检测试剂盒提供的说明书进行操作,制备单细胞悬液,PBS洗涤一次,预冷95%酒精冰上固定过夜,PBS洗涤后加入PI/RNase Staining Buffer 0.5 mL室温孵育30 min,PBS重悬细胞后上机检测。
(五)实时PCR 用Trizol提取总RNA,采用Nanodrop测定RNA浓度。按照Takara公司第一链cDNA反转录试剂盒(RR036A)说明书提供的操作步骤将总RNA反转录成cDNA。按照日本Takara公司SYBR Green PCR荧光定量PCR试剂盒(RR820)说明操作。PCR条件为:95 ℃变性30 s,55 ℃ 退火30 s,72 ℃延伸30 s,循环35次 。各靶基因引物序列见表1。

表1 实时PCR 引物序列
(六)高通量测序 采用带有Oligo(dT) 的磁珠(购自澳大利亚Bioclone公司)捕获带有poly A尾的mRNA,将mRNA片段化为100~200 bp大小的核苷酸片段。cDNA纯化后,进行PCR扩增、制备文库。采用HiSeq2500 平台(美国Illumina公司)进行高通量测序。所得数据与小鼠基因组进行比对,对差异表达基因进行生物本体学、信号通路分析。
(七)染色质免疫共沉淀结合高通量测序 采用Upstate公司提供的试剂盒(目录号:17-375)进行染色质免疫共沉淀,实验步骤参见试剂说明书。所得染色质经片段化、末端修复、3′末端加A、连接、片段选择及纯化、PCR扩增和纯化、以及文库质检等操作后,采用Illumina HiSeq2000平台(美国Illumina公司)测序,数据经去污染、去接头等处理后使用SOAP软件与Hgl9基因组序列进行比对,并对相关基因进行GO功能聚类分析KEGG生物通路富集分析。
(八)免疫印迹 采用RIPA裂解液提取胞质蛋白,BCA蛋白浓度测定试剂盒确定蛋白浓度。30 μg 细胞总蛋白与上样缓冲液按比例混匀,煮沸变性5 min,经 10%SDS-PAGE 电泳后,转移至 PVDF 膜上。PVDF 膜以 5%脱脂牛奶室温封闭 2 h,一抗 4°C孵育过夜。以 TBST 洗涤 3 次,每次5 min,加入HRP 标记的二抗(1∶500稀释),室温孵育 2 h,用 TBST 洗涤 3 次,每次5 min。用 ECL 化学发光。
(九)荧光素酶报告基因试验 由上海齐合生物公司构建含有小鼠Gli2基因启动子双荧光素酶报告基因重组质粒,将其分别转染至YB-1干扰组和对照组HPC,24 h 后采用双荧光素酶报告基因检测系统观察荧光素酶的表达活性。
结 果
一、YB-1调控HPC增殖
首先,通过慢病毒载体系统转染HPC并成功下调YB-1的表达。CCK-8实验显示,沉默YB-1显著抑制HPC增殖。siYB-1#1和siYB-1#2对HPC中YB-1 mRNA的抑制率分别达到67%和75%;与此相应,HPC增殖率分别下降了58%和70%。流式细胞术检测细胞周期显示,YB-1下调后G0/G1期细胞比例增加,表明沉默YB-1能阻滞细胞周期,进而抑制细胞增殖,见图1A-C。
二、YB-1调控HPC基因表达
为了进一步研究YB-1调控HPC增殖的分子机制,RNA-sequence被用来分析YB-1对HPC表达谱的影响。与对照组相比,YB-1沉默组HPC有395个基因表达上调,296个基因表达下调,如图2A。基因本体学分析(GO Analysis)表明差异基因参与多种生物学功能,包括细胞形态、细胞增殖和细胞粘附等,如图2B。KEGG分析表明差异基因参与多条重要的信号通路,包括TGF-β信号通路、ECM-receptor interaction、Hedgehog信号通路、Wnt信号通路以及MAPK信号通路,如图2C。
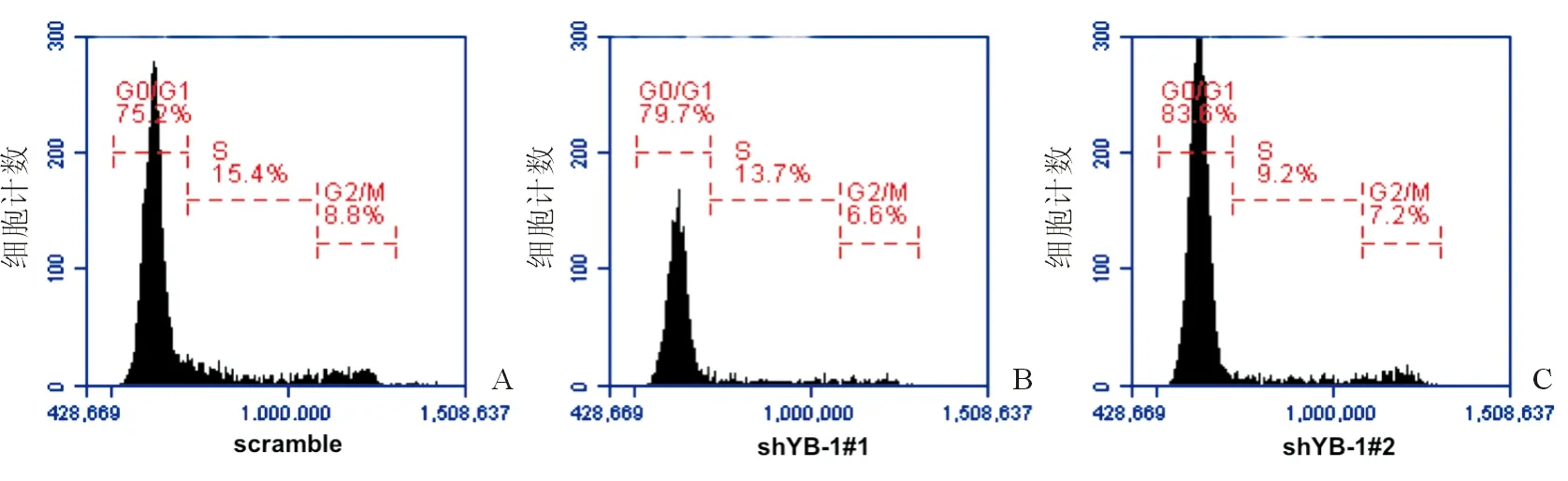
注:A- C.与scramble组相比,沉默YB-1能将更多肝祖细胞阻滞在G0/G1期图1 沉默YB-1抑制肝祖细胞增殖

注:A.YB-1调控基因表达;B.基因本体学(GO)分析;C 信号通路(KEGG)分析图2 沉默YB-1改变肝祖细胞基因表达谱
四、YB-1在HPC内靶基因分析
YB-1在HPC全基因组上有8524个结合位点,其中3609(62%)和1821(31.5%)个结合位点分别位于间区和内含子区,另外有202(3.4%)和192(3.1%)个分别位于外显子区和启动子区,如图3A。基因本体学分析(GO Analysis)表明这些靶基因具有广泛的生物学功能,如细胞形态、细胞粘附、信号通路调控等,如图3B所示。KEGG分析表明YB-1在HPC中的靶基因参与细胞粘附、Wnt信号通路、Hedgehog信号通路等,如图3C。Motif序列研究表明YB-1在HPC中的结合序列具有多样性,如图3D。
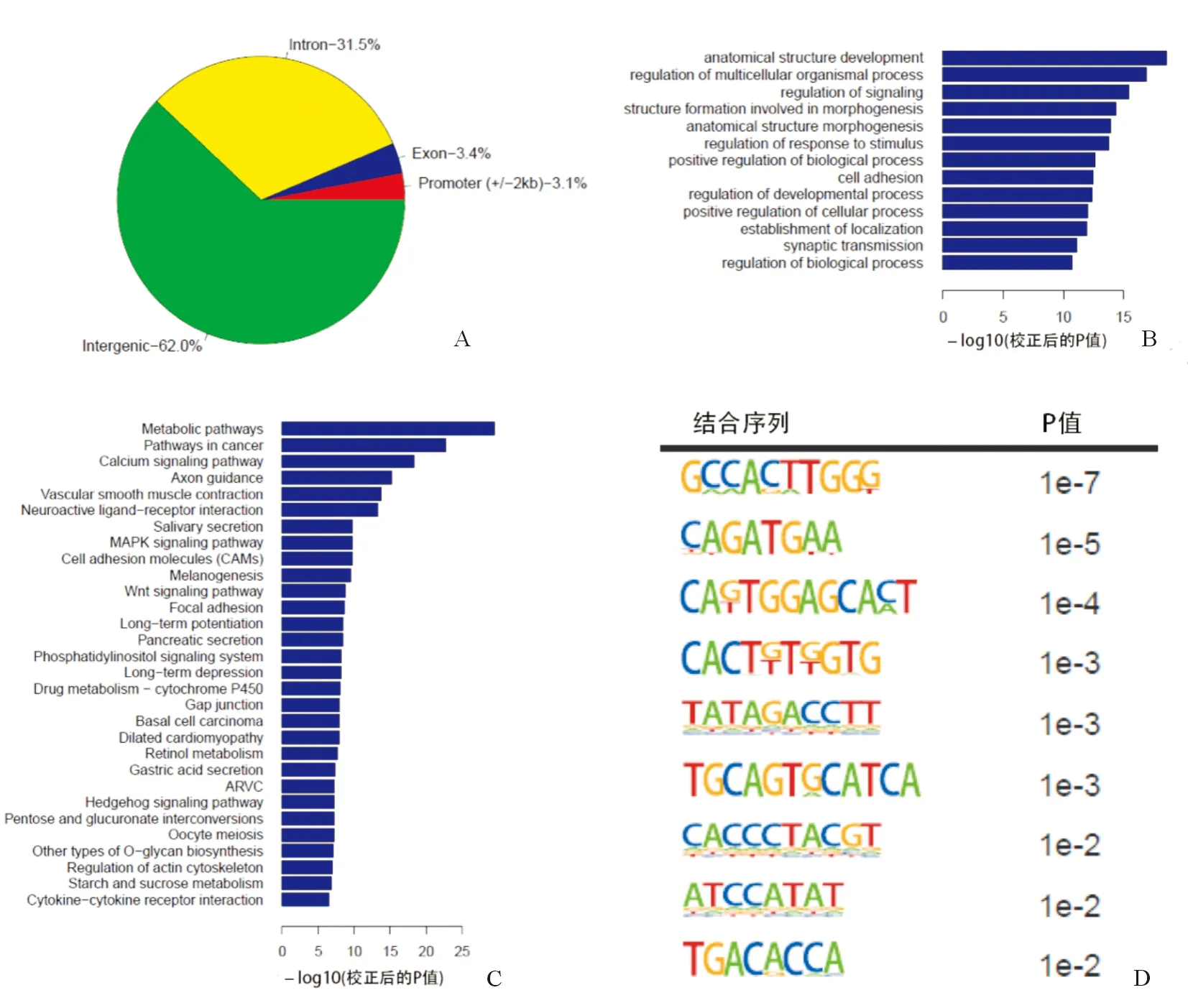
注:A.ChIP-sequence表明,YB-1在肝祖细胞全基因组上共有8524个结合位点;B.靶基因基因本体学分析;C.靶基因信号通路分析;D.YB-1在HPC中的结合序列具有多样性图3 YB-1在肝祖细胞全基因组上的靶基因
五、YB-1调控Hedgehog信号通路
RNA-sequence和ChIP-sequence均表明YB-1能调控Hedgehog信号通路,且ChIP-sequence 显示YB-1在 Gli2启动子区有结合位点。实时PCR表明沉默YB-1能下调Hedgehog信号通路的配体Shh和Ihh,受体Patched,中间信号分子Gli1和Gli2及其靶基因cyclin D1、cyclin D2、C-myc和N-myc。蛋白质印迹法也获得了相同的结果,如图4A。ChIP-PCR表明YB-1能直接结合Gli2的启动子区,如图4B;荧光素酶报告基因实验进一步表明沉默YB-1能下调Gli2启动子的转录活性,siYB-1#1和siYB-1#2对Gli2基因启动子双荧光素酶报告基因重组质粒的转录抑制效率分别达到42%和57%。

注:A.沉默YB-1抑制Hedgehog信号通路;B.ChIP-PCR表明YB-1能与Gli2启动子区结合图4 YB-1调控Hedgehog信号通路
六、Gli1/Gli2阻断剂抑制肝祖细胞增殖
为进一步验证Hedgehog信号通路能调控HPC增殖,Gli/Gli2抑制剂GANT61被用于阻断Hedgehog信号通路。CCK-8细胞增殖试验表明,GANT61能有效抑制HPC增殖并呈量-效关系,5 μm GANT61和10 μm GANT61对HPC的抑制效率分别为60%和87%。EdU细胞增殖试剂盒检测发现,对照组超过70% HPC 处于有丝分裂期,5 μm GANT61和10 μm GANT61处理组细胞处于有丝分裂期细胞数显著减少,其比例分别为32%和17%,如图5A-C。

注:A-C.EdU细胞增殖实验表明,Gli1/Gli2的抑制剂GANT61处理肝脏细胞48 h,肝祖细胞增殖受到明显抑制,进入有丝分裂期的细胞显著减少图5 Gli1/Gli2阻断剂抑制肝祖细胞增殖
讨 论
HPC活化和增殖过程较为复杂,现已发现多种因素能调控HPC的生物学行为。研究表明,肿瘤细胞因子样凋亡微弱诱导剂(TWEAK)[8]、肝细胞生长因子(HGF)[9]、表皮细胞生长因子(EGF)、成纤维细胞生长因子-7(FGF-7)、IL-6、TNF-α等细胞因子或炎症因子能调节HPC的增殖和分化[10]。本研究发现,YB-1能通过Hedgehog信号通路调控HPC的增殖。既往研究表明,YB-1能通过多种方式调控细胞增殖。Homer等[11]也发现YB-1能抑制p53的转录,导致细胞中p53的减少,抑制细胞凋亡的作用减弱,而肿瘤细胞增殖加速。Stratford等[12]发现,YB-1能通过促进EGFR的表达而促进乳腺癌的进展。此外YB-1还能促进cyclin D1的转录调控非小细胞肺癌的增殖[13]。本研究通过RNA-sequence和ChIP-sequence首次发现YB-1能够调控Hedgehog信号通路,而该通路被证实广泛参与各种干/祖细胞的增殖以及胚胎发育,并且多项研究表明该通路亦参与肝损伤后肝再生过程[14-16]。同时,ChIP-sequence确定该通路中的关键信号分子Gli2是YB-1的靶基因,并且结合位点位于启动子区,因此推测YB-1能通过Hedgehog信号通路调控HPC增殖。进一步实验证实,YB-1能与Gli2启动子区结合并正向调控其转录,Gli1/Gli2的抑制剂GANT61能抑制HPC增殖,这些结果均表明YB-1能通过调控Gli2的表达影响Hedgehog信号通路的强度,进而调节HPC的增殖。该研究结果有利于进一步认识肝细胞和肝再生的调控机制,能为急性和亚急性肝衰竭开发新的治疗方案提供理论基础。

